羰基化合物的转化反应是有机反应的重要组成部分,通过α-位点的亲核试剂对醛或酮进行加成反应被证明是非常好的合成方法。最近,通过单电子(SET)氧化方法能够实现产生α-羰基自由基物种,进而反应生成各种取代碳基化合物。在这些反应中,多种催化剂和多种策略被开发用于控制反应的选择性和手性。比如,MacMillian等发现SOMO催化经由(烯胺,enamine)自由基中间体生成烷基取代的醛(Nat. Chem. 2017, 9, 1037;J. Am. Chem. Soc. 2007, 129, 7004)。α取代的羰基自由基在和Lewis酸的反应中展现较强的反应性,能够通过手性Lewis酸对自由基进行活化。Yang等发现镁/双恶唑啉(magnesium/bisoxazoline)作用的非对称性分子内自由基-自由基级联环化反应(intramolecular radical-radical cyclization cascade)(Angew. Chem. Int. Ed. 2006, 45, 255)。此外,1,3-二羰基化合物和烯烃之间的自由基极化加成被发现是一种有效的构建杂环化合物的方法(Org. Lett. 2005, 7, 2997)。
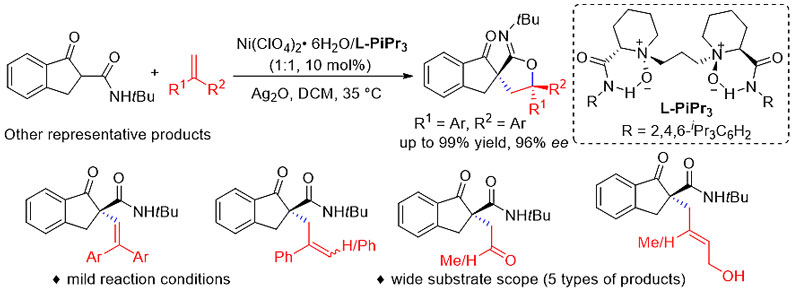
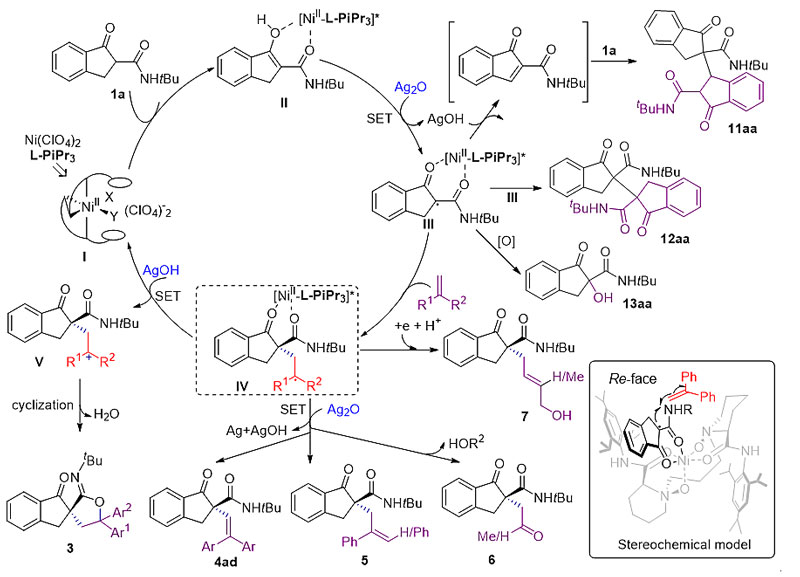
四川大学冯小明、刘小华报道了通过手性N, N’-dioxide-NiII手性催化剂和Ag2O结合,在温和条件中进行高效手性分子间的自由基交叉反应。对多种端基烯分子和茚满酮甲酰胺/酯进行了拓展,该反应通过自由基加成/环化反应过程进行,能以较高的收率(高达99 %)和较高的手性产率(高达96 % ee)生成螺亚胺内酯(spiroiminolactones)或螺甾内酯(spirolactone)。
Xiying Zhang, Wangbin Wu, Weidi Cao, Han Yu, Xi Xu, Xiaohua Liu*, Xiaoming Feng*
Enantioselective Radical‐Polar Crossover Reactions of Indanonecarboxamides with Alkenes
Angew. Chem. Int. Ed., 2020, 59, 4846-4850
DOI: 10.1002/anie.201914151
https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.201914151