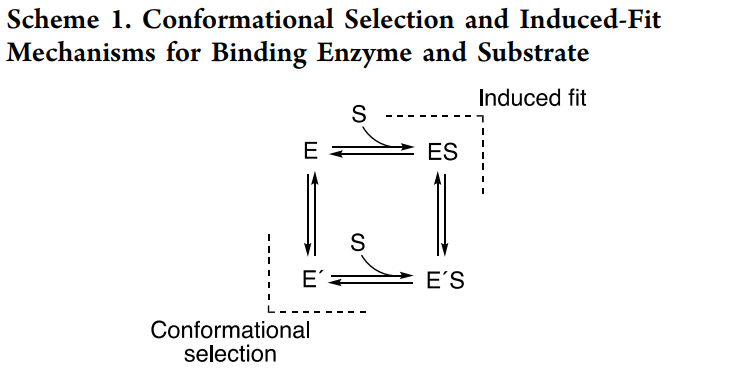
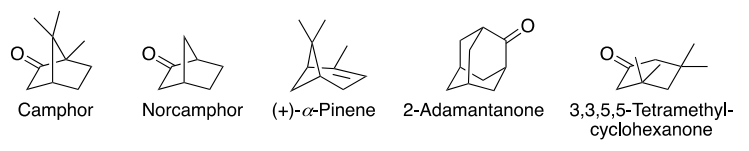
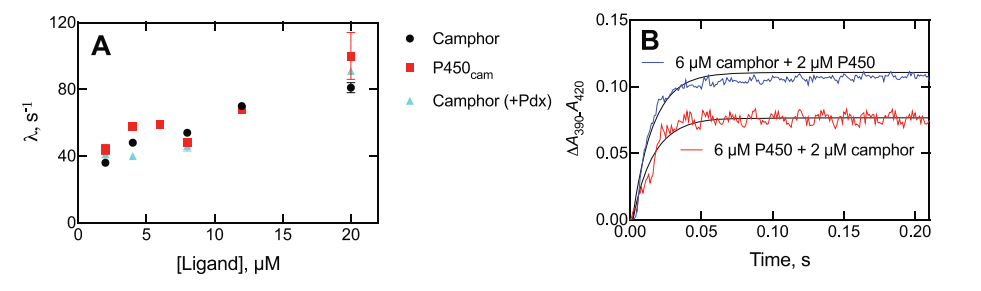
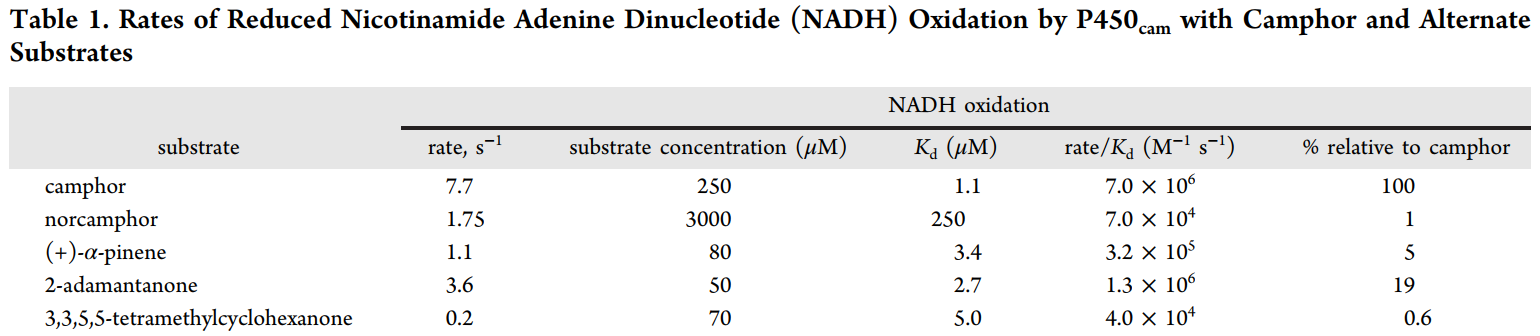
细菌细胞色素P450 101A1(P450cam)是众多P450酶结构的原型,对同源底物(樟脑)有较高的反应活性。有鉴于此,范德堡大学医学院F. Peter Guengerich等报道了通过X射线晶体学、NMR、FTIR表征对包括P450cam的多种不同P450进行表征,动力学结果显示底物结合到不同P450中的过程是一种构象选择性方式,其中底物能够结合到未配位酶的一种单独构象上,发现P450cam和底物樟脑结合的过程主要通过诱导拟合机制(induced-fit mechanism),其中酶结合樟脑后发生构象变化。这种过程通过改变樟脑、P450cam的浓度得以验证。此外,作者发现附属假单胞氧还蛋白不会改变底物的结合结构。

参考文献
F. Peter Guengerich*, Stella A. Child, Ian R. Barckhausen, and Margo H. Goldfarb, Kinetic Evidence for an Induced-Fit Mechanism in the Binding of the Substrate Camphor by Cytochrome P450cam, ACS Catal. 2021, 11, 639–649
DOI: 10.1021/acscatal.0c04455
https://pubs.acs.org/doi/10.1021/acscatal.0c04455


















