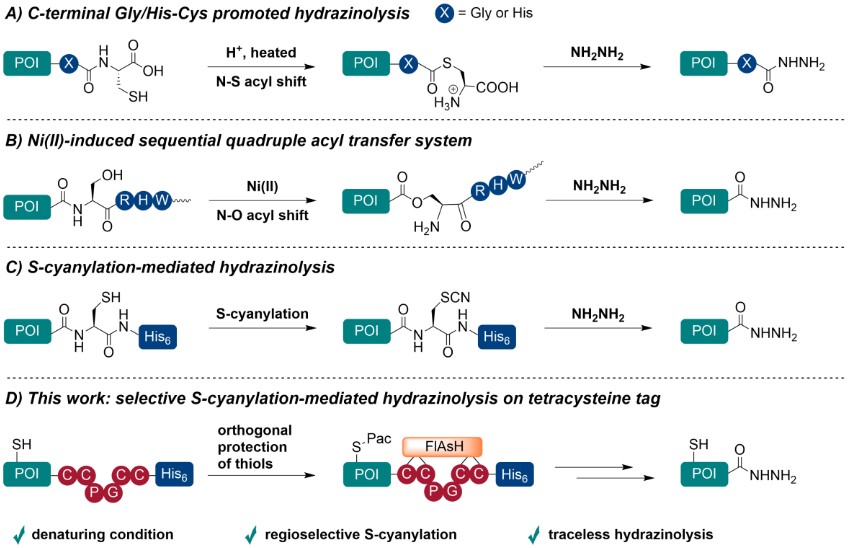
S-氰基化肽的肼解提供了一种替代方法,可以提供蛋白质α-肼——天然化学连接(NCL)中使用的关键试剂——而无需任何内肽或酶的帮助。然而,目前使用的非选择性S-氰基化,除了裂解位点的半胱氨酸外,不允许在蛋白质中除了切割位点的半胱氨酸。有鉴于此,华南理工大学的何春茂等研究人员,报道了C -末端四胱氨酸标记实现蛋白质连接和标记。
本文要点
1)研究人员报告了一种区域选择性S-氰基化和肼解策略,该策略是通过将四半胱氨酸标签融合到相关蛋白质的C-末端实现的,研究人员将其称为四半胱氨酸激活的蛋白质连接(TCEPL)。
2)虽然具有高度选择性,但该策略适用于以包涵体形式表达的蛋白质,铁硫蛋白-红氧还蛋白的高效半合成以及含有207个氨基酸残基的基质金属蛋白酶-14(MMP-14)的催化和铰链结构域证明了这一点。
3)此外,TCEPL策略被用于带有多种官能团的氨基试剂蛋白质C末端标,,证明了其多功能性和通用性。
参考文献:
Zeyuan Mo, et al. Protein Ligation and Labeling Enabled by a C-Terminal Tetracysteine Tag. Angew, 2022.
DOI:10.1002/anie.202115377
https://onlinelibrary.wiley.com/doi/10.1002/anie.202115377


















