直接和立体选择性方式对C(sp3)-H化学键官能团化修饰是一种高效制备高附加值化学品,近日人们发展了Fe催化不对称氮烯转移反应,将羧酸转化为立体结构的非天然α-氨基酸的方法,能够克服C-H键氨基化反应的反应性和选择性缺陷。有鉴于此,威斯康星大学麦迪逊分校Jennifer M. Schomaker等总结该反应的进展。
本文要点
(1)
在过去的二十年,人们发展了过渡金属介导氮烯转移的方式实现对惰性C(sp3)-H化学键直接修饰含氮官能团,氮烯转移反应能够用于复杂有机分子的后期官能团化修饰,反应具有非常高的反应活性和原子经济性,以及非常好的官能团兼容。一些研究组和研究人员发展了具有化学/位点/立体选择性的氮烯转移反应方法学,从而显著的拓展了该反应方法的种类和应用场景。但是目前大多数的反应方法是分子内C-H键氨基化。
(2)
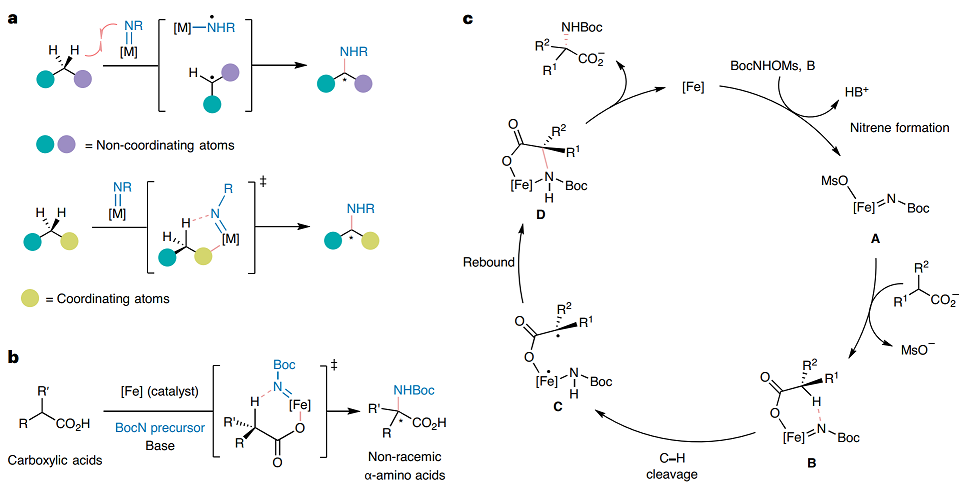
相比而言,分子间C-H键由于缺少预先安装官能团,因此产生非常大的困难区别分子中非常类似的C-H键。特别是如何设计分子间不对称C-H键氮烯转移反应,并且实现对不同C-H化学键的区分。目前早期的分子间C-H键不对称氨基化反应表现非常少的底物种类和立体选择性,但是近期人们发展了更加复杂 的配体结构,能够通过非共价相互作用实现对立体选择性的控制。但是这种复杂结构配体的设计理念限制了更加广泛的应用场景,而且无法实现对大宗化学品进行立体选择官能团化修饰。
(3)
近日,人们报道了将羧酸作为导向官能团参与氮烯插入反应,并且通过手性铁催化剂实现反应的立体选择性调控。虽然使用贵金属催化剂对羧酸能够通过内球环金属化进行直接C-H键活化。该反应具有催化剂结构简单的特点,使用高丰度的Fe作为催化剂,使用手性模块配体双(苯并咪唑)-二吡咯烷配体。而且,该反应能够通过普通的N保护官能团修饰氨基,说明该反应能够用于后期官能团化修饰。
参考文献
Tuan Anh Trinh & Jennifer M. Schomaker, Unnatural α-amino acid synthesis, Nat. Synth (2023).
DOI: 10.1038/s44160-023-00278-7
https://www.nature.com/articles/s44160-023-00278-7




















