免疫系统 T 细胞的任务是识别和破坏体内已感染入侵病原体的细胞。CAR T细胞是专门设计用于识别癌细胞并摧毁它们的 T 细胞。CAR T细胞已经在临床上用于治疗淋巴瘤,许多临床试验正在进行中,以评估 CAR T 细胞治疗对其他形式癌症的使用。
CART 细胞疗法在对抗表达 CD19 的 B 细胞恶性肿瘤方面取得了前所未有的成功,这一成功已获得 FDA 的两项批准,并激发了数百项正在进行的临床试验。然而,尽管 CAR T 细胞疗法在治疗人类恶性肿瘤方面具有革命性的潜力,但与生产临床级 CAR T细胞相关的复杂程序和成本是广泛临床应用的主要障碍。
治疗性 CAR-T 细胞的制造需要一系列广泛的步骤,包括:
(1)通过白细胞分离术从患者身上收集 T 细胞并将其运送到制造中心;
(2) 在良好生产规范条件下使用病毒载体激活、扩增和改造 T 细胞的劳动密集型程序;
(3) 生产细胞的质量控制;
(4) 将最终的CAR-T 细胞产品运送到医院并重新输注到患者体内。整个制造过程的成本可能高达 50 万美元,并且可能需要数周时间。
这也导致了CAR T 细胞治疗的一个主要缺点是它非常昂贵——每剂数十万美元(约120万RMB)。由于其成本,许多人被排除在这种治疗之外。
因此,全球都迫切希望解决与制造时间和成本相关的 CAR T 治疗挑战。
鉴于此,北卡罗来纳大学教堂山分校/北卡罗来纳州立大学Yevgeny Brudno等研究人员描述了一种用于 T 细胞工程和释放的可植入多功能藻酸盐支架(Multifunctional Alginate Scaffold for T Cell Engineering and Release, MASTER),它简化了体内 CAR-T 细胞的制造并将处理时间从几周缩短到一天。


设计目的
MASTER可以直接装载患者来源的 T 细胞和编码 CAR 的病毒颗粒,并在同一天植入以在体内生成 CAR-T 细胞。MASTER技术旨在 (1) 装载T细胞和病毒颗粒;(2)刺激T细胞活化和增殖;(3)促进T细胞转导;(4) 局部扩增 CAR-T细胞和 (5) 可持续释放功能齐全的 CAR-T细胞以控制肿瘤生长。

图|两种技术对比
材料构建
海藻酸盐因其生物相容性、生物降解性、温和的凝胶化要求以及作为细胞培养的三维 (3D) 结构的广泛应用而被选为该多功能支架 (MASTER) 的基础。最初需要在支架中使用大孔,以便为细胞和逆转录病毒(RV)之间的有效接触提供界面,随后将营养物质大量转移到增殖的 CAR-T 细胞。在 MASTER 中通过温和的冷冻凝胶化实现了大孔隙率。
为了促进支架内的 T 细胞活化,环辛炔偶联的抗CD3和抗CD28抗体通过温和有效的无铜点击化学固定在叠氮化物修饰的海藻酸盐上。此外,为了激活和扩展支架内的 T 细胞,细胞因子 IL-2 被物理封装在支架中,物理封装使IL-2 能够在 5 天内持续释放,同时保持释放的 IL-2 的生物活性。植入后,这些白细胞介素开始渗出,促进 CAR-T 细胞的快速增殖。

图|MASTER 促进原代人 T 细胞的活化和逆转录病毒介导的转导
生物指导性支架可作为体内CAR-T 细胞工厂
研究人员经过体内淋巴瘤异种移植肿瘤模型,在淋巴瘤再攻击模型和更成熟的淋巴瘤肿瘤模型进行了体内抗肿瘤研究,在前俩个模型中,MASTER在控制肿瘤生长和显著提高存活率方面更有效。在挑战MASTER极限的更成熟的淋巴瘤肿瘤模型中,发现使用 MASTER 生产的 CAR-T 细胞在控制肿瘤生长方面同样与传统 CAR-T 细胞具有相同的功能,但具有更好的扩增和持久性。值得注意的是,MASTER 大大降低了 CAR-T 细胞生产的时间、复杂性和成本。
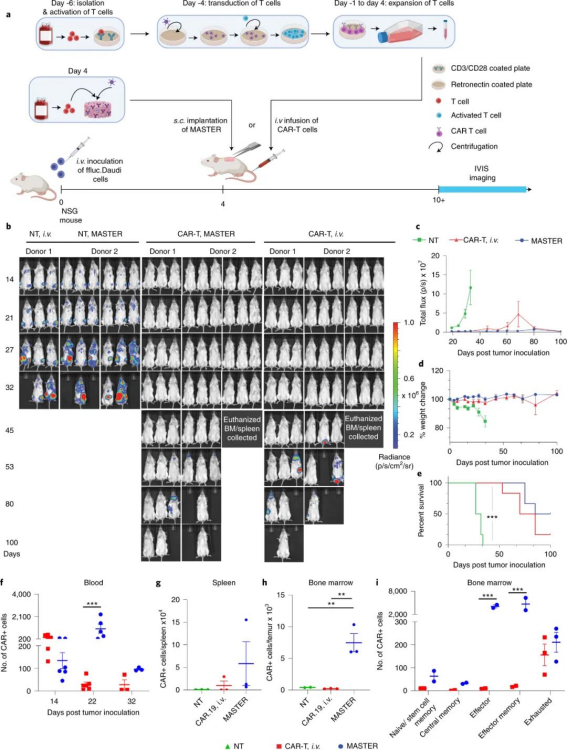
图|皮下植入的 MASTER 在淋巴瘤异种移植模型中产生并释放功能齐全的 CAR-T 细胞

图|在淋巴瘤的再攻击模型中,皮下植入的 MASTER 优于静脉注射的 CAR-T 细胞

图|MASTER 和常规 CAR-T 细胞对体内已建立的肿瘤表现出相同的抗肿瘤功效
小结:
综上所述,本文介绍了一个多功能支架,将 CAR-T 细胞制造和递送的关键方面整合到一个平台下,将 CAR-T 细胞制造的整个过程缩短到一天。该支架使用 FDA 批准的非免疫原性材料,为 αCD3 介导和 αCD28 介导的细胞活化和白介素介导的增殖创造了一个局部的培育环境。
MASTER提供了一种模块化平台技术,可用于重新编程其他免疫细胞或提供免疫调节因子以协同支持细胞功能。除了其在癌症治疗方面的潜力之外,MASTER 技术可能会激发新的治疗方法,利用重新编程和释放治疗细胞的能力。
参考文献:
Agarwalla,P., Ogunnaike, E.A., Ahn, S. et al. Bioinstructive implantable scaffolds forrapid in vivo manufacture and release of CAR-T cells. Nat Biotechnol (2022).
https://doi.org/10.1038/s41587-022-01245-x











