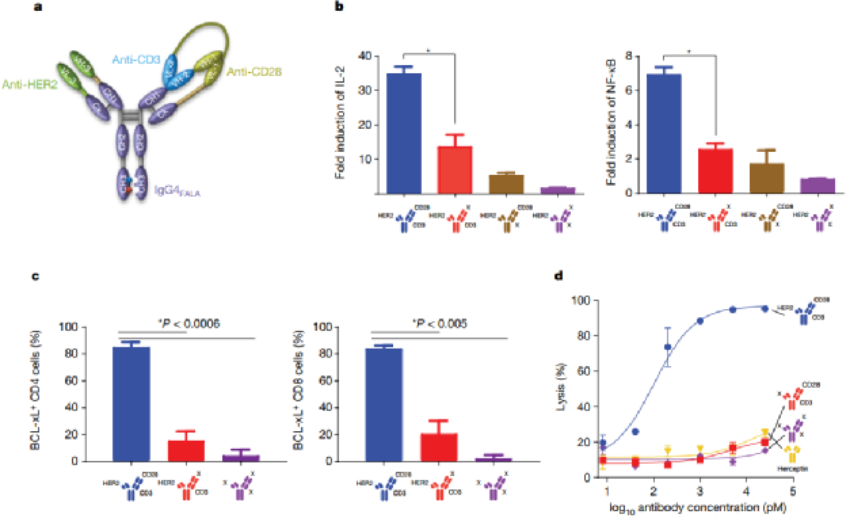
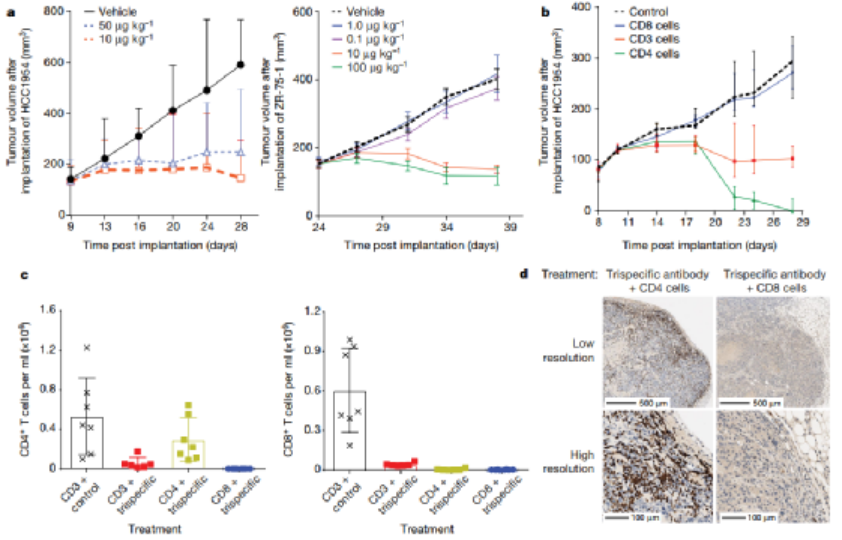
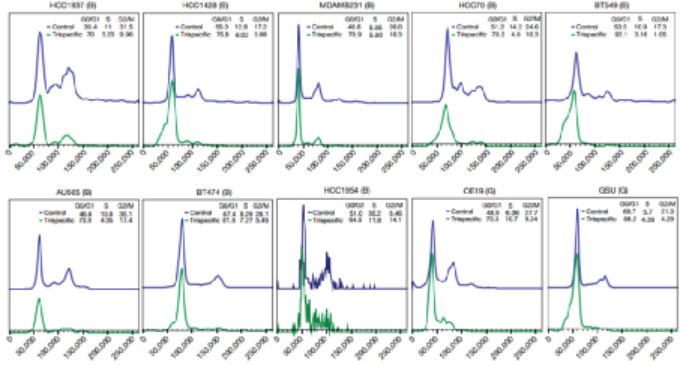
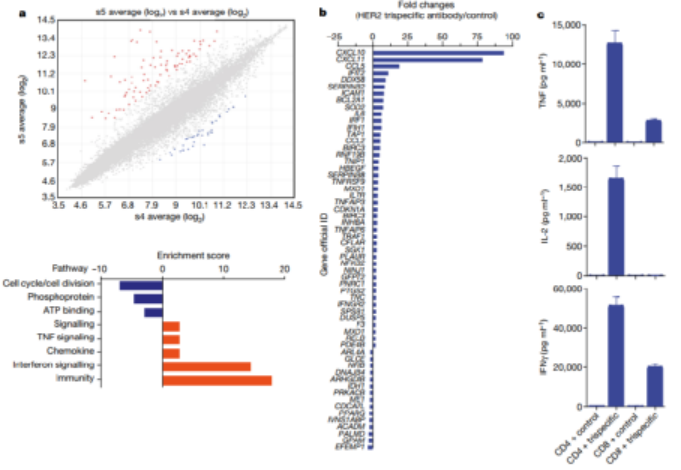
免疫治疗的最新进展彻底改变了癌症治疗的临床试验。在成功的免疫疗法中,已获批准的双特异性抗体(如blinatumomab)激发了人们对其他多特异性抗体疗法的兴趣。HER2是人类表皮生长因子受体酪氨酸激酶家族的成员,在乳腺癌、胃癌和其他癌症中高度表达。例如三阴性乳腺癌表达生理水平的HER2,并且对HER2靶向单克隆抗体治疗具有抗性。为了开发针对此类恶性肿瘤的高效疗法,赛诺菲公司Gary J. Nabel、Zhi-yong Yang和Lily Pao等人首先通过分析抗体结合位点、位置和双特异性结合臂接头来确定三特异性抗体的成分,之后通过瞬时转染制备三特异性抗体,得到了一种由HER2、CD3和CD28组成的三特异性抗体(图1)。1)三特异性抗体不但能够与肿瘤相关抗原和激活T细胞相结合,还能够结合T细胞表面的另一个,延长T细胞的抗肿瘤效果。2)该研究证实了CD4细胞通过在G1/S阻断癌细胞周期进程发挥抗增殖作用,这是一种以前未被认识的恶性肿瘤免疫控制机制。图 1. 三特异性抗体对HER2体外免疫激活的性能。为了确定T细胞亚群在肿瘤消退中的作用,将纯化的CD3、CD4或CD8细胞过继转移到植入了HCC1954乳腺癌细胞的人源化小鼠中。纯化的CD3或CD4细胞的过继转移刺激了几乎完全的肿瘤消退(图2)。相比之下,CD8细胞单独发挥最小的抗肿瘤作用。可能是由于在没有辅助T(TH)细胞的情况下存活率低,因为在CD8 T细胞重组的小鼠中未显示可检测到的CD8细胞。尽管BCL-xL表达,但激活并扩增的CD8 T细胞的凋亡率增加,这可能导致在没有CD4 T细胞帮助的情况下它们的数量很少。这一结果说明CD4细胞在介导肿瘤消退中的重要性。图 2. 人源化小鼠模型中HER2三特异性抗体对肿瘤生长的影响。为了进一步探索这种机制,作者考察了CD4细胞是否对HER2+人类乳腺癌和胃癌细胞系中发挥直接抑制作用(图3)。值得注意的是,所有10种细胞系在细胞周期的G0/G1期均显示出明显的积累,处理组的G1/S生长停滞。相比之下,在CD8细胞存在下,与三特异性抗体孵育的肿瘤细胞系显示出细胞周期分布的变化较小。这些数据表明,三特异性抗体通过不同且互补的效应机制刺激CD4和CD8细胞裂解人乳腺癌细胞。图 3. 三特异性抗体刺激的CD4 + T细胞抑制HER2 +乳腺癌和胃癌细胞的细胞周期进程和/或增殖。为了表征暴露于T细胞亚群后乳腺癌细胞基因表达的变化,在三特异性或阴性对照抗体存在下,在暴露于CD4或CD8细胞1天后,通过对HCC1954细胞进行基因表达谱分析(图4)。结果表明,CD4和CD8 T细胞通过不同的机制发挥其抗肿瘤活性。而且,CD4细胞直接影响肿瘤细胞周期进程,这是一种以前未被认识的恶性肿瘤免疫控制机制。图 4.三特异性抗体刺激CD4 + T细胞在乳腺癌细胞系HCC1954中抑制细胞周期进程和/或增殖并刺激炎症反应。总之,作者证明了HER2、CD3和CD28的三特异性抗体通过CD4细胞依赖性抑制肿瘤细胞周期,从而实现乳腺癌的消除。尽管CD8 T细胞在体外直接介导肿瘤消除,但CD4 T细胞通过在G1/S阻断癌细胞进程周期发挥抗增殖作用,并刺激细胞的炎症反应。该三特异性抗体技术有助于从多靶点刺激更有效的肿瘤消退,改善多种人类癌症的治疗。Edward Seung,et al. A trispecific antibody targeting HER2 and T cells inhibits breast cancer growth via CD4 cells. Dio: 10.1038/s41586-022-04439-0.全文链接:https://www.nature.com/articles/s41586-022-04439-0