抗肿瘤免疫的成功建立需要抗原特异性淋巴细胞的活化、扩增和分化。在很大程度上,这一过程是由T细胞和抗原呈递细胞(APC)之间的相互作用决定的。因此,对APC功能的控制是需要T细胞刺激的治疗策略的关键一步。CD8+细胞毒性T淋巴细胞(CTL)的激活已被证明是肿瘤免疫治疗的关键因素。这一过程依赖于APC的主要组织相容性复合体I类(MHC-I)分子向T细胞递送的肿瘤衍生多肽。传统疫苗,包括多肽和蛋白质疫苗,依赖于与宿主APC的随机相遇,而不适当的相遇可能导致免疫反应的沉默。CD8+ T细胞的激活也过度依赖于有效的抗原交叉呈递。这两种情况都可以解释目前癌症疫苗的一些缺点。
在一项广泛测试的称为 DC 疫苗的临床应用中,DC 前体从癌症患者中分离出来,暴露于离体的蛋白质肿瘤抗原(抗原负载),并在重新输注给患者之前完全成熟。这种形式的细胞疗法在癌症患者中显示出有希望的临床疗效,尽管通常是坊间传闻。迄今为止较少实验的方法需要向患者施用由负载抗原的DC自发释放的细胞外囊泡。这种称为 DC 纳米囊泡 (DCNV) 的无细胞制剂可以在其表面展示激活 CTL 所必需的分子机制和肿瘤抗原。因此,它们可能保留了亲本 DC 的抗原呈递能力。然而,尽管临床前结果令人鼓舞,但 DCNV 未能引发抗原特异性 CTL,并且在早期临床试验中未能在癌症患者中获得客观反应。
鉴于此,厦门大学刘刚和新加坡国立大学陈小元等人报告了一种新型纳米疫苗制剂,该制剂整合了抗原自我呈递和免疫抑制逆转 (Antigen self-presentation and immunosuppression reversal,ASPIRE),用于个性化癌症免疫治疗。成果发表在Nature Nanotechnology上。

主要思路
ASPIRE纳米囊泡是由未成熟的DC生产的。抗PD-1单链抗体通过质粒转染法在树突状细胞中表达,随后通过Adv转导肿瘤抗原。通过Adv转导,DC获得成熟和激活的表型,其特征是MHC-I和共刺激分子(CD80和CD86等)表达增强。然后,从培养的树突状细胞中提纯ASPIRE纳米囊泡,并接种到携带肿瘤的小鼠体内,在那里它们到达肿瘤引流的淋巴结(归巢效应)。在淋巴结中,ASPIRE纳米囊泡通过抗原呈递、CD28/B7共刺激和PD-1阻断等方式接触并激活CTL。此外,与需要递送至 APC 的传统疫苗不同,ASPIRE纳米疫苗能够将新抗原直接呈递给 CD8+T 细胞,我们称之为“抗原自我呈递”,从而刺激强烈的 CTL 反应。
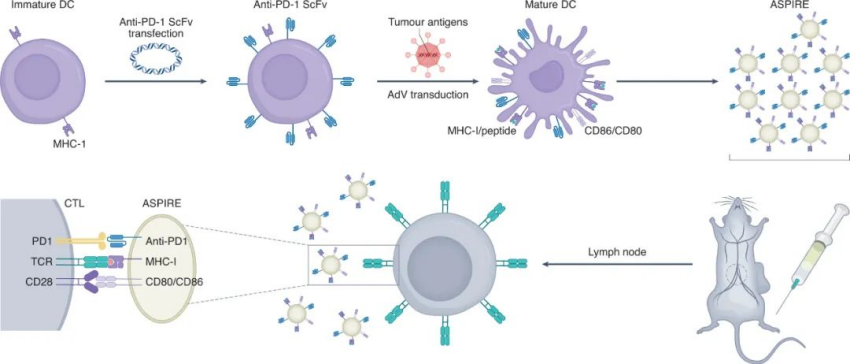
图|ASPIRE 在小鼠中诱导保护性抗肿瘤免疫
DCNV直接刺激T细胞
研究人员通过腺病毒载体(AdV)转导从经过修饰以表达特定肿瘤抗原的小鼠DC中分离出DCNV。除了内源性表达肿瘤抗原和在MHC-I分子上呈递肿瘤多肽外,与病毒感染相似的 AdV 转导过程自身激活了 DC。因此,质谱仪分析表明,DC和DCNvs都显示了对DC归巢到淋巴结(例如CCR7、ICAM-I)、抗原提呈(MHC-I)和T细胞共刺激(例如CD80、CD86和CD40)重要的激活分子。抗原提呈(信号1)和T细胞共刺激(信号2)都是CTL激活的重要步骤。

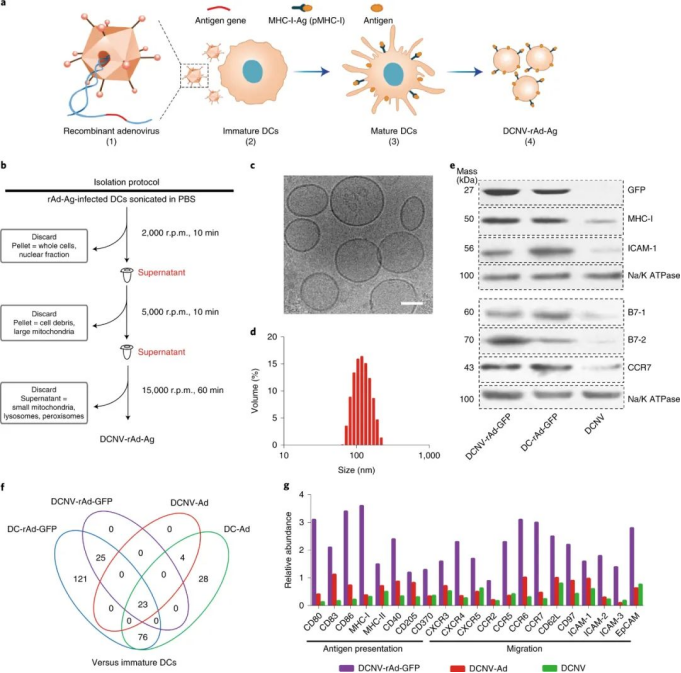
图|工程化DCNV-rAd-Ag和表征
在第一系列肿瘤研究中,研究人员使用了用OVA转基因转导的 DCs 和癌细胞。DCNVs在细胞培养中直接激活OVA特异性T细胞。此外,它们诱导OVA 特异性 CTL 的强烈扩增,并在小鼠中反复输注后抑制表达 OVA 的肿瘤的生长。有趣的是,作者发现 DCNV在其抗原呈递能力受损的转基因小鼠中也有效,这表明DCNV在小鼠中诱导抗肿瘤CTL的机制可能涉及直接的T细胞刺激,而不需要内源性(组织驻留的)DC摄取DCNV。相反,早期的研究表明,负载抗原的 DCNV 通过将肽/MHC-I 复合物转移到内源性 DC 间接刺激 T 细胞反应。然而,具体的制造过程可能是这些差异的基础。例如,上调 DCs 中 MHC-I 和共刺激分子的AdV 转导可能赋予 DCNVs 直接启动幼稚 T 细胞的能力,而直接负载DC或DCNV的抗原可能无法达到同样的结果。

图|DCNV-rAd-Ag 用于抗原自我呈递和 LN 靶向
ASPIRE的强抗肿瘤效果
虽然DCNV对高免疫原性的OVA表达的肿瘤有效,但它们无法排斥免疫原性较低的肿瘤。事实上,从转导了三种黑色素瘤抗原(包括新抗原)的DC中分离出的DCNV并不抑制小鼠B16-F10黑色素瘤的生长,该黑色素瘤在所有癌细胞中都表达这三种抗原。进一步的研究表明,荷瘤小鼠淋巴结中的CTL表现出耗竭的表型,其特征是高表达抑制性免疫检查点PD-1。
为了克服CTL耗竭和逆转免疫抑制,研究人员改造DC在其质膜上展示针对PD-1的单链抗体片段(ScFv),然后再通过Adv转导这三种黑色素瘤抗原。由此产生的DCNV制剂(也就是ASPIRE),在所有小鼠中导致了完全的B16-F10肿瘤排斥反应,而单链抗体未经修饰的抗原呈递DCNV与游离PD-1单抗的组合仅在40%的小鼠中实现了肿瘤排斥反应。与这些发现一致的是,与联合治疗相比,ASPIRE在更大程度上减少了荷瘤小鼠中PD-1+CD38high 功能障碍的CTL。
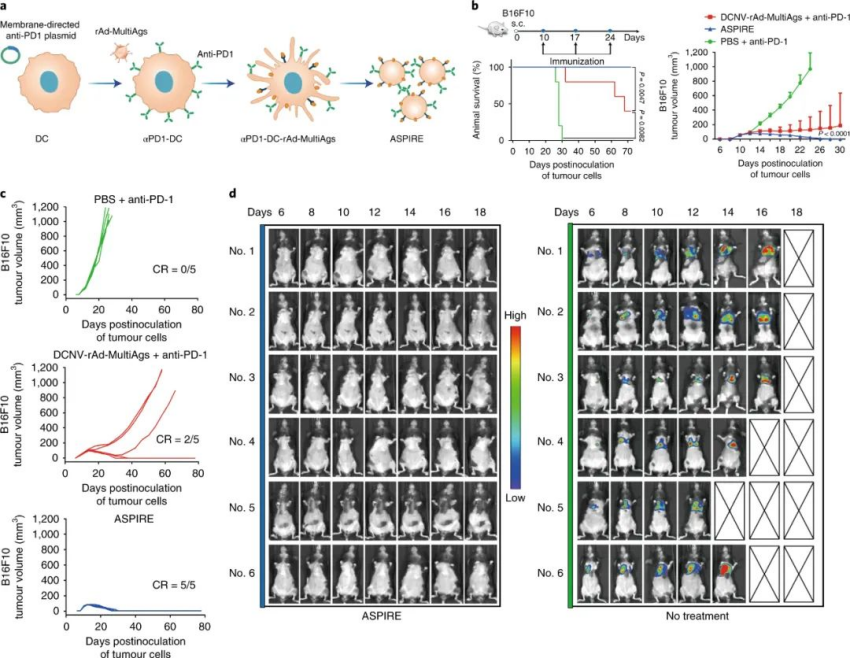
图|ASPIRE疫苗提高抗肿瘤效果
目前尚不清楚 ASPIRE 是否会通过抗原扩散过程诱导有效的 CTL 介导的免疫反应,以对抗缺乏靶向(新)抗原的肿瘤细胞亚克隆的遗传异质性癌细胞。尽管如此,该启发性结果表明,空间和时间耦合的抗原呈递、T 细胞共刺激和 PD-1 阻断对于 DCNV 充分发挥抗肿瘤 CTL 的功效,同时缓解肿瘤诱导的免疫抑制是必要的。

图|ASPIRE 疫苗通过整合抗原自我呈递和免疫抑制逆转来增强免疫治疗,并在异质肿瘤中诱导级联免疫反应。
临床化潜能
该临床前研究结果应该会鼓励增强型DCNvs用于癌症免疫治疗的临床转化。值得一提的是,虽然 ASPIRE 制剂的生产比 DC 疫苗的生产要复杂一些,但 ASPIRE 的化学、制造和控制并不是主要问题,因为我们已经建立了规模化合成的标准操作程序对膜囊泡进行适当的质量控制。与常规DC疫苗相比,无细胞ASPIRE在储存和长途运输方面具有独特的优势,大大降低了生产成本和劳动强度。
小结:
总之,本文开发了一种新型纳米疫苗平台,能够激活免疫反应并打破免疫耐受。已经证明了它能够刺激强大的 CTL 反应并增强免疫检查点阻断,并具有显着的治疗效果。由于 ASPIRE 对天然形式的大蛋白质插入具有耐受性,该方法为生产个性化癌症疫苗提供了一种强大而简便的方法。此外,该平台技术也可能普遍适用于治疗其他疾病,例如慢性病毒感染。
参考文献:
Liu, C., Liu, X., Xiang,X. et al. A nanovaccine for antigen self-presentation and immunosuppressionreversal as a personalized cancer immunotherapy strategy. Nat. Nanotechnol.(2022).
https://doi.org/10.1038/s41565-022-01098-0











