通常情况下,注射疫苗后需要留观半小时以上以确定注射者是否产生过敏反应,方便及时应对。然而目前只能建议对于首次出现过敏反应的患者,应避免第二次用药,其潜在机制尚不清楚,未来反应的风险无法预测。那么该如何从已知的经验中获取有效的措施来应对SARS-CoV-2 mRNA疫苗的罕见超敏反应呢?
近日,来自美国马里兰州弗雷德里克国家癌症研究所Marina A. Dobrovolskaia教授在Nature Nanotechnology发表的这篇综述就详细的描述了如何将从纳米药物中汲取的经验教训用于应对SARS-CoV-2 mRNA疫苗的罕见超敏反应。

由病毒病原体(例如流感、呼吸道合胞病毒和严重急性呼吸综合征冠状病毒2型(SARS-CoV-2))引起的呼吸道感染在世界范围内造成大量死亡和发病率。疫苗是对抗传染病最有效的工具之一,但它也会产生副作用。超敏反应是其中一种严重的不良反应,需要住院治疗,如果治疗不及时,可能会致命。
目前超过10亿人接种SARS-CoV-2 mRNA疫苗,疫苗的过敏反应率非常低。然而,最近的报告表明,SARS-CoV-2疫苗的过敏反应总发病率高于传统疫苗,疫苗制造商和监管当局已发出警告,呼吁特别关注高风险人群,强制进行30分钟疫苗接种后监测,以便在发生过敏反应时提供药理学干预。
在许多方面,受影响的疫苗接种者经历的过敏症状类似于纳米药物的输注反应(下图)。于是研究人员分享了十年来纳米药物研究的经验教训,并讨论了目前关于个别或共同导致纳米药物输注反应的几个因素。利用这些认识为基于脂质纳米粒的SARS-CoV-2 mRNA疫苗领域提供有效的参考信息;了解超敏反应背后的机制将有助于医学界开发管理这些反应、防止重大影响和死亡的方法,从而减少人们对这些疫苗的焦虑和恐惧。
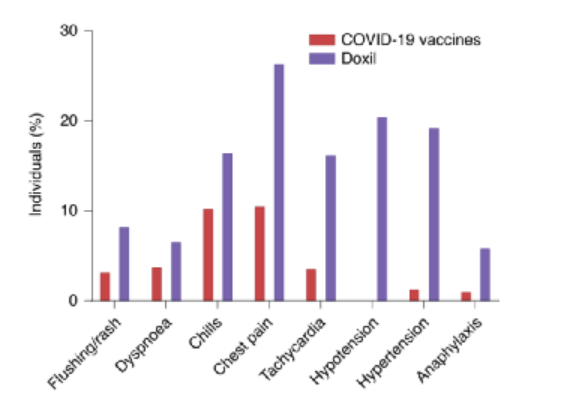
图|SARS-CoV-2 mRNA疫苗接种者的一些症状与纳米药物治疗患者相似(例如:皮疹、呼吸困难、寒战、胸痛、心动过速、低血压、高血压和过敏反应)
首先,先对LNP–mRNA疫苗进行简单的概述:
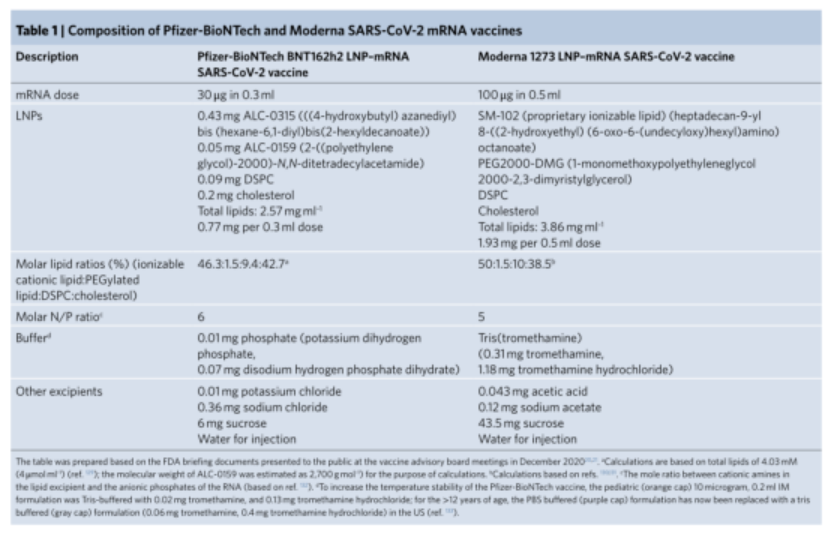
(1)疫苗的成分和理化性质:辉瑞-生物技术公司和Moderna公司使用LNP作为mRNA递送载体(下表)。两个公司疫苗的mRNA分子在核苷类型、序列及剂量、PEG端基和与PEG结合的脂质等方面有所不同;但具有类似成分的LNP,如100nm的球形结构,具有电子致密的核心、在这些球体内部,mRNA、可电离阳离子脂质和水分子形成一个倒六边形相,而外壳包含PEG脂质、部分胆固醇和DSPC23-25。
(2)疫苗的药理学和作用机制:LNP–mRNA在SARS-CoV-2疫苗中的命运尚不清楚,关于人类注射后LNP–mRNA分布和mRNA表达的详细信息也并不详尽。目前还没有关于人类接种i.m.LNP–mRNA疫苗后会发生什么的数据。但现有的有限研究提供了有关LNP–mRNA时空转运和抗体形成的重要信息,并表明局部耐受性和蛋白质表达水平与免疫原性无关。
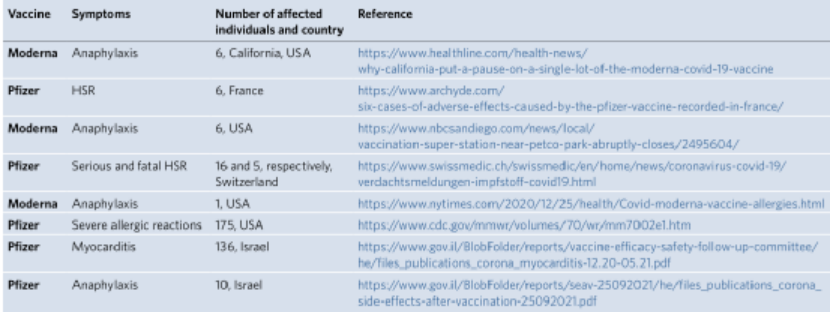
接着,讨论了LNP-mRNA疫苗引起超敏反应的潜在机制。并总结了一些早期在线报告,这些报告强调了2020-2021年免疫接种初期阶段对SARS-CoV-2疫苗的副作用(下表)。
(1)系统性的补体激活:SARS-CoV-2 mRNA疫苗至少提供三种成分(聚乙二醇化LNP载体、mRNA有效载荷和表达的刺突蛋白抗原)可以激活补体系统。在补体也存在的间质间隙和淋巴管中,注射后可发生激活,在颗粒分布到体循环后也可发生激活(图a)。目前尚不清楚注射的SARS-CoV-2疫苗是否或在多大程度上进入体循环。
(2)胞内补体:虽然在辉瑞生物技术公司和Moderna公司使用的LNPs还没有被研究过,但阳离子纳米颗粒已被发现在膜损伤相关过程中激活细胞内补体系统,类似于阳离子脂质使mRNA从溶酶体逃逸到细胞质。因此,如果可电离的疫苗脂质确实诱导了细胞内补体的激活,它可能与mRNA的胞质翻译相一致,正好能及时刺激APC-T细胞相互作用。关于疫苗中的佐剂、mRNA或刺突蛋白是否能激活细胞内补体尚无数据。
(3)肥大细胞通过IgE和非IgE机制激活:由于抗PEG IgE的存在,SARS-CoV-2 mRNA疫苗确实存在超敏反应的可能。
(4)细胞因子介导的超敏反应:阳离子脂质是实验性疫苗的常见纳米载体,可诱导广泛的细胞因子、趋化因子等。阳离子分子也可触发炎性小体激活,趋化因子介导的中性粒细胞招募对致敏至关重要。此外,SARS-CoV-2刺突蛋白包含超级抗原的序列和结构基序,超级抗原是导致过度炎症综合征的原因。
(5)血小板,凝血和缓激肽系统:含有阳离子部分的纳米颗粒可激活血小板,血小板通过释放生物活性分子(如ATP、血栓素和趋化因子)和脂类炎症分子(如血小板活化因子)促进过敏反应。血小板凝集因子是炎症的中心,触发血管周围肥大细胞脱颗粒,导致炎症反应和组织损伤;缓激肽的激活导致血管通透性增加,这与过敏性患者的低血压有关。
(6)氧化应激:氧化应激与某些药物(例如磺胺类药物)的过敏反应有关,是纳米颗粒介导毒性的常见原因。
(7)常见可变免疫缺陷(CVID):CVID是一种以补体系统过度活动为特征的疾病,CVID患者可能容易出现由LNP - mRNA疫苗引发的补体介导的毒性。
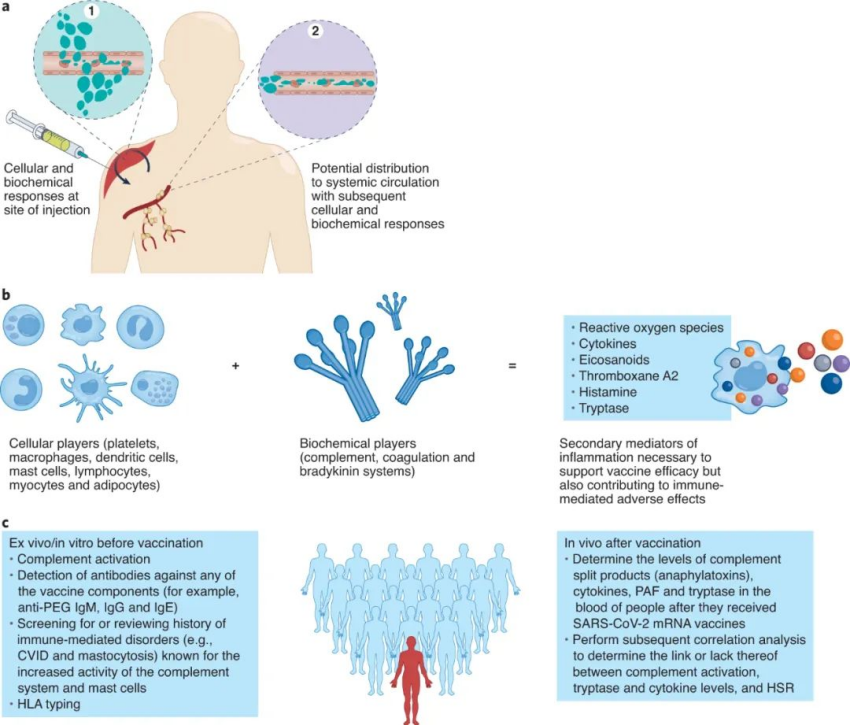
图|不良影响及克服策略
小结与展望:
总而言之,LNP–mRNA疫苗的所有成分(载体、mRNA、佐剂和表达抗原)对广泛的效应细胞和靶细胞(心肌细胞、APC、T和B淋巴细胞、血小板和自然杀伤细胞)以及疫苗效力所需的生化途径(补体和凝血)具有不同的免疫刺激作用(图b)。然而,由于个体间在免疫反应的数量(例如细胞因子水平、补体分裂产物、胰蛋白酶和诱导的和预先存在的抗体)和质量(例如炎症介质)方面存在很大差异,相同的成分也会导致过敏反应。SARS-CoV-2疫苗接种后人群血液中的PAF和类胰蛋白酶,以及随后的相关分析,以确定补体激活、类胰蛋白酶和细胞因子水平之间的联系(或缺乏联系),将为过敏反应提供进一步的见解(图c)。
了解SARS-CoV-2 mRNA疫苗引起过敏反应的作用机制,以及纳米医学和疫苗领域之间的知识交流,不仅有利于SARS-CoV-2疫苗,也有利于所有以纳米颗粒为载体的mRNA为基础的疫苗和治疗。针对注射疫苗可能产生过敏反应的人群,确定个体是否存在已知的补体活动较高的情况(例如CVID)或超敏反应(例如,某些类型的HLA和肥大细胞增多症),回顾过敏史将进一步有助于确定高铁高危人群,并制定安全接种策略。在临床中,给患者预先用药可能也会有帮助。然而,这些治疗方法对疫苗的适用性需要进行调查,以确保它们不会影响疫苗的效力;一旦被证实为不干扰,它们可能允许更广泛的人群接种疫苗。同时未来可以做更多的基础研究,以探索更安全的PEG替代品和mRNA的化学修饰,以减少其不良的免疫反应性。
参考文献:
J. Szebeni, G. Storm, J.Y. Ljubimova, M. Castells, E.J. Phillips, K. Turjeman, Y. Barenholz, D.J.A. Crommelin, M.A. Dobrovolskaia, Applying lessons learned from nanomedicines to understand rare hypersensitivity reactions to mRNA-based SARS-CoV-2 vaccines, Nature nanotechnology, (2022).
https://doi.org/10.1038/s41565-022-01071-x











