身处后疫情时代,对于疾病的带来的苦痛,我们每个人都深有体会。对于疾病而言,我们一直在力图实现早预防、早发现、早治疗。早筛的概念其实在国内早在2005年就被提出了,但是也只是近十年内才高速发展起来。
有多少的家庭被肿瘤摧毁,一纸检测报告所有的字眼都比不上晚期二字,如同晴天霹雳般无法相信早期和中期去哪里了?有调查显示,美国每年有几十万不到一百万新发的癌症病人,而中国是300万人,2015年甚至达到了430万新发癌症案例,这个数据是美国的4倍。不可思议的是,在美国50%癌症发现是中晚期,而在中国是80%。其实有几乎九成的肿瘤在早期发现的话是可以治疗的,所以疾病的早筛,其重要性不言而喻。
其实近些年中,疾病的早筛也在飞速发展着。从分子生物学中的蛋白标志物、再到基因学中的易感基因与疾病家族史的筛查、再到细胞水平上的循环肿瘤细胞用于早筛与复发预防、最后到近些年比较火的肿瘤外泌体用于早筛开发。这些早期肿瘤的马脚在被我们一步步的揪出来。同时,检验与影像医学也在迅速发展着,为早筛开发出更多更优异的检测技术,胶体金、免疫荧光、流式细胞术、巢式PCR等等。
近日南洋理工大学化学与生物工程学院的浦侃裔团队与浙江大学医学院附属第一医院合作,共同开发了一种可以通过肾脏清除的多荧光团纳米传感器。这是一种泛用性纳米平台,通过静脉注射与特异酶靶向,结合体内成像和尿液分析,可以实现小型肿瘤与免疫排斥反应的超灵敏检测,推动了早筛领域的进一步发展。

APNs结构功能设计:
作者团队报告了可激活的多荧光团纳米传感器(APNs)的设计,具有生物标志物触发的肾脏清除和荧光反应,用于非侵入性近红外荧光(NIRF)体内成像和尿液分析。APNs包括三个关键构建块:蛋白酶反应肽段,级联自毁单元和具有肾清除部分和/或靶向部分的荧光团单元。荧光团单元与自毁单元连接以形成聚合物主链,其蛋白酶反应肽段与自毁单元苯胺侧链相连接。荧光团单元的叠氮化物基团与肾清除单元HPβCD或cRGDfK进一步偶联,分别得到APNC和 APNG。在内在状态下,APNs是非荧光的,因为荧光团单元的酚基基于笼状结构被抑制了电子供体能力。而在激活状态下,蛋白酶切割蛋白酶反应肽段并诱导级联自毁单元降解以解聚APNs的主链,释放肾可清除的荧光团片段用于NIRF成像和尿液分析。
在原位肝癌,皮下结直肠癌和急性肝同种异体移植排斥反应的啮齿动物模型中测试APNs。选择两种蛋白酶,组织蛋白酶B(CatB)和颗粒酶B(GzmB),分别与肿瘤进展和同种异体移植物排斥反应中的淋巴细胞活化有关,作为构建APNC和 APNG的生物标志物。
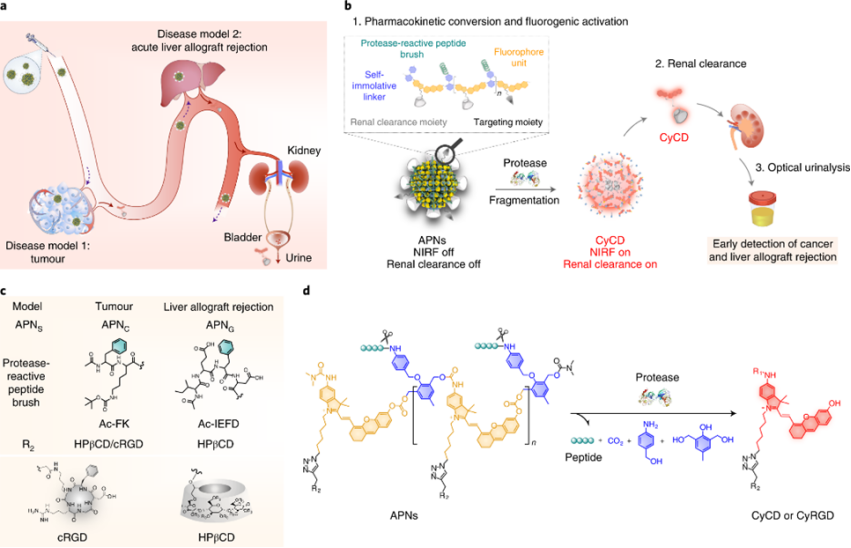
图 APNs的构建示意图
APNs物理性能与生物代谢表征:
APNs的疏水性荧光团骨架和蛋白酶反应肽段的亲水性使其具有两亲性,因此它们在具有球形形态的水溶液中自发组装成纳米颗粒。APNC和 APNG平均流体动力学直径为180和170 nm。APNC和 APNG具有几乎相同的光学特性,在600nm处具有最大吸收,并且最初在PBS中是非荧光的。响应于它们各自的蛋白酶后,APNs的吸收发生了变化,在700nm处出现了峰并且荧光强度增加了约11倍。
研究了APNs和降解片段的药代动力学。降解片段CyCD的有效肾清除率归因于其高亲水性和分子量远低于肾小球滤过临界值(<50kDa)。CyCD(CyRGD)的肾脏清除效率与粪便排泄效率的比较分别为91±3.0%与1.9±1.0%,即降解片段主要通过尿液排出体外。APNs的从注射后12天开始,它们在所有主要器官中完全检测不到,表明它们完全从体内清除。
研究APNs的生物分布。相比CyCD主要聚集于肾脏,CyRGD主要积聚在肝脏,胆囊和肠道中。APNs的大尺寸导致它们在肝脏中的积累。此外,组织学染色显示,所有APNs及其片段都具有很高的生物安全性。
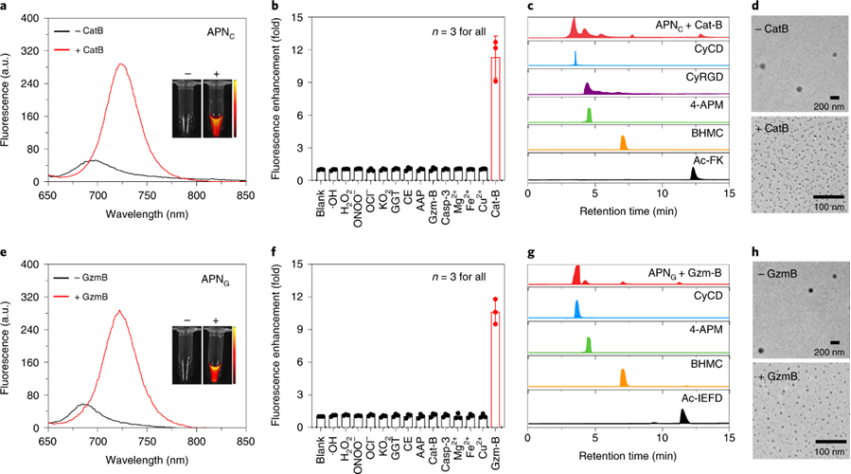
图 APNs的物理性能表征
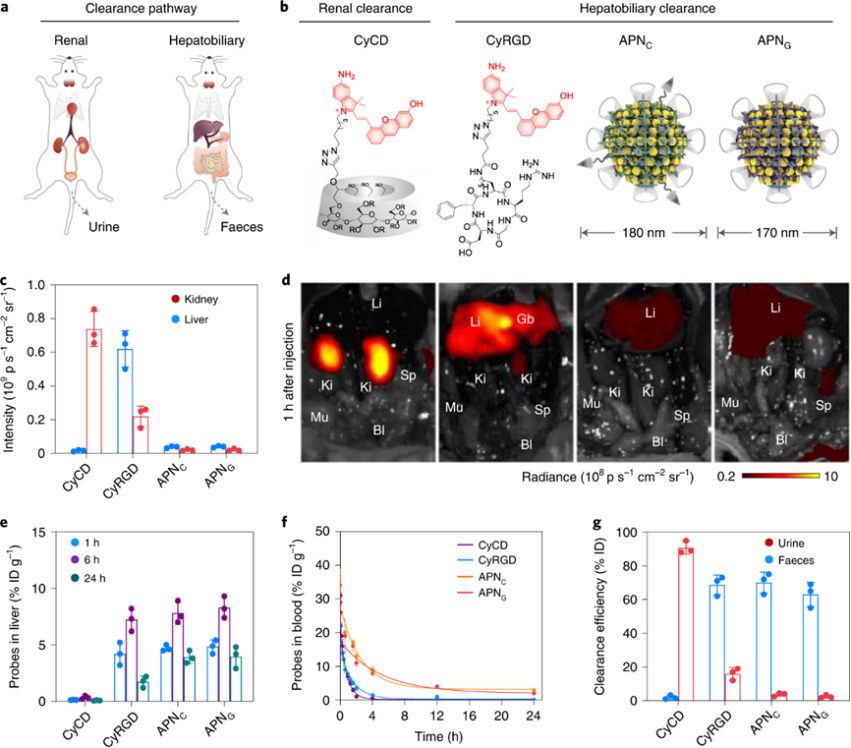
图 APNs的药代动力学及生物分布表征
原位肝肿瘤早筛应用:
癌症的早期诊断对于治愈治疗和提高生存率至关重要。然而,由于当前方法的敏感性和特异性较低,检测超小型肿瘤(<2 mm)仍然具有挑战性。
APNC在原位肝肿瘤模型中评估了肿瘤的实时成像和尿液分析。从LM3细胞植入14天后,静脉注射APNC后进行纵向成像。注射后6 h肝-背景比(LBR)和KBR达到最大值。在肿瘤植入后3天,当肿瘤体积约为3.4mm时,最大LBR和KBR相对于对照小鼠增加了2.0倍和2.4倍。此外,在肿瘤植入后8 d观察到小鼠组的信号演变与成像时间的函数相似。
在注射APNC后,通过测量尿液CyCD来检测肿瘤内CatB水平.相对于对照小鼠,肿瘤植入后3,8和14 d的信号分别增加了1.8倍,3.8倍和7.8倍。尿液CyCD百分比与肿瘤大小密切相关(图4j)。APNC基于尿液分析的检测能够检测直径低至~1.9 mm的原位肝肿瘤,与约~1.6 mm的接近皮下CT26肿瘤(见附图)。临床肝功能测定的敏感性较低,因为当肿瘤直径~6.4 mm时,丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)即使在肿瘤植入后14 d也没有显着增加。
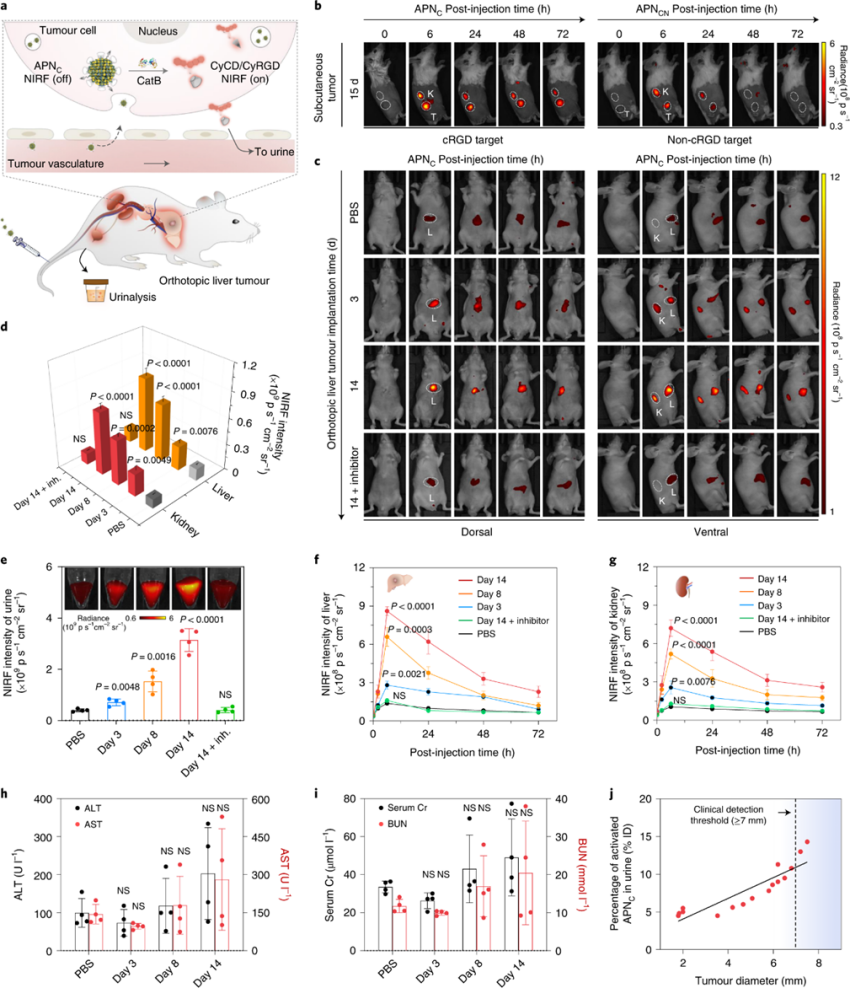
图 APNs的原位肝肿瘤早筛应用
免疫介导急性肝炎早筛应用:
实时监测活化的T淋巴细胞的存在对于诊断免疫介导的疾病和实体器官同种异体移植排斥反应至关重要。APNG监测T淋巴细胞活化的性能在凝集素康那瓦林A(Con-A)诱导的急性免疫介导的肝炎小鼠模型中进行测试。
APNG在用Con-A诱导后的不同时间静脉注射到小鼠体内。NIRF成像显示,用Con-A治疗2 h后,APNG的信号在肝脏和肾脏中接近对照小鼠;然而,在5小时后,信号分别增加了2.4倍和1.9倍,表明APNG在肝脏中被激活,将CyCD释放到肾脏中。用Con-A处理后7小时和11小时观察到小鼠组的类似信号演变。
测量尿液CyCD的信号以进行光学尿液分析。治疗后5小时(5.5倍)观察到第一个具有统计学意义的NIRF增强;它在8小时(7.3倍)继续增加,然后在治疗后12小时(5.0倍)下降。与成像数据一致,在给予高剂量CsA时,尿中荧光信号接近背景水平。此外,尿中荧光信号与肝脏GzmB浓度相关。
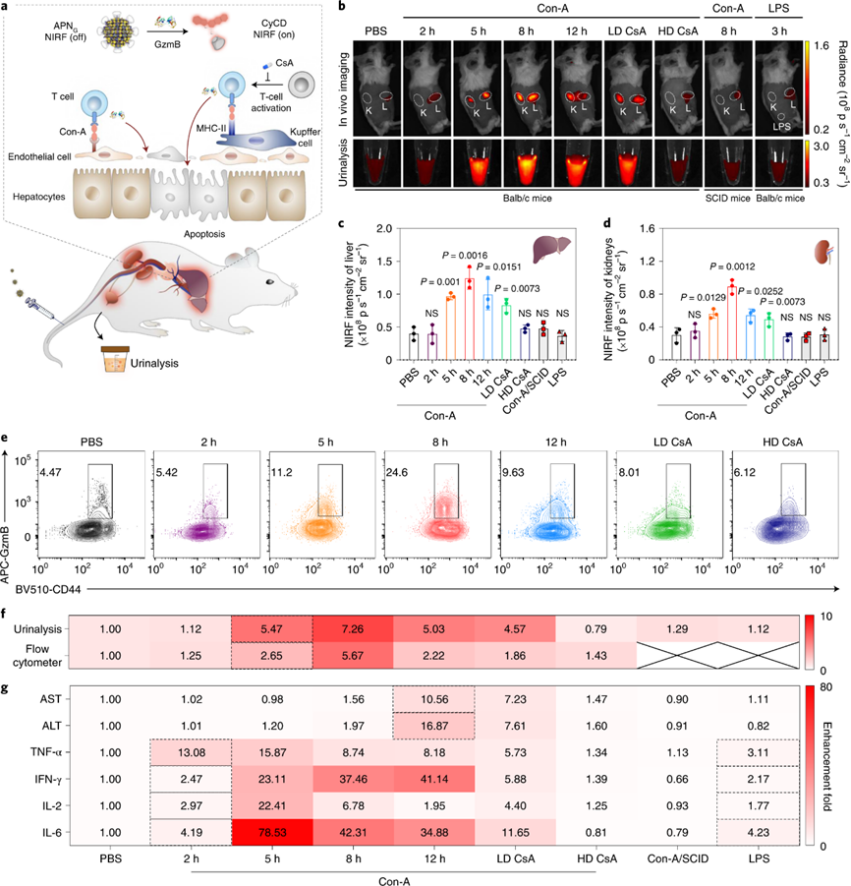
图 APNs的免疫介导急性肝炎早筛应用
急性肝同种异体移植排斥反应早筛应用:
原位肝移植是终末期肝病患者的唯一选择。然而,同种异体移植排斥反应仍然是移植后的主要并发症。侵入性活检是常规用于诊断同种异体移植排斥反应和监测免疫抑制药物治疗疗效的金标准。该手术可导致继发性损伤,并且仅提供静态和局灶性病理状态。APNG也在在急性肝同种异体移植排斥反应的大鼠模型中进行了评估。
以健康小鼠的移植前尿液信号为基线,移植后3天(3.2倍)观察到尿CyCD的首次统计学意义NIRF增强,移植后分别增加到4天和6天4.9倍和3.9倍。在Tac治疗后,低剂量时信号降低至1.8倍,甚至在高剂量时退退到基线水平。
验证APNG的信号是否与T细胞同种异体移植物的浸润程度相关,通过流式细胞术分析不同术后移植细胞毒性T淋巴细胞中GzmB的水平。检测肝脏中GzmB上调,最早时间点是术后3 d,相对于健康大鼠的增量为4.8倍,与APNG尿液分析结果一致。免疫荧光染色显示,移植后3 d观察到肝脏中CyCD的信号,但对于同种移植物大鼠,假手术大鼠或LPS诱导的局部皮肤水肿的大鼠则不然。此外,包括TNF-α,IFN-γ,IL-2,IL-4和IL-6在内的细胞因子在术后2 d显示出统计学上显着的增加。但是在,在同种移植,假手术和皮肤水肿大鼠中也观察到细胞因子的统计学显着增加,显示出低特异性。
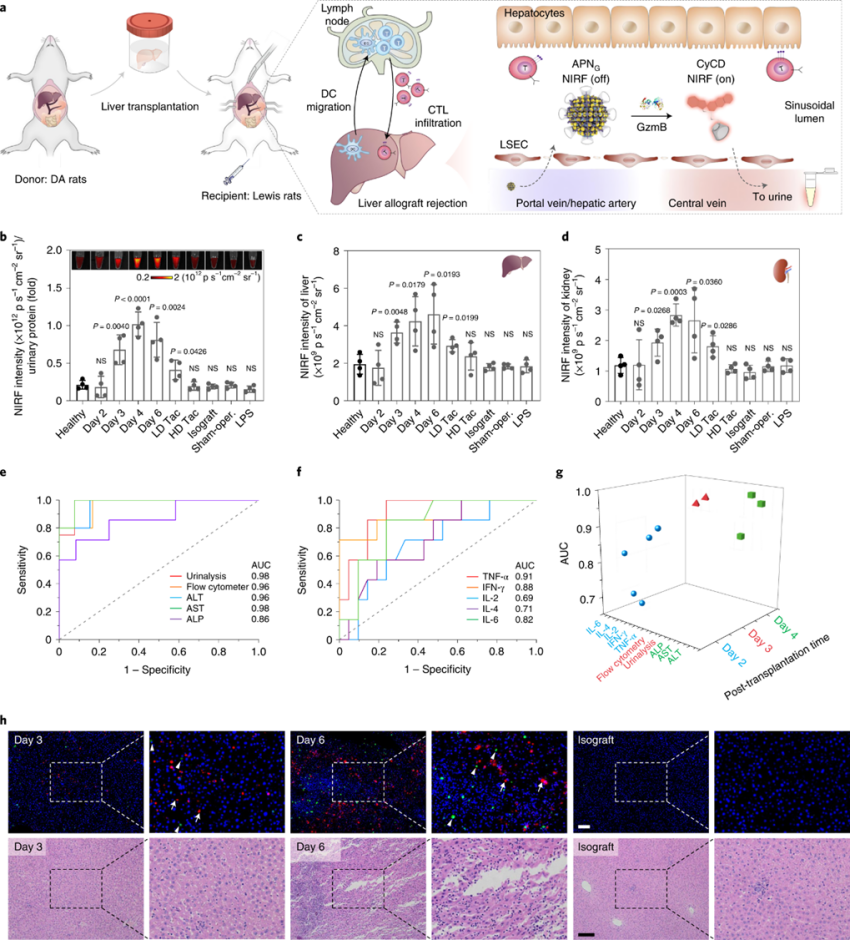
图 APNs的急性肝同种异体移植排斥反应早筛应用
小结:
作者团队以开发了 APNs 平台,通过体内成像与尿液荧光检测实现了直径小至~1.6 mm(皮下结直肠癌)和~1.9 mm(原位肝癌)小型肿瘤的超灵敏检测。这明显比许多临床成像技术更敏感。
在免疫介导的肝炎和急性肝同种异体移植排斥模型中,APNG基于尿液分析被证明与流式细胞术和活检一样敏感,但具有非侵入性和动态性的优点。此外,它比包括超声在内的临床成像方法更早检测到T细胞浸润到肝脏同种异体移植物中。值得强调的是,APNG-基于尿液的分析将急性同种异体移植排斥反应与创伤和局部炎症区分开来,这在血液检查中是不可能的。
同时,尿液检测的开发使得这项技术有着更高的临床转化价值,尿液作为一种极其易取的体液,其内的自体生物学指标波动过大一直是限制其应用的枷锁。此技术使用了肾清除的荧光基团来反应体内某些酶的水平,打造了一种通用纳米平台。可以预期的是,通过更改蛋白酶反应肽段的设计,该平台可以适应越来越多的生物指标筛查。
参考文献:
Huang, J., Chen, X., Jiang, Y. et al. Renal clearable polyfluorophore nanosensors for early diagnosis of cancer and allograft rejection. Nat. Mater. (2022).
https://doi.org/10.1038/s41563-022-01224-2











