眼睛是一个复杂的器官,具有来自不同原始细胞谱系的高度特化的组成组织。例如,视网膜是通过视泡从神经外胚层发育而来的,角膜上皮是从表面外胚层发育而来的,而角膜的虹膜和富含胶原蛋白的基质则具有神经嵴起源。人类的眼表由泪膜覆盖,这层泪膜可润滑、营养和保护眼表组织,在维持眼的正常生理功能中发挥极其重要的作用。泪膜主要由泪液形成,而泪液大部分由泪腺分泌。泪腺与位于眼睑内的产生脂质的睑板腺协同作用,共同建立和维持健康的泪膜,促进良好的视力。泪腺还通过合成防御蛋白(包括乳铁蛋白和溶菌酶)来保护眼表。泪腺功能障碍和泪液分泌减少与一系列病因有关,是最常见的自身免疫性疾病之一干燥综合征的特征,导致干眼症。哺乳动物胎儿泪腺存在干/祖细胞,具有再生能力。然而,在成年人中,泪腺的再生能力很小,并且体外培养受到细胞分离和腺体组织活检的限制。因此,在体外构建具有完整结构和功能的泪腺组织具有重要意义。2013年,Lancaster在大脑类器官中发现具有人眼视杯类似组织的区域,随着对培养条件的不断优化和升级迭代,在体外可以够构建具有光敏感性的大脑类器官和视网膜类器官,这些进展对人眼发育和人视神经疾病的研究具有重要的意义。然而,这些类器官构建的方向重点关注视网膜组织,对于为眼睛起保护性作用的腺体组织的关注相对较少。2021年,Hans Clevers课题组利用分离的小鼠和成人的泪腺组织,在体外构建出具有分泌功能的泪腺类器官,极大地推进了为泪腺生物学的研究和泪腺疾病的治疗开辟了新的途径。但是,对于泪腺的发育和成熟过程等却知之甚少。2022年4月20日,日本大阪大学医学院Ryuhei Hayashi等人基于该实验室在2016年发表在Nature上所建立的自形成的、外胚层的、自主的、多区域(Self-formed,ectodermal,autonomous,multi-zone,SEAM)二维(2D)眼类器官的基础之上,以题为Generation of 3D lacrimal gland organoids from human pluripotent stem cells在Nature上发表具有完整泪腺结构和功能的泪腺类器官,为泪腺的发育研究和移植治疗提供了新的研究模型。


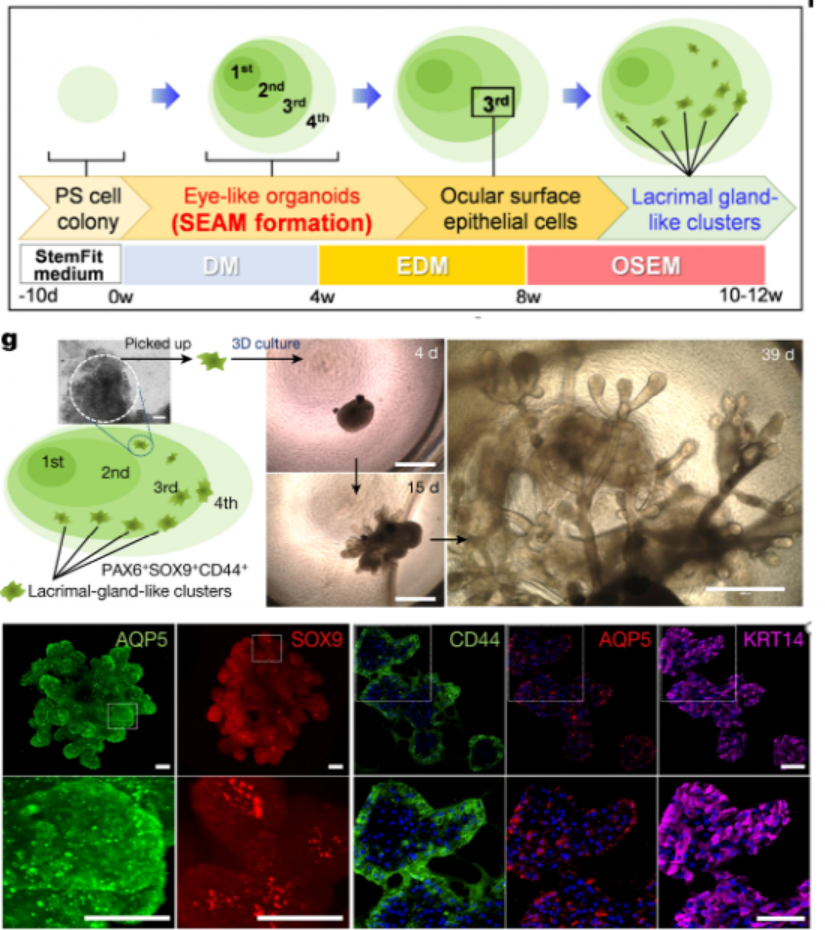
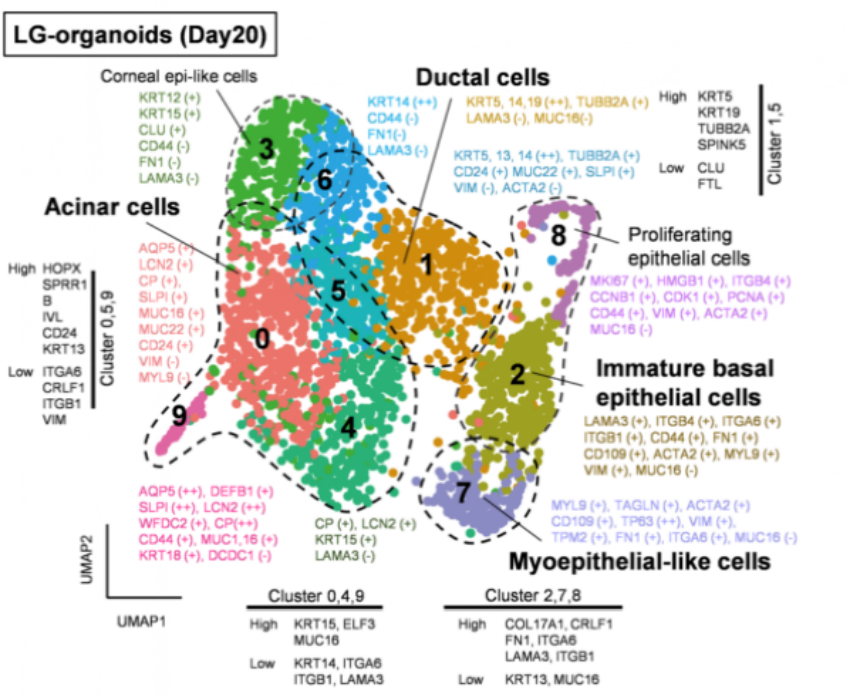
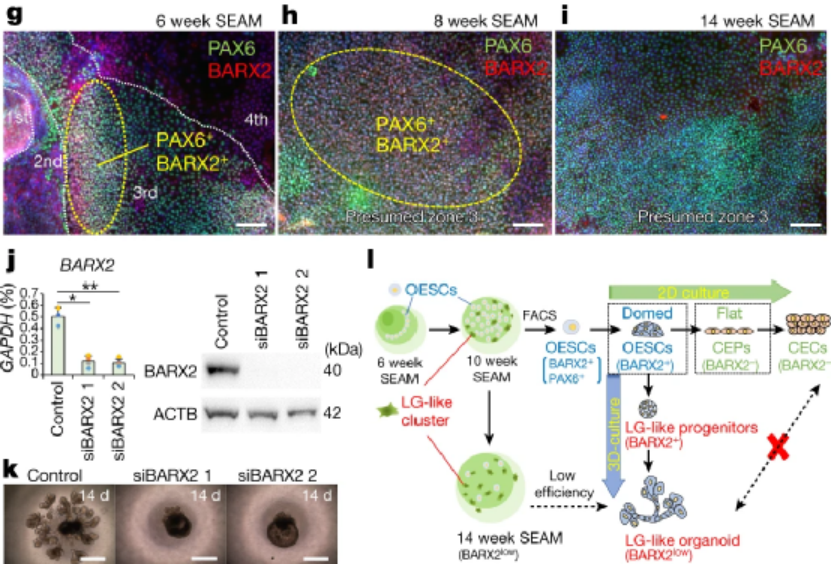
诱导人多能干细胞分化成泪腺类器官,并优化其培养条件作者基于前期建立的实验基础,利用人诱导多能干细胞hiPSC细胞系201B7在体外诱导分化成具有泪腺类器官簇的SEAMs眼状类器官,并利用免疫荧光等技术手段鉴定了泪腺的关键标志物的表达。进一步,作者通过对培养基中的成分进行调整,优化出含有表皮生长因子EGF、角化细胞生长因子KGF、成纤维细胞生长因子FGF10、骨形态发生蛋白BMP7和Y-27632的关键因子的培养基,能定向的诱导多能干细胞分化为芽状泪腺类器官(图一)。随后作者基于优化的培养基分化了另外两种多能干细胞系(hiPS细胞YZWJs524和hES细胞KhES-1),均可以形成泪腺类器官,验证了该培养基具有普适性。光片荧光显微镜分析泪腺类器官,在一些腺泡细胞的细胞核中鉴定出SOX9以及主要在腺泡细胞上的点状的AQP5。还在细胞内观察到CDH1,在细胞核中观察到PAX6,在大多数细胞的细胞质区域观察到KRT14,在所有腺泡和导管细胞的整个基底侧都发现了CD44。在形态切片中未观察到清晰的管腔结构,但在hiPS细胞衍生的泪腺类器官和AQP5和SOX9中存在细胞内CDH1和核内PAX6在一些腺泡细胞中发现。然从人类ES细胞产生的类器官显示出与其hiPS细胞衍生的泪腺类器官相似的免疫染色模式(图一)。基因表达分析显示参与泪腺发育的转录因子如PAX6、SOX9、BARX2、RUNX1、SIX2和FGFR2IIIb在泪腺分化培养过程中瞬时上调,并且随后在泪腺类器官中减少。单细胞测序结果(scRNA-seq)分析表明,在3D培养的第10天,泪腺祖细胞瞬时表达增殖标志物MKI67以及上皮间质转化标志物VIM和FN1。这些标志物的表达在第20天下调,此时AQP5+腺泡细胞已开始分别表达脂质运载蛋白和防御素的功能性泪腺蛋白LCN2和DEFB1。此外,第20天的类器官包含主要细胞簇,包括腺泡、导管和肌上皮样细胞(图二)。为了进一步探究泪腺祖细胞来源于眼表上皮干细胞的假设,作者使用延时显微镜观察克隆团的形成,将其分类为圆顶或扁平(图3a)。几乎所有的克隆团最初都是圆顶形的,但随着时间的推移,往往会变成扁平的克隆团,以至于在4周后,扁平的菌落占主导地位。在诱导泪腺类器官方面,圆顶菌落比扁平菌落更有效。与泪腺发育相关的基因,如BARX2、SIX2、SOX9和KRT15在圆顶菌落中上调。相比之下,在扁平菌落中,粘膜上皮角蛋白KRT13和角膜上皮祖细胞标志物CDH2和NGFR占主导地位。在分化的第6周和第8周,BARX2与PAX6在SEAM区的最内侧区域共表达。此后,与KRT12表达相反,BARX2表达减少,KRT12表达随时间增加。此外,BARX2在泪腺祖细胞形成的球状体中强烈表达,但在泪腺类器官中表达减少。使用小RNA干扰技术敲低BARX2后,得出与体内研究相一致的结果----泪腺类器官中的出芽和分支显着减少。这证实了BARX2是泪腺发育的关键分子,并且对由hiPS细胞产生的泪腺类器官的形成有影响。最后,作者为了验证所建立的泪腺类器官在治疗等方面应用的潜能,将泪腺类器官移植到泪腺剥离的大鼠眼睛附近的结缔组织中。在移植后,移植的人泪腺类器官在体内可以存活,并且其中一些表现出管腔样结构。这些人类泪腺类器官的细胞中的大多数表达KRT14、PAX6和CDH1,而一部分在顶端表达AQP5,SOX9,CD44,并呈现细胞极性。与体外泪腺类器官相比,植入2周的泪腺类器官显示出明显的导管。尽管在移植的泪腺类器官周围积累的大多数大鼠基质细胞ACTA2+细胞,少数细胞与抗人抗体呈阳性反应,表明泪腺类器官可能能够分化为ACTA2+人肌上皮样细胞。在移植的类器官的某些部分也检测到体外泪腺类器官缺乏的分泌腺细胞,这表明植入后的泪腺类器官进一步分化成熟。此外,ELISA结果显示,与未移植的类器官或假手术的组织相比,移植的泪腺类器官中的人乳铁蛋白和溶菌酶蛋白水平升高。与单个球体相比,由五个泪腺类器官球体产生的移植泪腺类器官中的蛋白质水平也更高。移植的类器官中的乳铁蛋白产量大约达到了体内大鼠泪道组织中的乳铁蛋白产量的一半。使用人类基因特异性TaqMan探针组对移植后组织的基因表达分析显示,在移植的泪腺类器官中,与未移植的类器官相比,编码泪膜蛋白溶菌酶和乳铁蛋白的LYZ和LTF的表达高出3000倍。因此,移植的泪腺类器官的表达表型与泪腺组织的表达表型一致,但与其他腺体或眼表上皮组织不同,移植部位的微环境和移植的类器官的数量对于泪腺类器官实现功能成熟都很重要。总之,本文作者开发出了一种从hiPS细胞和ES细胞构建具有特定结构和功能泪腺类器官的分化方法,同时验证了其发育路径和移植后的成熟。这一进展为泪腺发育研究和用于治疗干燥综合征等疾病的再生疗法带来了希望,为泪腺相关疾病的基础研究和药物开发提供了创新性平台。目前,泪腺类器官的来源主要有两种,一种是本文所介绍的多能干细胞来源的泪腺类器官分化方法;另一种是Hans Clever团队基于成体细胞构建的泪腺类器官,两者均能在体外构建具有与人体泪腺结构和功能的类器官,但是两者也存在一定的优势和局限性。本文中的泪腺类器官相较于Hans Clever法构建的类器官的成熟度较低,在研究泪腺的发育具有一定的优势,而Hans Clever法的泪腺类器官则更加的成熟,但其来源相对复杂。两者各具优势,对于后期的应用具有巨大的潜力,这也为泪腺相关疾病的治疗提供了新的视角。[1] Cowan C S , Renner M , MD Gennaro, et al. Cell Types of the Human Retina and Its Organoids at Single-Cell Resolution[J]. Cell, 2020, 182(6):1623-1640.e34.[2] M Bannier-Hélaout, Post Y , Korving J , et al. Exploring the human lacrimal gland using organoids and single-cell sequencing[J]. Cell Stem Cell, 2021.[3] Hayashi R , Ishikawa Y , Sasamoto Y , et al. Co-ordinated ocular development from human iPS cells and recovery of corneal function[J]. Nature, 2016, 531(7594):376-380.[4] 丁传庆. 泪腺解剖和功能的最新研究及其与干眼的关系[J]. 中华实验眼科杂志, 2020, 38(10):4.[5] Lancaster M A , Renner M , Martin C A , et al. Cerebral organoids model human brain development and microcephaly[J]. Movement Disorders, 2013, 501(7467):373.[6] Hayashi, R., Okubo, T., Kudo, Y. et al. Generation of 3D lacrimal gland organoids from human pluripotent stem cells. Nature (2022). https://doi.org/10.1038/s41586-022-04613-4