运动是每一种生命形式的关键特征。即使在微尺度上,也有报道称细菌菌落可以在机械悬臂上产生纳米运动,但这些纳米尺度振动的起源尚未解决。
为此人们提出了许多假设,但尚未达成共识。这与这样一个事实有关,即在微尺度上对生物力学进行非侵入性探测是极具挑战性的。来自荷兰Delft University of Technology 的Farbod Alijani 课题组提出了一种使用超薄双层石墨烯制成的鼓可以在其水性生长环境中测量单个细菌的纳米运动。发现对大肠杆菌细胞的环境施加高达6 nN的力可使得单个大肠杆菌细胞产生振幅高达60纳米的随机振荡。通过使用单基因缺失而运动不同的突变菌株,能够确定细菌鞭毛是纳米运动的主要来源。通过实时追踪抗生素给药时纳米运动的变化,研究人员证明了石墨烯鼓可以进行单细胞敏感性的抗生素敏感性测试。这些发现加深了我们对细胞动力学过程的理解,并为高通量、并快速筛选治疗细菌感染的抗生素铺平了道路。

本文的创新点:
(1)与以前的方法相比,该技术大大提高了纳米机械传感的灵敏度;
(2)证明鞭毛运动是这些细菌纳米运动的主要来源;
(3)这种基于石墨烯的超灵敏平台能够进行单细菌敏感性的抗生素敏感性试验,这为在单细胞水平上更快、无标记地检测抗菌素耐药性开辟了新途径,在药物筛选和快速诊断方面具有潜在的应用前景。
研究思路:
(1)用石墨烯鼓检测单个细菌的纳米运动。实验使用由超薄(<1 nm)双层化学气相沉积石墨烯制成的鼓进行,在LB培养基中,带有数千个石墨烯覆盖空腔阵列的硅芯片置于含有大肠杆菌的反应杯中,细菌的纳米运动导致悬浮膜偏转,细菌在悬浮石墨烯鼓的中心诱导了一个时间依赖性偏转z(t),含有单个活细菌的鼓显示出高达60nm的大位移zmax,时间平均运动幅度高达σ=20nm,明显超过了没有细菌的鼓的偏转。
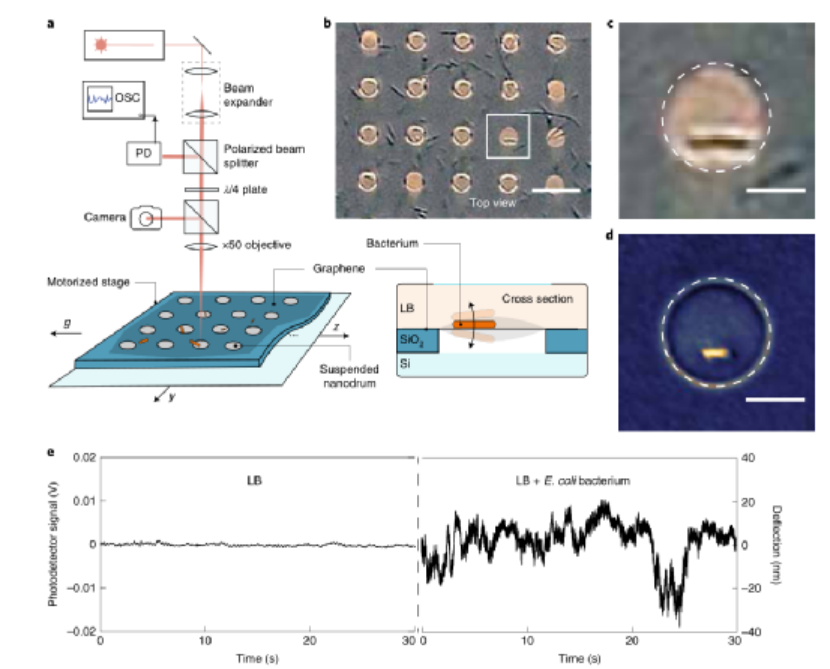
图|用于探测单个细菌的石墨烯鼓
在从秒到小时的时间尺度上也观察到了波动。运动的功率谱密度(PSD)显示,与空鼓的背景信号相比。光谱具有1/fα频率依赖性,平均值α=1.8±0.1(n=277个石墨烯鼓)。
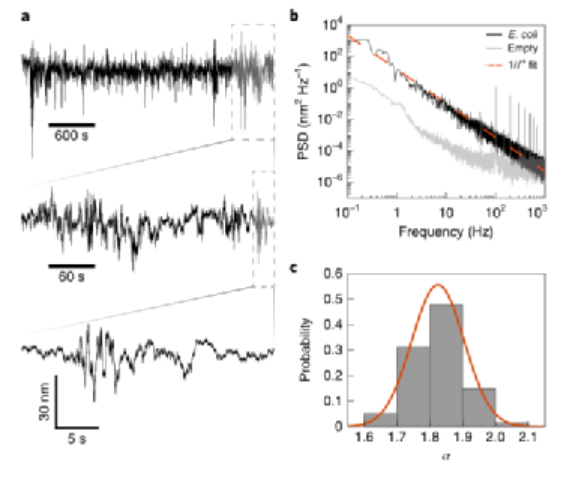
图|单个细菌的运动
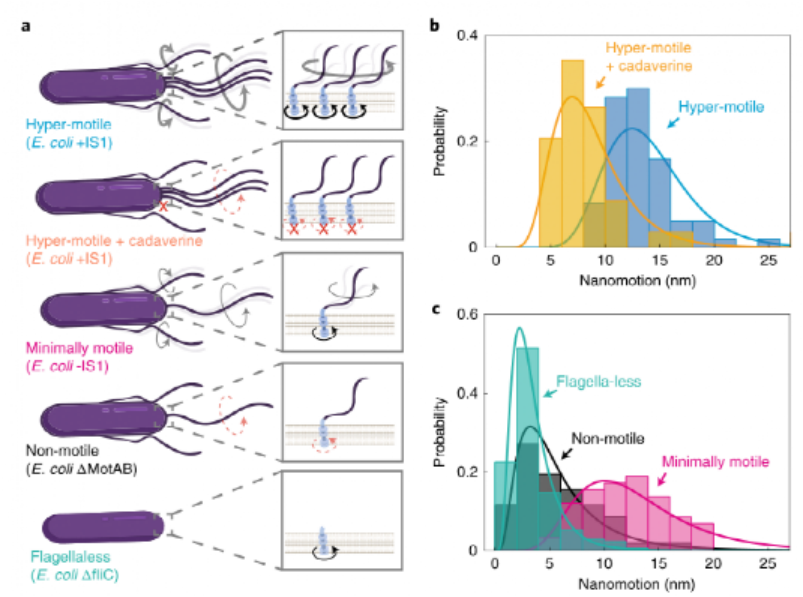
(2)鞭毛运动是纳米运动的主要来源。为了阐明其在产生的细菌力中的作用,研究人员比较了四种经基因修饰具有不同运动水平的大肠杆菌菌株的纳米运动,得出的结论是,观察到的纳米运动差异主要是由鞭毛的活动引起的,因为纳米运动在鞭毛较少的应变中消失,振幅与鞭毛的活动明显相关。
(3)通过监测石墨烯鼓的纳米运动可以对单个大肠杆菌进行抗生素敏感性试验。为了测试不同抗生素的疗效,研究人员测试了的六种不同抗生素及其作用方式。结果表明,可以使用石墨烯鼓来测试基于纳米运动的抗生素敏感性。除了检测菌株之间或服用抗生素后纳米运动的差异外,石墨烯平台还提供了实时探测振幅下降的可能性,提供了有关细菌死亡途径的动态信息。这些结果证明了石墨烯器件作为细菌生理学指标的潜力,并为在单细胞水平上确定细菌对抗生素的时间反应开辟了新途径。
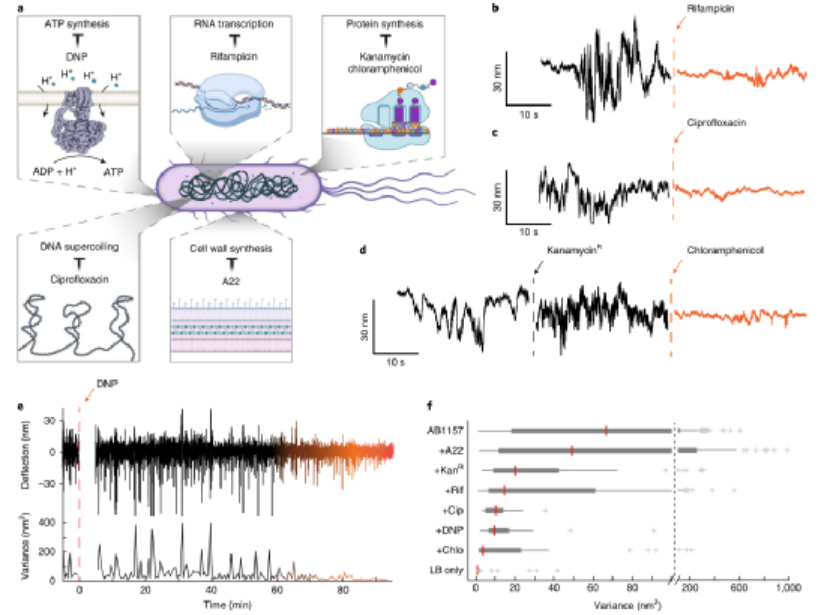
图|使用石墨烯进行单细胞抗生素敏感性筛选
总结与展望:
研究人员提出了一个超灵敏的平台,使用石墨烯鼓测量单个细菌细胞的纳米运动。实验数据表明通过比较不同菌株细菌的纳米运动,鞭毛运动是导致纳米振动的主要因素。然而,值得注意的是,鞭毛运动并不是纳米运动的唯一来源,即使在无鞭毛的大肠杆菌和天然的亚心房杆菌中也观察到了这种运动,尽管振幅明显较低。
同时该平台具有以下优势:
(1)该平台扩展了单细胞分析的可用工具,并为使用悬臂梁的可用纳米运动方法的灵敏度设置了新的基准。
(2)与荧光显微镜相比,纳米运动检测是一种无标签技术,因此可以直接应用于临床样本的抗生素敏感性筛查。
(3)石墨烯具有强度高、惰性好、薄且与光耦合良好的特性,非常适合大规模并行化。
(4)抗生素敏感性实验表明,石墨烯鼓传感平台可以实时跟踪抗生素对细菌纳米运动的影响。这为快速、无标签的药敏试验开辟了道路.
(5)与其他检测抗生素敏感性的技术相比,本文介绍的方法在灵敏度和速度方面都非常突出,能够在30秒的时间范围内量化单个细菌水平上的纳米运动。
(6)石墨烯鼓的小尺寸能够实现高通量传感,原则上允许,在抗生素存在的情况下,数百万个细胞将被并行监测。类似的好处可能也适用于个性化医疗领域,在该领域,可以根据纳米运动反应快速选择合适的抗生素。
(7)作为一种快速选择和筛选方法,定向进化实验可能受益于该技术。
总之,随着本研究中尺寸的显著减小和灵敏度的提高,纳米运动检测有望发展成为细胞生物学中一种重要的非侵入性监测工具,并为个性化医学和药物开发中的快速筛查测试提供新的途径。
参考文献:
Rosłoń, I.E., Japaridze, A., Steeneken, P.G. et al. Probing nanomotion of single bacteria with graphene drums. Nat. Nanotechnol. (2022).
https://doi.org/10.1038/s41565-022-01111-6











