它,类器官,CNS期刊的座上宾,一时声名鹊起,风光无两,被各大媒体争相报道:2013年,被Science杂志评为年度十大技术;2018年,被Nature Methods评为2017年度方法;2019年,被The New England Journal of Medicine杂志成为优良的临床前疾病模型。类器官作为微型体外器官模型,主要来源于多能干细胞(PSC)或成体组织。它们可以自我组织和分化成功能细胞类型,高度模拟人体内器官结构和功能特征。分析类器官的形成可以加深对人类发育和组织/器官再生机制的理解。此外,类器官为疾病建模和药物筛选提供了强大的平台。2019年,由冠状病毒2(SARS-CoV-2)引起的严重急性呼吸系统综合征(COVID-19)是历史上最致命的流行病之一。SARS-CoV-2不仅感染呼吸道,还会对其他组织器官造成损害。类器官可以自我更新和概括不同器官的结构和功能,是模拟COVID-19的强大平台,并为类器官模型研究SARS-CoV-2和未来新兴病毒提供了全新的视角。近日,威尔康奈尔医学院陈水冰教授团队在Nature Methods上发表观点文章,概述了目前应用人类多能干细胞衍生类器官和成体类器官来研究SARS-CoV-2趋向性,宿主反应和免疫细胞介导的宿主损伤,并进行药物发现和疫苗开发的努力,进一步总结了基于类器官的COVID-19研究中使用的新型技术,以及深入讨论了后续的挑战。

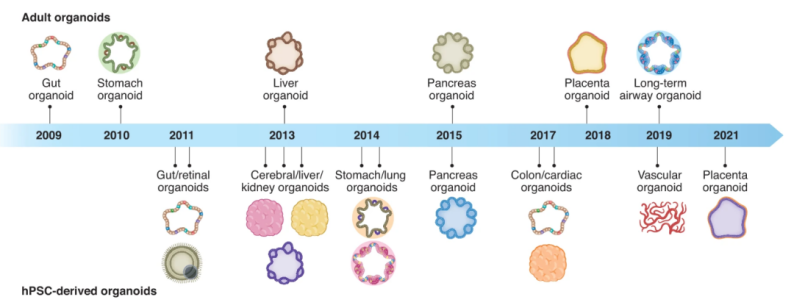
类器官的起源可以追溯到1907年,当时H. V. Wilson试图在体外再生生物体,并表明机械分离的海绵细胞可以重新组装和自组织成具有正常功能的新海绵生物体。1965年,在3D细胞培养的早期研究中,类器官被定义为异常的细胞生长或细胞内结构。1975年,莱茵瓦尔德和格林首次描述了长期培养人类细胞的方法。随着3D培养方法的发展,Emerman和Pitelka通过悬浮的胶原凝胶培养乳腺上皮细胞。1981年,首次从小鼠胚胎中分离出胚胎干细胞(ESC)。1998年,从的人类囊胚中分离出人ESC。这些进步推动了干细胞生物学和类器官领域的进一步发展。2006年,通过引入四种转录因子将小鼠胚胎或成纤维细胞诱导PSC。2008年,Eiraku等人使用3D聚集培养系统从ESC产生基底极性的大脑皮层组织。2009年,Sato等人证明Lgr5+的人肠道成体干细胞可以自组织和分化成隐窝-绒毛类器官。此后,类器官领域研究呈现出爆发式增长。目前,几乎所有的组织都可以在体外构建3D培养的类器官,包括人多能干细胞(hPSC)来源的肠道、视网膜、脑、肝、肾、胃、肺、胰腺、结肠、心脏、和血管类器官和人成体组织来源的胃、肝、胰腺、胎盘、和肺类器官(图1)。
器官已被广泛地应用于模拟人类疾病,包括传染病。2016年,使用脑类器官模型,ZIKV被发现感染神经祖细胞,导致细胞死亡增加和增殖减少。随后,ZIKV感染的脑类器官用于研究病毒趋向性和菌株致病性以及全基因组分析。此外,脑类器官还用于化学药物筛选研究,该研究确定了几种潜在的抗ZIKV候选药物。最近的一项研究表明,ZIKV和1型单纯疱疹病毒都损害了脑类器官的生长,诱导了明显的形态缺陷和转录组变化,并最终导致小头症,脑类器官为该疾病的病理生理学提供了关键的见解。在COVID-19大流行之前,几项研究应用人肺类器官来研究呼吸道疾病,如呼吸道合胞病毒和流感病毒。这些研究促进了类器官在新发病毒感染疾病中的应用,如SARS-CoV-2。COVID-19是由SARS-CoV-2引起的传染病,可导致严重的急性呼吸系统综合征,过度炎症反应和广泛的多器官损伤(图2)许多研究报告了SARS-CoV-2的进入因素。首先确定和占主导地位的SARS-CoV-2受体是存在于不同人类细胞类型的细胞表面的血管紧张素转换酶2(ACE2)。由于ACE2广泛分布在哺乳动物细胞中,SARS-CoV-2可以通过呼吸道感染人体并迅速扩散到其他器官系统。因此,COVID-19不仅会导致严重的呼吸道疾病,还会诱发其他器官的损害,包括大脑,心脏,肝脏,肾脏,肠道和胰腺。二维(2D)细胞培养模型,如VeroE6细胞或ACE2过表达的癌细胞系,已被用于SARS-CoV-2感染的药物筛选和机制研究。但2D细胞培养模型无法模拟宿主的复杂性,并且与组织具有不同的表型。相较于2D细胞培养模型,3D类器官与人体组织/器官的生理和病理特征具有更高相似性,可以作为研究SARS-CoV-2感染模型,模拟受损器官病理生理学并进行药物发现的高级模型。
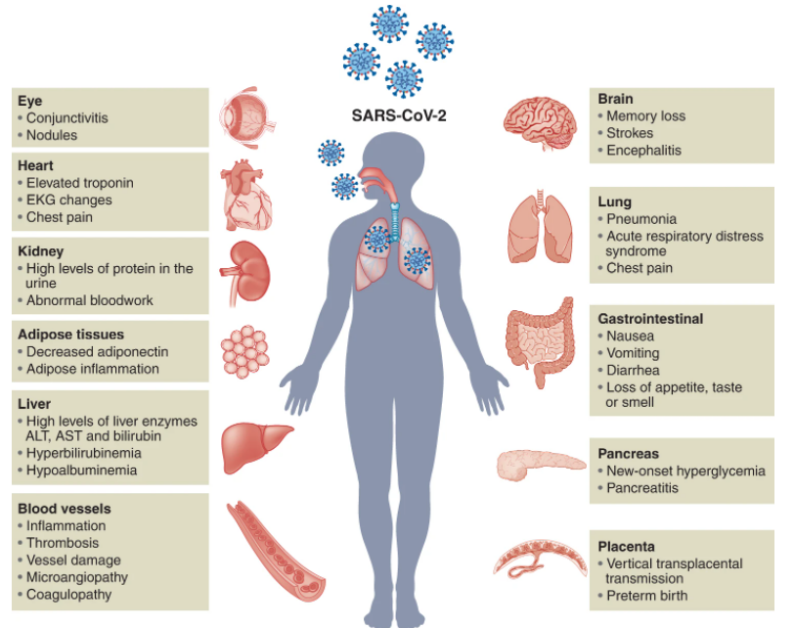
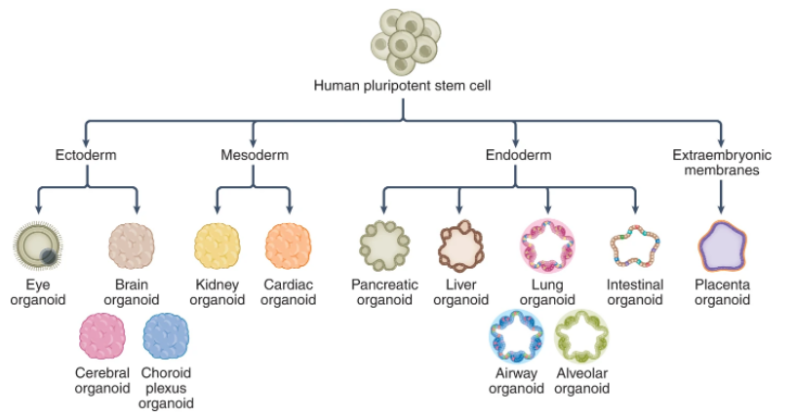
在胚胎发育过程中,呼吸上皮细胞来自内胚层,随后以产生多个隔室,包括肺泡,近端和中间气道以及呼吸道细支气管。SARS-CoV-2主要针对呼吸系统中的上皮细胞,引起严重咳嗽,粘液分泌过多和呼吸急促。在严重的COVID-19患者中,发展为肺炎,进展为急性呼吸窘迫综合征,最后发展为呼吸衰竭。肺泡、肺气道和支气管类器官已被广泛用于监测病毒感染、探索病理变化和确定潜在的治疗方法。呼吸类器官模型表明,纤毛细胞、棒状细胞和AT2细胞亚群(分布在气道和肺泡末端的近端到远端)易于受到SARS-CoV-2感染。这些发现与COVID-19患者尸检数据一致,表明呼吸道类器官模型可以概括体内SARS-CoV-2感染。COVID-19患者通常表现出胃肠道症状,例如腹泻、呕吐或腹痛。人类肠道类器官(IO)已被确定为体外研究肠道病理生理学的生理相关模型。IO包含多种细胞类型,包括肠细胞、杯状细胞、肠内分泌细胞、转运扩增细胞和干细胞。hPSC和成体组织来源的IO,包括小肠类器官(ISO)、结肠类器官(CO)和回肠类器官(ILO),已被用于研究SARS-CoV-2感染。SARS-CoV-2感染伴随着hPSC-SIO的超微结构变化,并诱导了包括ISG在内的强大转录反应。急性肾损伤等肾损伤在COVID-19患者中很常见。hPSC衍生的肾脏类器官(KO)已被应用于研究肾脏中的SARS-CoV-2感染。最近一项比较2D和3D肾近端肾小管上皮细胞中ACE2表达水平的研究发现,与2D培养条件相比,KO中ACE2的表达率高出两倍,这凸显了应用3D类器官进行COVID-19疾病建模的重要性。据报道,在COVID-19患者中,肝功能检查异常和肝损伤的患病率很高。肝脏相关并发症包括总胆红素升高和丙氨酸氨基转移酶异常。由于肝细胞和胆管细胞是肝脏中的两种主要功能性细胞类型,因此含有这些细胞类型的肝细胞和胆管细胞类器官研究SARS-CoV-2感染具有独特的优势。在hPSC衍生的肝脏类器官(LO)中,在大多数白蛋白阳性肝细胞中检测到ACE2表达。SARS-CoV-2假病毒和SARS-CoV-2病毒均被证明可感染肝细胞。COVID-19患者会出现一系列神经系统症状,严重程度从嗅觉和味觉丧失到记忆丧失,再到中风。hPSC衍生的脑类器官(BO),包括全脑和区域脑特异性BO,已应用于SARS-CoV-2研究。在皮层,海马,下丘脑和中脑类器官中鉴定出SARS-CoV-2。发现星形胶质细胞可促进BO中的SARS-CoV-2感染。目前关于类器官主要集中在宿主反应和药物发现上。最近,开发了人扁桃体类器官(TOs)来评估对SARS-CoV-2疫苗的体液免疫反应。特化的生发中心(GCs)中滤泡辅助T细胞和B细胞之间的相互作用在抗原特异性体液反应的发展中起关键作用。通过重新聚集解离的人扁桃体组织而获得的TO维持扁桃体细胞组成,并支持抗原特异性体细胞超突变,亲和力成熟和人B细胞的分类切换。在使用减毒活流感疫苗进行免疫接种后,TOs分化成了具有清晰光区和暗区,这一分区对于GC选择至关重要。B细胞从暗区迁移到光区,与滤泡树突状细胞和滤泡辅助T细胞相互作用,调节GC反应。约三分之一的COVID-19住院患者出现眼部异常,包括结膜炎。ACE2和TMPRSS2在hPSC衍生的视网膜类器官(RO)中表达。SARS-CoV-2假病毒和实时SARS-CoV-2可感染hPSC衍生的RO。受感染的hPSC衍生的RO和成人人眼细胞表现出强大的SARS-CoV-2复制和宿主免疫应答,包括NF-κB信号通路激活。最近,利用与内皮细胞共同培养的hPSC衍生的心脏类器官(CDO)来模拟在COVID-19患者心脏中观察到的细胞因子风暴。人毛细血管类器官(CAPOs)类似于人毛细血管的管腔结构以及内皮细胞、包膜和基底膜。在CAPOs中通过QPCR检测SARS-CoV-2,可被hrsACE2阻断。类器官为研究SARS-CoV-2感染提供了生理相关平台。除了如上所述的病毒趋向性,宿主反应和药物发现外,类器官还被应用于研究宿主遗传变异的影响,检查物种差异并评估不同SARS-CoV-2变异的性质。此外,可以生成来自不同物种的类器官来研究其允许性和对病毒感染的免疫反应的物种差异。hPSC衍生的和成体类器官在可用性,可编辑性,成熟度和多样性方面有利有弊。从理论上讲,hPSC具有无限的增殖能力和发育潜力,可以在所有三个胚层中产生类器官(图3)。hPSC衍生的类器官可以大规模研究,如代谢分析和药物筛选。一些类器官,如脑和心脏类器官,只能从hPSC获得。相比之下,来自成体组织的类器官具有有限的自我更新能力,这限制了它们在可扩展研究中的应用。基因编辑技术已应用于hPSC衍生和成体类器官,以研究基因/变异在SARS-CoV-2感染中的作用。成体类器官的一个主要优点是成熟度。与成体类器官不同,大多数hPSC衍生的类器官仍存在胎儿或新生儿身份。还需要做更多的工作来进一步改善hPSC衍生的类器官的成熟状态。总之,具有不同遗传背景的类器官可以应用于探索遗传背景对疾病进展的影响。
在过去的两年中,类器官在COVID-19疾病建模方面大显身手,也取得了重要进展。然而,现有的类器官模型,仍存在一定的局限性,需要进一步优化传染病的类器官模型,例如通过添加壁龛/免疫细胞来提高类器官的复杂性,结合3D打印和器官芯片技术来开发与人体系统的生理学和病理学更加相似的平台,应用单细胞技术以高分辨率对病毒-宿主相互作用进行深入研究,以及应用基因组测序和基因编辑来探索病毒感染期间的基因型-表型相关性(图4)。这些技术将加强类器官培养方法,加速新的抗病毒疗法和疫苗的研究进程,这可能有助于研究未来的其他病毒爆发。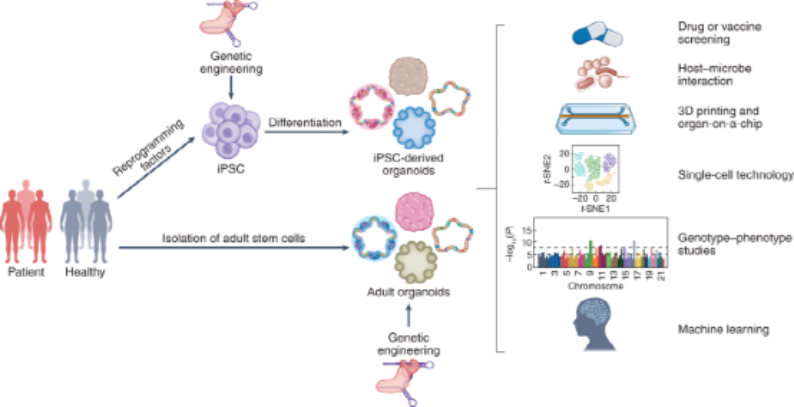
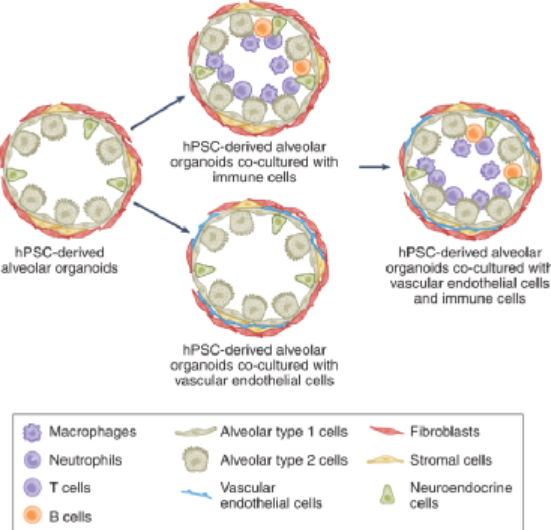
图4:类器官模型在传染病研究中的未来应用用于COVID-19研究的大多数类器官仅包含宿主组织/器官的细胞,缺乏其他关键细胞类型,例如免疫细胞和血管系统细胞。免疫细胞是COVID-19病理生理学和疾病进展的关键。免疫介导的损伤在宿主损伤中可能比直接感染起同等甚至更重要的作用。因此,除了直接感染的后果外,体外共培养的类器官与免疫细胞还可用于研究由免疫细胞引起的COVID-19的病理生理学。此外,具有免疫细胞的类器官可以更好地了解受感染的宿主细胞和免疫细胞之间的相互作用,从受感染细胞释放的免疫调节分子如何影响免疫成分,以及免疫反应如何影响受感染的宿主组织。类器官另一个局限性是缺乏血管。血栓并发症在COVID-19中很常见,并导致死亡。类器官与血管内皮细胞和周细胞共培养以形成血管化类器官,为进一步发展类器官模型系统提供了希望。包含宿主类器官、免疫细胞和血管细胞的免疫-血管-类器官模型将推进类器官技术,并为研究新出现病毒的感染提供下一代高阶版模型(图5)。除了在类器官中包括不同的细胞类型外,创建具有适当空间细胞位置和组织间相互作用的类器官也很重要。3D生物打印技术使用生物墨水中含有的组织特异性细胞类型,并通过分层打印技术重建人体器官样结构。3D生物打印生成的器官模拟系统技术在人体病毒感染研究中具有广阔的应用前景。另一种与类器官融合的创新技术是器官芯片,它是用于在连续灌注的小腔室中培养细胞和组织的微流体装置。芯片上的器官系统允许创建动态和可控的微环境,适合研究病毒-宿主相互作用,对病毒治疗的耐药性的演变,新的抗病毒疗法的开发以及潜在的病毒发病机制。在芯片上培养的类器官为在器官水平上概括生理功能提供了新的可能性,这将进一步增强对COVID-19发病机制的理解。类器官的一个主要优点是它们含有多种类型的细胞,可用于探索病毒与不同宿主细胞之间的相互作用,以及病毒感染时宿主细胞之间的相互作用。在COVID-19研究的早期阶段,scRNA-seq已被广泛用于确定类器官内不同类型细胞中SARS-CoV-2进入因子的表达。然而,基于scRNA-seq分析的总体ACE2表达较低。例如,肺AT2细胞中ACE2阳性细胞的百分比在0.3%至2.4%之间变化,这反映了scRNA-seq平台的检测低灵敏度。因此,有必要深入解析SARS-CoV-2进入因子表达的scRNA-seq数据。此外,scRNA-seq数据需要通过独立方法进一步验证,例如免疫染色或流式细胞术分析。这些类型的研究有望以单细胞分辨率深入了解SARS-CoV-2感染时宿主细胞反应和宿主细胞相互作用。hPSC和成体类器官都可以来自具有不同遗传背景的个体,这为探索遗传变异对疾病进展(包括病毒感染)的影响提供了可靠的模型。在某种程度上,基于CRISPR的基因编辑方法可以有效地敲除单个基因/位点或敲入单个变体。为产生等位基因hPSC/类器官提供高通量平台。这些等位基因hPSC/类器官可用于确定单个基因/遗传位点,甚至是单核苷酸多态性在病毒感染和宿主损伤中的精确作用。另一方面,通过将全基因组测序和来自不同供体的类器官筛选相结合,进行基因型表型研究,以确定与病毒感染相关的新基因/位点/变异。鉴定的基因/位点/变异可以使用基因编辑工具开发的等基因类器官模型进一步验证。此外,这些来自不同供体的hPSC/类器官也可用于调查个体对抗病毒药物的反应,这将有助于为COVID-19患者开发个性化治疗。深度机器学习已应用于分子和细胞生物学、药物发现、蛋白质结构预测和转化生物医学。深度学习在病毒遗传学领域的应用主要集中在对与耐药性相关的病毒突变的预测上。最近,DeepNEU是一种基于完全连接的递归神经网络架构的无监督深度机器学习技术,每个输入都有一个网络处理层,它使用一组定义的重编程转录因子来模拟iPSC系统。在DeepNEU中,可以模拟AT2细胞,并且被证明对模拟的SARS-CoV-2病毒感染是易感的。受感染的肺细胞和类器官可用于刺激和评估SARS-CoV-2基因组中潜在功能突变的影响。这些数据与最近公布的数据一致,并为确定潜在有效的抗SARS-CoV-2药物组合提供了一种新方法。使用类器官平台的研究为COVID-19疾病建模和药物发现做出了重大贡献。类器官仍然存在一些局限性,与动物模型相比,缺乏血管系统,免疫细胞和组织间通讯等。在现阶段,疫苗和药物开发仍然需要动物模型。未来,这些类器官平台将用于模拟更复杂的器官,模仿器官内相互作用,并探索致病机制。来自健康或COVID-19供体的多种组织和类器官可以提供不同年龄、性别或种族群体个体的病毒易感性的可靠分子评估,并为当前和未来的大流行提供个性化的治疗策略。Han,Y.,Yang,L.,Lacko,L.A.etal.HumanorganoidmodelstostudySARS-CoV-2infection.NatMethods19,418–428(2022).https://doi.org/10.1038/s41592-022-01453-y