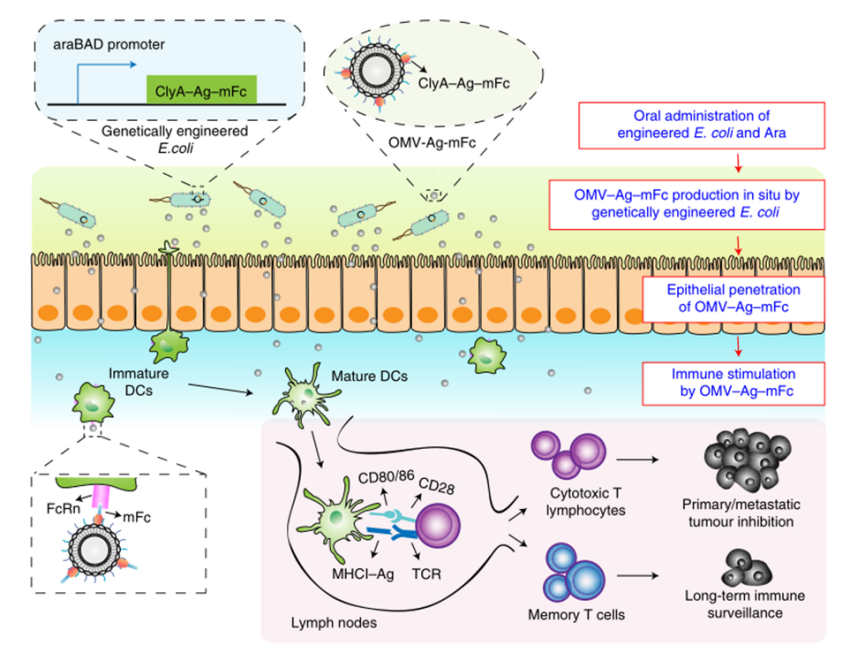
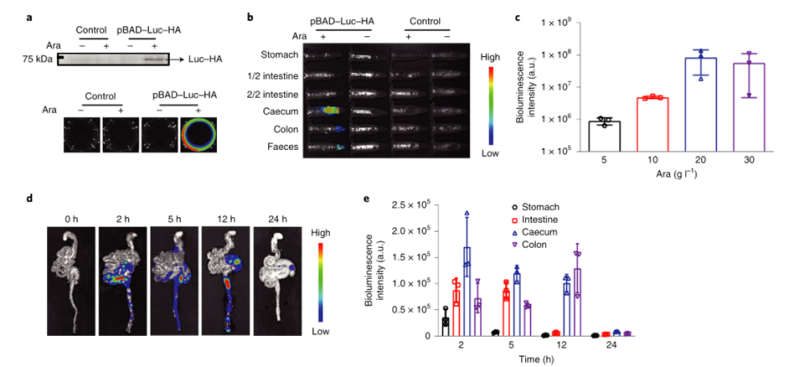
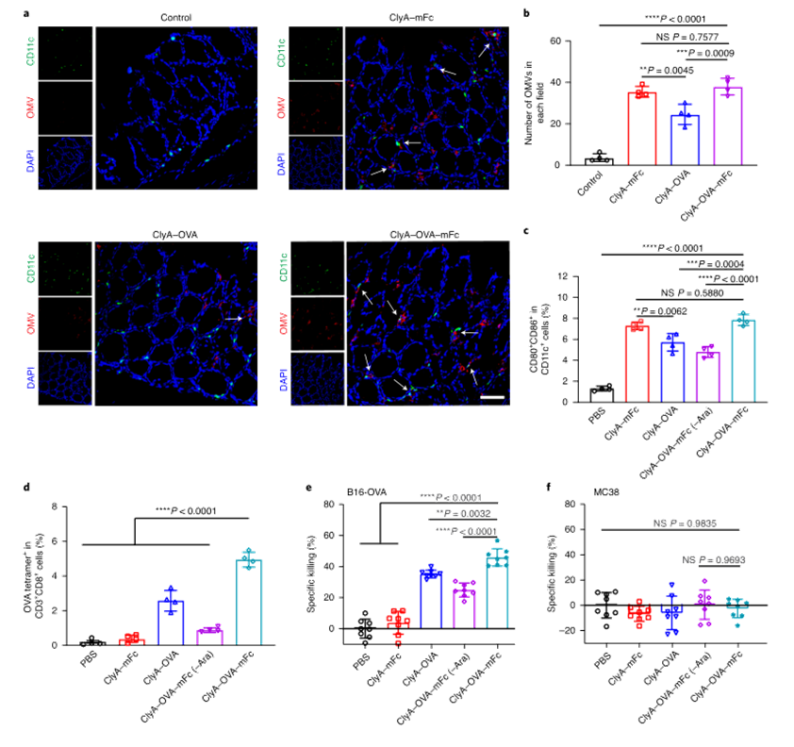
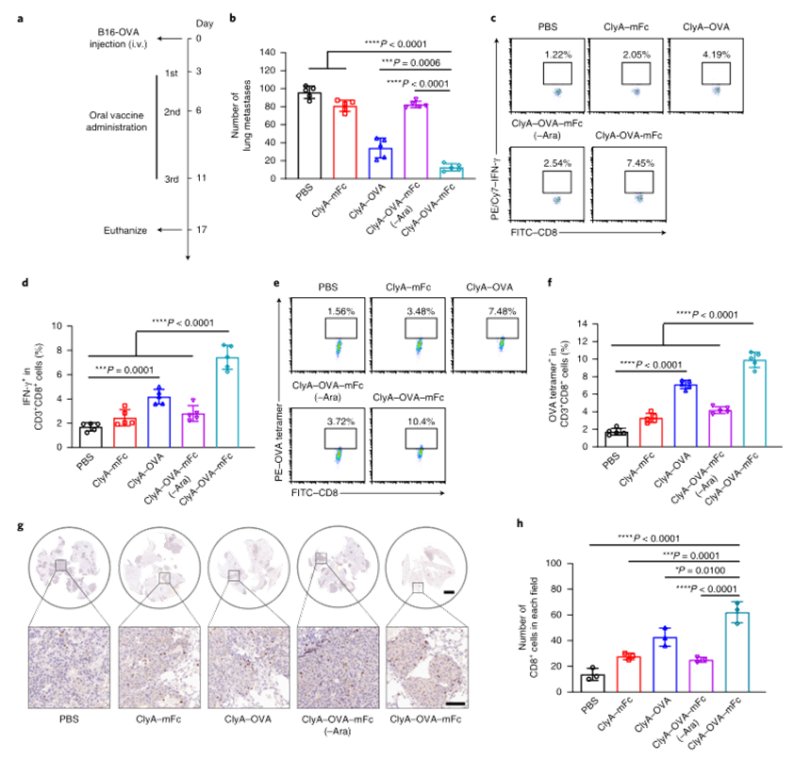
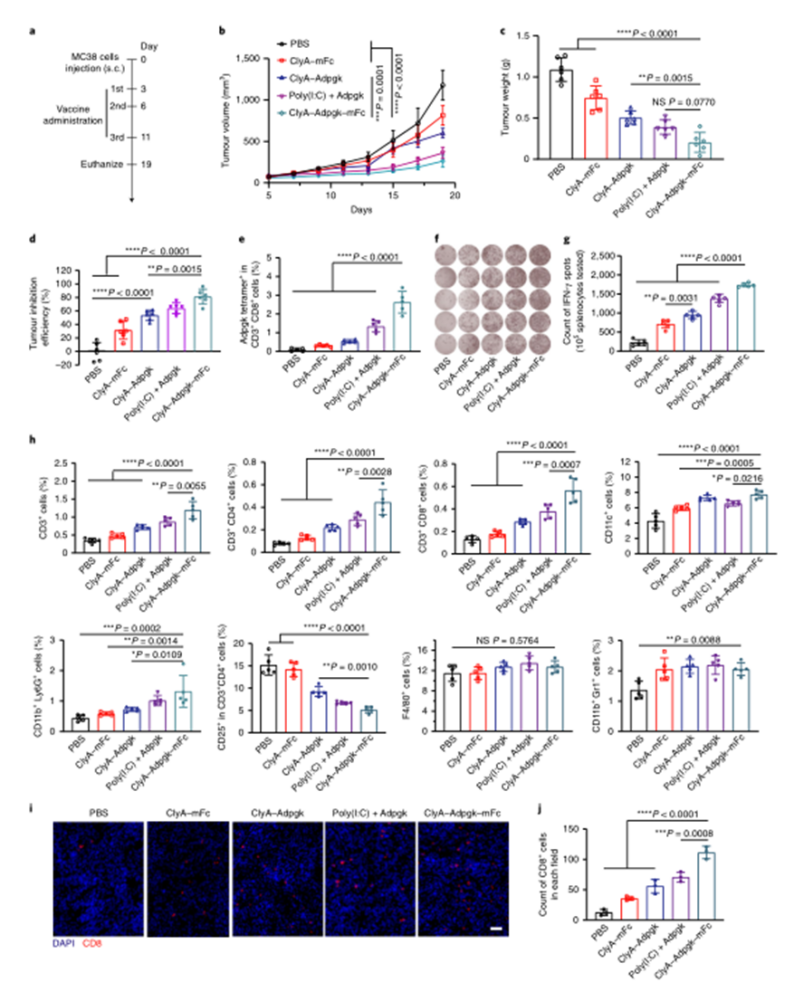
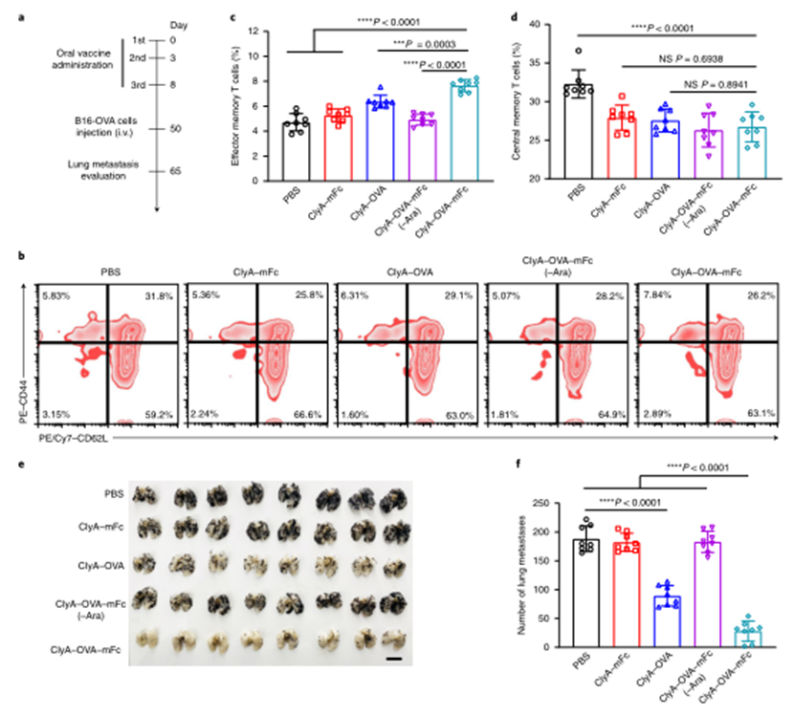
目前,临床试验中的大多数肿瘤疫苗通过肌肉注射或皮下注射进行接种,由于抗原呈递细胞在肌肉组织和皮下层的分布有限,因此需要使用佐剂来提高通过这些途径接种的疫苗的免疫原性。肠道是最大的免疫器官,含有约70%的人体免疫细胞,口服肿瘤疫苗是激发强大的抗肿瘤免疫反应的一个有希望的替代选择。然而,由于复杂的胃肠环境和肠上皮屏障的挑战,口服肿瘤疫苗受到限制。近年来,利用工程微生物输送治疗药物和治疗疾病受到越来越多的关注。之前的研究已经证明,口服程序化细菌或改良益生菌可以识别肠道中的结肠癌组织,并使治疗剂能够局部输送,从而促进肿瘤消退。肠道细菌释放的外膜囊泡(OMV)可与宿主免疫系统相互作用。OMV是由革兰氏阴性细菌分泌的天然纳米颗粒,由于其丰富的病原体相关分子模式(PAMP),可以激活先天免疫系统。然而,OMV在体内的功能和代谢的具体机制尚不清楚,关于基因工程菌在肠道原位分泌功能性OMV治疗疾病的报道也很少。值得一提的是,肠道细菌释放的OMV具有穿透肠上皮屏障并与固有层中的免疫细胞,尤其是树突状细胞(DC)相互作用的能力,导致免疫调节。针对口服肿瘤疫苗的技术障碍,并利用肠道共生细菌的生物学特性,国家纳米中心的聂广军和赵潇团队报告了一种基因工程细菌衍生的口服肿瘤疫苗。首先,研究人员将小鼠免疫球蛋白G(IgG;mFc)的肿瘤抗原(Ag)和Fc片段融合到OMV(ClyA–Ag–mFc)表面蛋白ClyA的C末端。假设mFc会通过Fc和新生儿Fc受体(FcRn)之间的相互作用,增强DC对OMV的识别和摄取。此外,为了实现严格的疫苗接种途径,避免长期抗原刺激引起的免疫耐受,研究人员引入了阿拉伯糖(Ara)诱导启动子来控制融合蛋白的表达。通过口服改良细菌和表达诱导剂Ara,在肠道内实现了携带肿瘤抗原(OMV–Ag–mFc)的OMV的原位可控生产。这些OMV–Ag–mFc有效地穿过肠上皮屏障,并被固有层中的DC吸收,随后进行淋巴结引流和肿瘤抗原递呈。在多种小鼠癌症模型中,肿瘤抗原特异性免疫激活显著抑制肿瘤生长和抵抗肿瘤挑战。为了可视化细菌的生物分布,研究人员首先设计了大肠杆菌(Top10菌株),在araBAD启动子(pBAD–Luc–HA)的控制下,表达与人流感血凝素标签(HA标签;Luc–HA)融合的荧光素酶,araBAD启动子由Ara激活。接下来,给小鼠口服工程大肠杆菌,然后口服Ara。12h后,收集不同部位的胃肠组织和粪便进行生物发光检测。在pBAD–Luc–HA大肠杆菌+Ara组的小鼠盲肠、结肠和粪便中观察到生物发光信号。这些结果表明,口服给药的工程化大肠杆菌能够到达肠道并耐受肠道环境,这确保了Ara口服时目标融合蛋白的成功表达。接下来,研究人员评估了工程大肠杆菌的生物分布和药代动力学。口服pBAD–Luc–HA大肠杆菌和Ara后,生物发光信号在给药后2小时主要出现在盲肠,并在12小时内逐渐移动到结肠。24小时后,由于细菌的代谢清除,生物发光信号变弱,这对口服疫苗的生物安全性很重要。为了研究口服疫苗是否能够刺激免疫系统,研究人员融合了卵清蛋白(OVA)的一个表位(O VA257–264(SIINFEKL))或mFc连接到OMV表面蛋白ClyA的C末端,生成ClyA–mFc、ClyA–OV A和ClyA–OV A–mFc,所有这些都用HA标签标记。并继续在体外和体内研究OMV穿透肠上皮屏障的能力。为此,研究人员在transwell系统的上腔联合培养结肠癌Caco-2和HT29细胞21天,以模拟肠上皮屏障。12小时后通过流式细胞术分析成熟DC的百分比。OMV有效穿透上皮屏障并激活下腔中的DC。接下来,研究人员进行了灌肠实验,以检测OMV在体内的渗透能力。结果显示在ClyA–mFc、ClyA–OVA和ClyA–OVA–mFc组中,OMV明显穿透肠上皮屏障。此外,与不含mFc的OMV相比,含mFc的OMV具有更大的穿透力和DC亲和力。综上所述,工程化大肠杆菌分泌的OMV能够穿透肠上皮屏障,而ClyA与mFc的融合有利于这一过程。接下来,研究人员又检测了口服细菌衍生疫苗在体内刺激免疫系统的能力。与口服磷酸盐缓冲盐水(PBS)组相比,在所有口服细菌衍生疫苗组中,CD11c+DC中CD80+CD86+细胞的比例显著增加,口服ClyA–mFc和ClyA–OVA–mFc疫苗组CD80+CD86+细胞的比例高于口服ClyA–OVA疫苗组,这可能是由于mFc介导的上皮渗透增强。这些结果表明,小鼠固有层中的免疫细胞耐受固有共生细菌,而口服外源细菌通过OMV介导的机制刺激固有层中的DC。研究人员研究了不同口服细菌源性疫苗(第0、3和8天)三轮免疫后的抗原特异性免疫应答。结果显示,口服ClyA–OVA–mFc疫苗刺激的CD3+CD8+抗原特异性T细胞数量最高。这种口服细菌衍生疫苗的免疫刺激可以通过口服Ara来控制。研究人员还评估了收集的脾细胞对表达卵清蛋白的黑色素瘤B16(B16-OVA)和结肠癌MC38细胞的细胞毒性作用。与来自ClyA–OVA-mFc疫苗组的脾细胞相比,来自ClyA–OVA-mFc疫苗组的脾细胞对B16-OV A细胞表现出更强的细胞毒性作用,表明mFc修饰增强上皮渗透的重要性。当使用不表达OV A抗原的MC38细胞时,所有组中的细胞毒性效应均消失,因此证明了口服细菌衍生疫苗免疫刺激的抗原特异性。综上所述,口服疫苗能够在Ara的控制下在肠道内产生携带肿瘤抗原的OMV。OMVs原位疫苗可以穿透肠上皮屏障,激活抗原特异性T细胞对抗肿瘤细胞。为了评估口服疫苗对转移性黑色素瘤的抗肿瘤效果,研究人员在第0天向小鼠静脉接种B16-OVA细胞,并在第3、6和11天用各种口服疫苗制剂或PBS(对照)对动物进行口服免疫。与口服PBS组相比,口服ClyA–OVA疫苗可抑制约60%的肺转移,而口服ClyA–OVA–mFc疫苗组的肺转移几乎被消除。在口服ClyA-OVA-mFc疫苗组中,经OVA257-264抗原肽再刺激的脾细胞中IFN-γ+或CD3+CD8+T细胞的比例最高。此外,在口服ClyA–OVA–mFc疫苗组中,肺浸润性CD8+CTL的水平也最高。这些结果表明,ClyA–OVA–mFc是一种有效的口服肿瘤疫苗,可有效诱导抗肿瘤免疫。研究人员第0天在小鼠皮下注射MC38肿瘤细胞建立皮下MC38肿瘤模型,然后,将来自MC38细胞的特异性抗原Adpgk(ASMTNMELM)引入口服肿瘤疫苗,小鼠接受3次口服PBS、ClyA–mFc、ClyA–Adpgk或ClyA–Adpgk–mFc疫苗治疗(第3天、第6天和第11天)。此外,皮下注射佐剂聚肌苷聚胞苷酸(Poly(I:C))和Adpgk肽(Poly(I:C)+Adpgk)的混合物作为阳性对照,结果显示与其他组小鼠相比,口服ClyA–Adpgk–mFc疫苗组小鼠表现出更强的肿瘤生长抑制。与其他组相比,口服ClyA–Adpgk–mFc疫苗组的肿瘤重量也最低。与口服PBS组相比,口服ClyA–Adpgk–mFc疫苗组的肿瘤抑制率为81.2%。所有这些都表明这些口服疫苗耐受性良好,没有明显毒性。口服ClyA–Adpgk–mFc疫苗组和皮下注射聚(I:C)+Adpgk疫苗组发现血液中CD3+CD8+T细胞比例增加;在口服ClyA–Adpgk–mFc疫苗免疫的小鼠中,这种效果更强。正如所料,大多数IFN-γ是由口服ClyA–Adpgk–mFc疫苗免疫的小鼠脾细胞产生的。这些结果进一步证实,这种口服疫苗比临床试验中使用的普通配方更强烈地激活抗原特异性免疫应答。接下来,研究人员通过流式细胞术检测肿瘤组织中浸润的免疫细胞,口服ClyA–Adpgk–mFc疫苗可显著抑制肿瘤微环境中的免疫抑制性CD3+CD4+CD25+Treg。与其他疫苗组类似,口服ClyA–Adpgk–mFc疫苗组中存在CD11b+Gr1+MDSCs浸润,尽管MDSCs的瘤内浸润不干扰抗肿瘤效果。最后,正如预期的那样,在口服ClyA–Adpgk–mFc疫苗组中发现了数量最多的浸润性CD8+T细胞。为了研究口服疫苗制剂治疗的长期免疫记忆和益处,研究人员在第0天、第3天和第8天用各种口服疫苗治疗健康小鼠三次。在第50天分离脾细胞,并通过流式细胞术分析中央记忆T细胞和效应记忆T细胞的比例结果显示,效应记忆T细胞(CD3+CD8+CD44+CD62L)的比例在口服ClyA–OVA–mFc疫苗组显著高于其他口服疫苗组和PBS组。接下来,在第50天通过尾静脉注射用B16-OVA细胞刺激免疫小鼠,并在第65天收集肺部并成像,口服ClyA–OVA疫苗组和口服ClyA–OVA–mFc疫苗组的肺转移显著减少,口服ClyA–OVA–mFc疫苗组对肿瘤挑战的保护作用更强。总的来说,这些结果证实了口服细菌衍生OMV肿瘤疫苗可以诱导有效的免疫记忆,这对于长期预防肿瘤复发至关重要。综上所述,研究人员通过基因工程改造大肠杆菌(肠道中最丰富的共生细菌之一)来建立基于细菌衍生OMV的口服肿瘤疫苗。利用这一策略,在肠道内实现了携带肿瘤抗原的OMV的原位可控生产。与肿瘤抗原一起,OMV有效地穿过肠上皮屏障,被固有层中的免疫细胞识别,从而有效地激活肿瘤抗原特异性免疫反应,导致对肿瘤生长的显著抑制。这一策略在开发口服肿瘤疫苗方面具有巨大潜力。Yue, Y., Xu, J., Li, Y. et al. Antigen-bearing outer membrane vesicles as tumour vaccines produced in situ by ingested genetically engineered bacteria. Nat. Biomed. Eng (2022). https://doi.org/10.1038/s41551-022-00886-2