临床三维成像中常规使用的计算机断层扫描、磁共振成像和超声成像缺乏在单细胞水平(小于5μm)观察结构和过程所需的分辨率。而且它们不能用于可视化自发荧光(所有组织的一种特征,它携带大量结构信息)或来自成像示踪剂的荧光,通常用于突出组织中的结构特征。荧光,即使在亚细胞分辨率下,也可以通过显微镜检测到,但传统系统甚至先进的共聚焦激光扫描显微镜通常在生成 3D 图像方面很慢,并且不足以建立用于临床应用。光片显微镜,它使用专门的光学器件将激光束转换成薄光片,然后可以用于以高分辨率(甚至是极高的分辨率)进行体积成像,速度更快,但通常需要复杂的预处理样品。
成果简介
近日,哥伦比亚大学Elizabeth M. C. Hillman等人报告了一种用于光片荧光显微镜的优化系统,该系统每秒可生成高达12次的活组织体积图像,平面和垂直分辨率分别约为 1 μm 和 2 μm。这种用于体积显微术的快速系统建立在先前报道的称为扫描共焦对齐平面激发 (SCAPE) 的技术之上,并使用快速数码相机和检流计镜(galvo)沿垂直于薄光的方向扫描样品。成果发表在Nature Biomedical Engineering上。

整体设计
在“经典”装置中,光片显微镜通过照明透镜生成固定的光片,第二个垂直放置的透镜检测组织的荧光激发部分。为了产生体积扫描,样品需要通过光片移动。该研究开发了一种更为优雅的光路,在这种光路中,由斜光片照射的组织切片发出的荧光通过照明透镜本身进行检测,然后由检流计镜通过两个物镜和一个分束器(允许同时进行双色成像)控制进入相机。除了检流计镜外,此装置没有移动部件,因为使用相同的镜子将光片扫过组织。(值得注意的是,来自不同扫描光片的图像最终在相机中的相同位置,因为光片扫描运动通过扫描镜“向后转向”;也就是说,它们是“去扫描的”)。
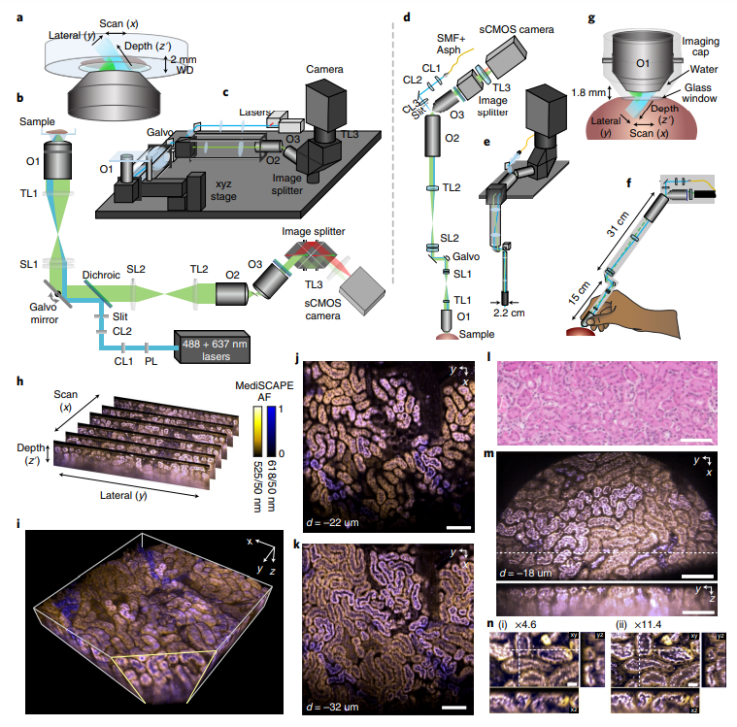
图|MediSCAPE 系统设计和图像形成
快!
通过使用该系统和快速照相机,作者在0.78秒内以每体素1.0×1.4×1.1μm3的采样速度对802×861×275 μm3的体积进行成像。除了使用单个主物镜(直径51 mm)的固定工作台设置并针对大视野进行优化外,作者还使用较小的主物镜(直径12mm)构建了一个小型系统,更坚固的光路,外径与内窥镜相当,设计适合临床使用。在小型化系统中,主物镜和检流计镜可以手持,成像透镜上的灭菌性盖确保透镜表面和成像组织之间有一个规定的距离。
可对活体小鼠进行扫描
研究人员通过利用内源性荧光色素对组织自发荧光进行成像,展示了台式和小型化系统的性能。他们报告了从小鼠身上切除的不同健康和癌性器官的基本结构特征的如实重建。而且,在活体小鼠中,尽管由于血流、呼吸和肌肉抽搐而导致组织自然运动,但显微镜仍然能以每秒超过10个体积的最大成像速度,在大面积组织(跳动的心脏中的肾脏、癌变胰腺和肌肉,尽管其频率约为自由行为小鼠的 10%)上产生了清晰的高对比度扫描。
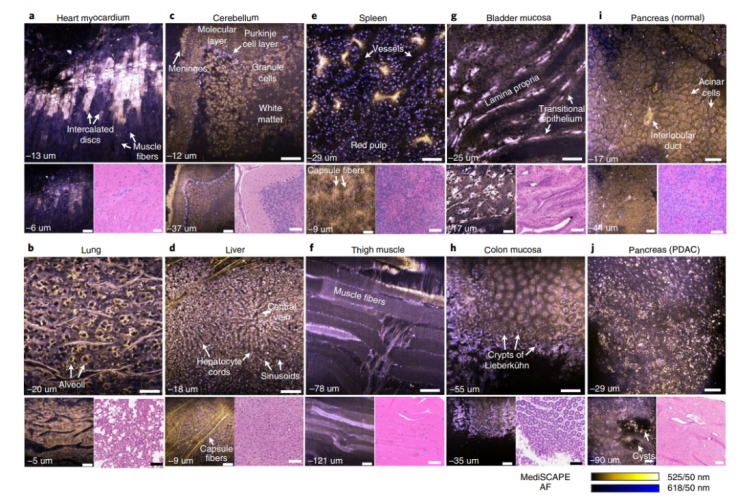
图|使用 MediSCAPE 对各种新鲜小鼠组织进行无标记成像
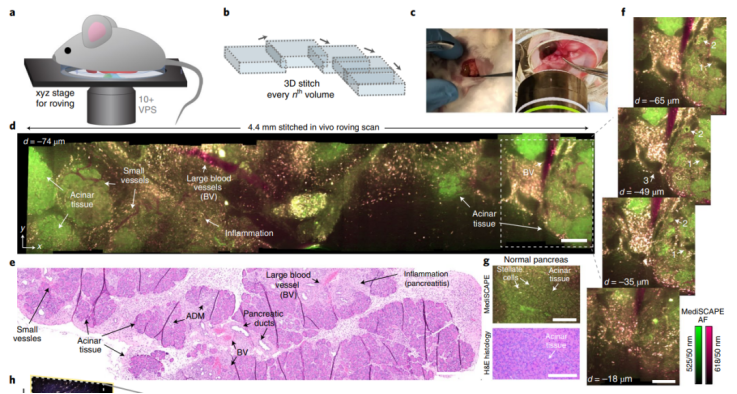
活体小鼠,胰腺疾病和心脏跳动的无标记巡回采集
可用于病理切片
通过图像“拼接”,作者还表明,肾切除术后的人体肾脏图像可以显示预期的病理特征,正如组织病理学所证实的那样。此外,显微镜可以通过将微囊与萎缩性小管明确区分开来进行诊断。当只有经典的组织切片可用时,这项诊断任务很难执行。
具有临床适用性
为了探索微型手持系统的潜在临床适用性,研究人员对志愿者的舌头和嘴唇进行了成像,以识别这些组织的特征性功能结构。作者还展示了台式系统对活体小鼠组织成像的能力的三个演示:注入荧光示踪剂后大脑中微血管灌注的成像揭示了细节,包括毛细血管中血流的单红细胞分辨率;内源性自发荧光显示肾脏缺血和再灌注的影响;该系统的高时间分辨率允许对荧光示踪剂通过肾脏并进入其近端小管的过滤进行成像。能够在单个功能元素(小鼠肾脏中有超过 15,000 个功能元素)水平上实时执行肾脏生理学尤其令人印象深刻。
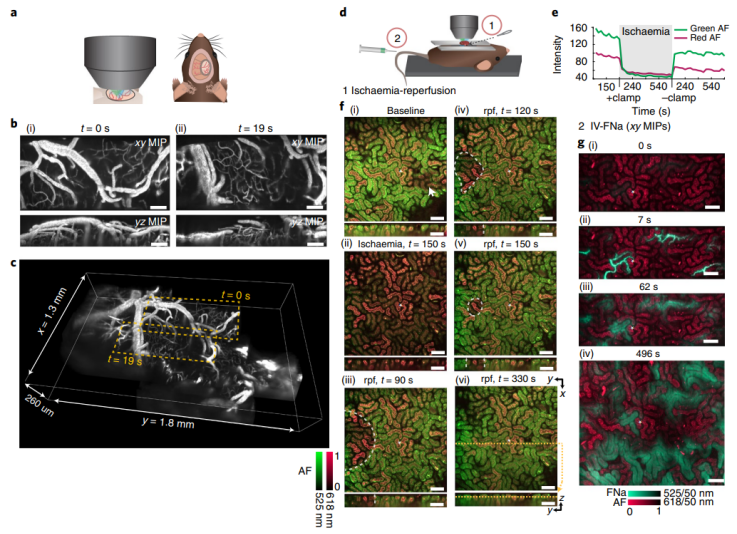
图|小鼠大脑和肾脏的体内功能成像
综上,该研究进一步优化的医疗 SCAPE 系统将使实时组织可视化变得更加容易,并最终可能成为基于图像的诊断设备的一部分。例如,它们可以实时观察用于识别癌症患者前哨淋巴结的荧光示踪剂(如吲哚菁绿)的引流情况。
参考文献:
1.Patel, K.B., Liang, W., Casper, M.J. et al. High-speed light-sheet microscopyfor the in-situ acquisition of volumetric histological images of living tissue.Nat. Biomed. Eng (2022).
https://doi.org/10.1038/s41551-022-00849-7
2.Gunzer, M. Fast volumetric scanning of living tissue. Nat. Biomed. Eng (2022).
https://doi.org/10.1038/s41551-022-00894-2











