时光匆匆,白驹过隙,年迈之时回顾人生总会感慨青春易逝。随着年岁的增长,衰老成为了我们不得不面对并承认的现实,慢慢的慢慢的,我们会忘记刚才随手放下的笔在哪;渐渐的渐渐的,我们会忘记刚才说出口的话;最后,我们会忘记那些我们爱着并爱着我们的人。面对这种可以预见的悲伤,我们为什么不能举起反抗的大旗,逆转光阴,重获年少时的才思呢?
其实提到记忆衰退,最为广泛的认知多半是老年痴呆症。针对这种记忆衰退的情况,其实已经有很多的研究正在开展,如异时异种共生和年轻供体的血浆移植可以使衰老的大脑恢复活力与记忆功能。然而,血源性的影响因素会因为血脑屏障的隔离作用而受到限制。因此,研究的目光就转移向了脑脊液(CSF),其携带的信号分子在发育过程中指导神经元祖细胞增殖和分化。脑脊液蛋白组成随着人类衰老而变化,以炎症蛋白增加以及生长因子减少为特征。所以将年轻小鼠的脑脊液输注给老年小鼠会不会对大脑恢复活力发挥积极作用呢?
近日,美国斯坦福医学院的Tony Wyss-Coray率领其团队发现,就将年轻的脑脊液直接注入老化小鼠的大脑中并改善了小鼠的记忆功能。年轻的脑脊液在老化的海马体和原代OPC培养物中可以促进少突胶质细胞祖细胞(OPC)的增殖和分化。使用SLAMSeq分析,作者团队鉴定了血清反应因子(SRF)是年轻脑脊液介导OPC增殖的通路。通过筛选了CSF中潜在的SRF激活剂,发现成纤维细胞生长因子17(Fgf17)输注足以诱导老年小鼠的OPC增殖和长期记忆巩固,而Fgf17阻断则会损害年轻小鼠的认知。这些发现证明了年轻脑脊液的恢复活力,并将Fgf17确定为恢复衰老大脑中少突胶质细胞功能的关键靶标。

年轻脑脊液对少突胶质发生的调控:
首先,研究人员将研究目标放在了年轻供体的脑脊液输注到老年小鼠中,是否可以改善由衰老引发的海马依赖性学习和记忆能力损伤。之所以选择了条件恐惧实验,是因为它允许我们分析影响长时记忆形成和巩固的影响因素,而这一过程与衰老相关的认知能力下降有关。二十个月龄的老鼠接受了三次与声光相关的脚部电击。然后将小鼠随机分成两组,并注入人工脑脊液(aCSF)或年轻小鼠脑脊液(YM-CSF)1周,并在3周后测试长期记忆回忆。YM-CSF组暴露于声光后僵直率较高,表明这组可以更好地维持长期恐惧记忆。
研究人员进行了批量RNA测序(RNA-seq)测量了输注年轻脑脊液对海马转录组的影响。具体而言,年轻的脑脊液促进了促少突胶质细胞分化相关转录因子和主要髓鞘蛋白成分的上调。有趣的是,虽然这些老化小鼠的大脑中整体细胞增殖非常低,但我们发现海马体的整体细胞增殖水平激增。我们向老年小鼠输注了来自健康年轻人类供体脑脊液(YH-CSF,平均年龄为24.6岁)或老年人类供体脑脊液(AH-CSF,平均年龄为69岁)。YH-CSF诱导OPC增殖的水平与YM-CSF相当,而AH-CSF诱导的细胞增殖仅为一半。同时来自年轻健康供体的人类脑脊液被证明可以诱导提高神经元活力,而来自多发性硬化症患者的脑脊液对神经元和OPC表现出毒性。值得注意的是,我们发现海马体分子层中MBP强度和无髓鞘轴突的数量增加。这表明年轻的脑脊液含有促进少突胶质细胞谱系细胞生长或中和抑制因子的物质。
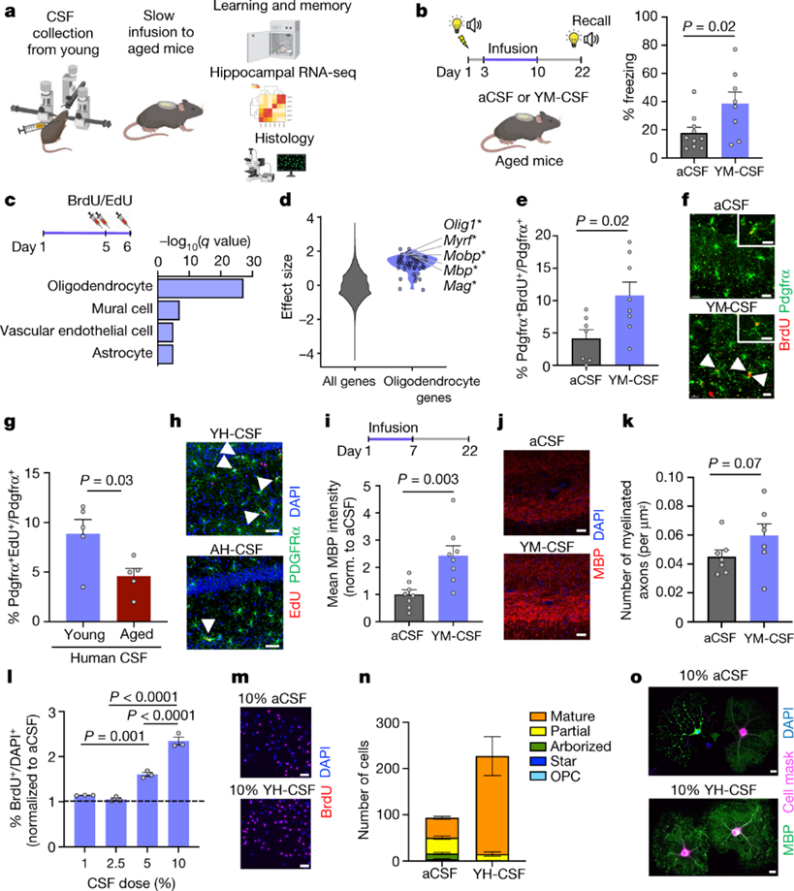
图 年轻的脑脊液改善记忆巩固,促进OPC增殖和分化
SRF介导年轻脑脊液对OPCs的影响:
为了更深入地了解上述的生理过程,我们对暴露于年轻脑脊液中1或6小时的OPCs进行RNA代谢测序(SLAMseq)。在1小时处理组中的top基因是血清反应因子(SRF),这是一种在骨骼肌、心脏、中枢神经中被广泛研究的转录因子。我们还注意到编码Wnt信号负调节因子、促凋亡因子Bcl7b和DNA修复蛋白Rpa3的基因显著下调,这与暴露于YH-CSF的促生存反应期望一致。
针对年轻脑脊液诱导的SRF表达是否调节OPC肌动蛋白细胞骨架,OPC内的SiR-肌动蛋白信号在YH-CSF刺激数小时后迅速增加,但是信号总面积没有变化,这表明细胞肌动蛋白丝表达水平增加。暴露于YH-CSF6小时的OPCs表达的鬼笔环肽是对照组的两倍。在输注YM-CSF6天后的老年小鼠的海马OPCs中也证实了鬼笔环肽表达的增加。
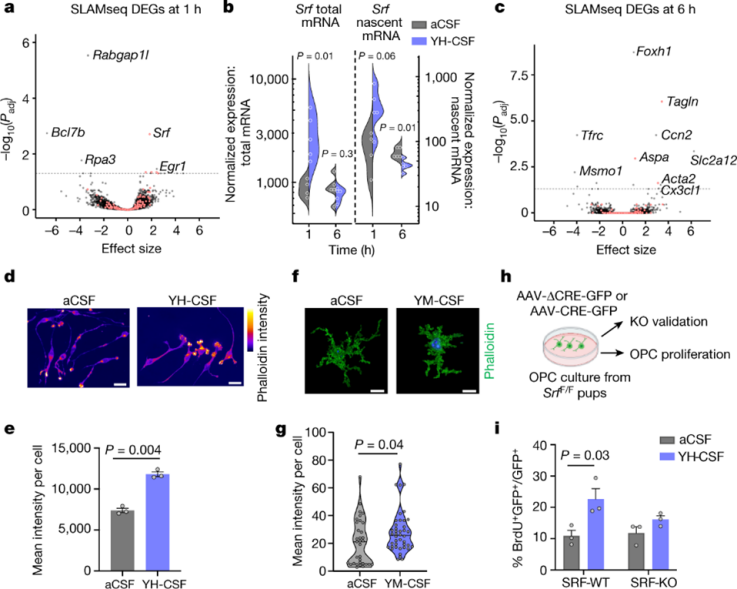
图 SRF由年轻脑脊液诱导上调,并介导OPC增殖
因为SRF对于神经元轴突生长锥中肌动蛋白丝的形成是必需的,所以我们测试了它在OPC中是否具有类似的作用。与aCSF相比,YH-CSF诱导的每个细胞的生长锥细胞明显更多。我们构建SRF-KO小鼠模型并重复了YH-CSF增殖实验,结果表明脑脊液诱导的增殖依赖于SRF。这些结果揭示了年轻脑脊液对OPCs影响的可能机制,并指出SRF和肌动蛋白细胞骨架调控是年轻脑脊液在体内影响的潜在介质。
事实上,通过原位杂交检测到的海马体CA1区域中SRF阳性OPCs的比例随着年龄的增长而显着降低。随着年龄的增长,OPC中下调的top通路与少突胶质细胞标记物、胶质细胞分化的调节、细胞呼吸和代谢以及蛋白质折叠有关。相反,免疫相关通路和小胶质细胞特异性基因随着年龄的增长而上调。SRF靶基因在其他已发表的关于年龄和阿尔茨海默病(AD)OPC的人类和小鼠数据集中也被下调。总而言之,这些实验表明,OPCs中的SRF信号表达随着年龄的增长而下调,并在颅内急性注射年轻脑脊液后被诱导升高。
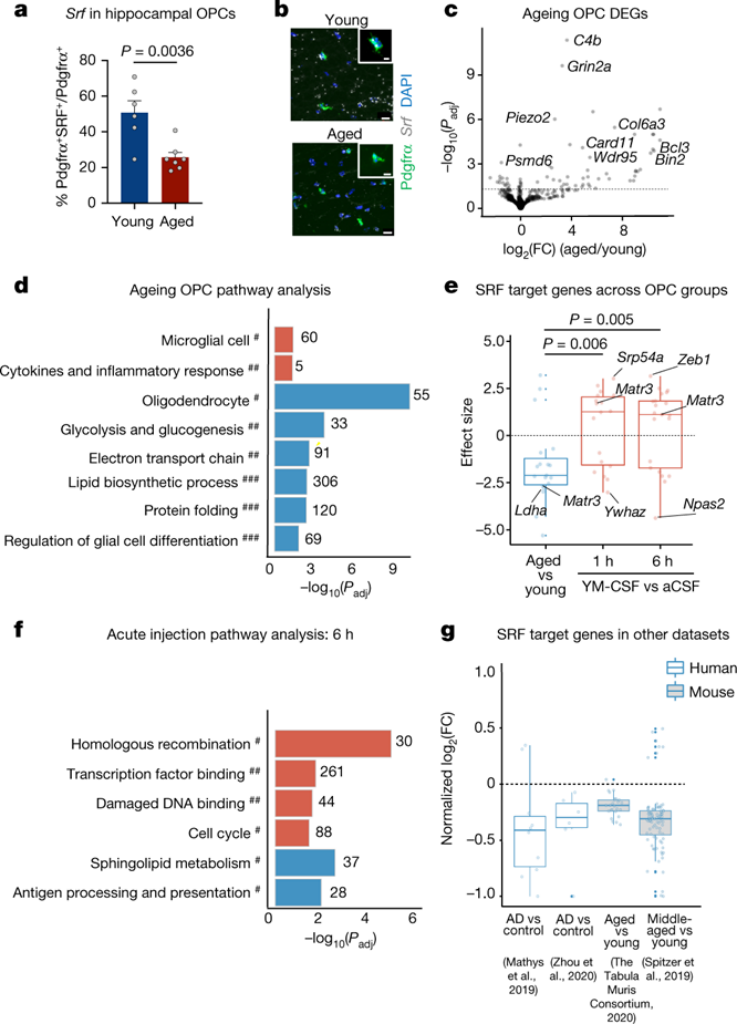
图 SRF随着年龄的增长在海马OPCs中表达下调,并由年轻脑脊液诱导表达再上升
Fgf17模拟年轻脑脊液对OPCs和记忆能力的影响:
CSF含有数百种可能诱导SRF信号的蛋白质,研究人员将两个已发表的脑脊液蛋白质组学数据集与TRANSFAC预测的SRF靶点列表交叉引用,并生成了一个潜在SRF诱导物列表。在基因转染实验后,成纤维细胞生长因子8(Fgf8)和Fgf17诱导最强的剂量依赖性反应。我们选择继续研究Fgf17,因为它是一种在人类脑脊液富含的蛋白质,并且其水平随着年龄的增长而降低。通过干涉肌动蛋白聚合,我们发现Fgf17通过肌动蛋白调节激活SRF信号。
研究人员将重组Fgf8和Fgf17注入老年小鼠,Fgf17诱导了老化海马体中的OPC增殖,但Fgf8没有。我们发现,注射了抗Fgf17(而非对照抗体)的小鼠在两项海马依赖性认知测试(Y迷宫和情境恐惧条件反射)中表现出受损表现,这表明增殖的增强部分是由Fgf17介导的。这些实验表明,Fgf17足以模仿年轻脑脊液对海马体OPCs和老年小鼠记忆巩固的影响,是年轻脑脊液发挥作用的主要成分。
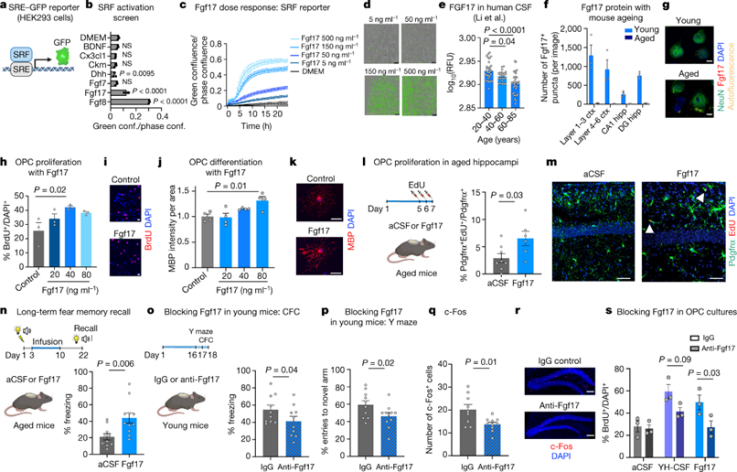
图 Fgf17诱导OPC增殖并改善记忆力
小结:
综上所述,作者团队发现年轻的脑脊液足以改善老年小鼠的记忆功能,这与OPC增殖和海马髓鞘形成增多相关。Fgf17对于改善老年小鼠的认知并促进OPC在体内外的增殖是必要的,它构成了年轻CSF恢复活力作用的主要组成部分。此外,年轻的脑脊液诱导转录因子SRF及其肌动蛋白细胞骨架靶基因的表达,促进OPC增殖。我们推测SRF协调了各种细胞类型的可塑性,这种可塑性随着年龄的增长而丧失最终会促进神经变性。
占老年大脑干细胞数量最多的OPCs在目前的研究中大多被忽视。对年轻啮齿动物的最近研究表明,OPCs形成有髓鞘少突胶质细胞,对于巩固形成新记忆至关重要,暗示了这些细胞在认知功能中的积极作用。此外,成熟的少突胶质细胞对于维持轴突健康和调节神经元功能至关重要。髓鞘可塑性正在成为学习和记忆中的重要机制,对髓鞘功能障碍在衰老相关认知能力下降中的研究正在引起更多人的兴趣,而研究CSF(适应大脑独特需求的媒介)有可能进一步深入对大脑复杂机制和细胞相互作用的理解。
参考文献:
Tal Iram, Fabian Kern, Achint Kaur, et al. Young CSF restores oligodendrogenesis and memory in aged mice via Fgf17. Nature. 2022 May 11.
https://www.nature.com/articles/s41586-022-04722-0#Sec5











