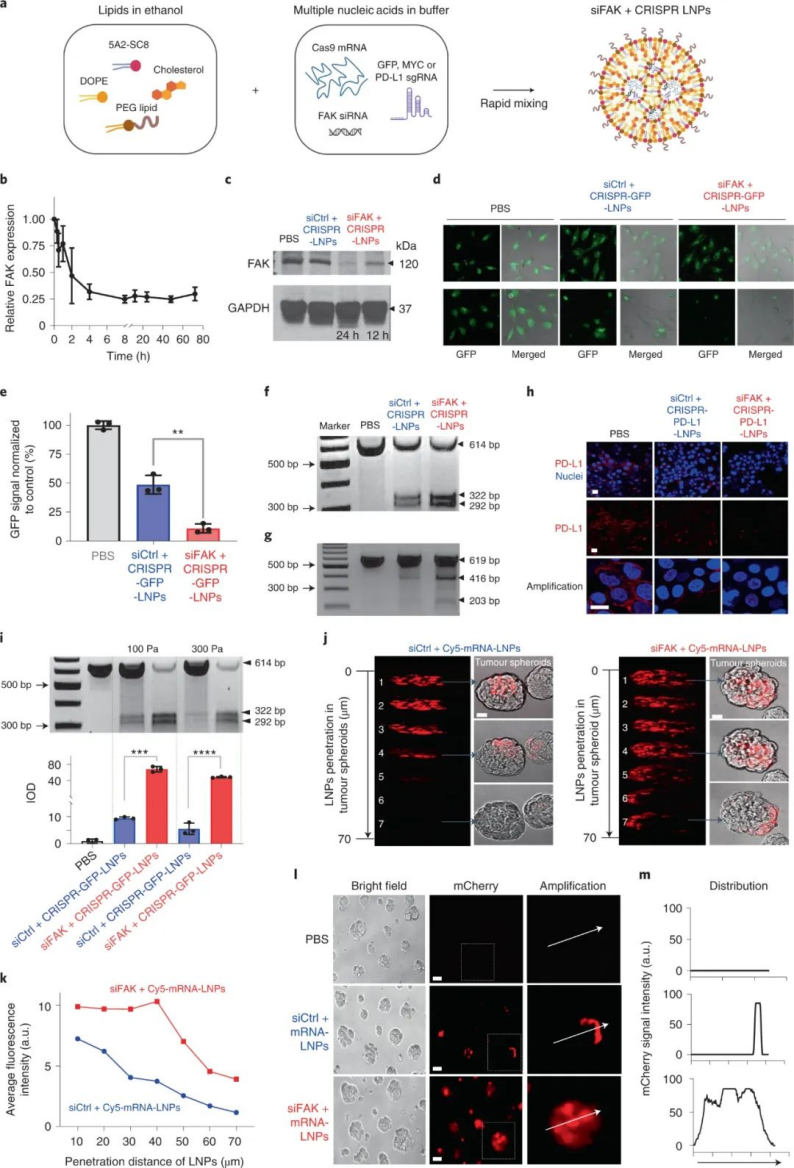
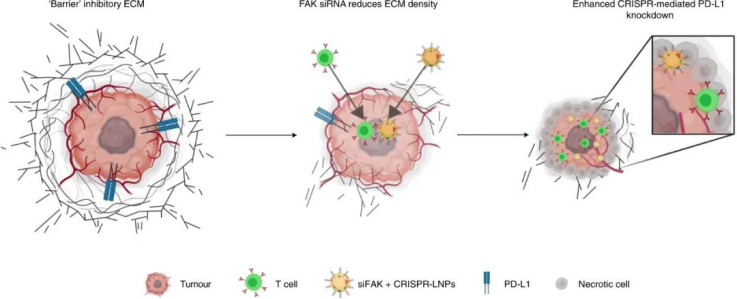
使用稳健且可编程的CRISPR/Cas系统对癌症相关基因进行体内失效或修复是一种令人兴奋的癌症治疗方法。然而,基于CRISPR的实体瘤疗法面临着重大的障碍。1)首先是癌症的无限复制潜力,因此编辑少量细胞将无法逆转疾病症状。因此,物理致密的肿瘤微环境成为肿瘤治疗的障碍,这阻止了纳米颗粒进入肿瘤中接触到更多的肿瘤细胞以抑制癌细胞复制潜能,并且阻碍了免疫细胞渗透到肿瘤组织中。由于丰富的 ECM,肿瘤微环境表现出刚性,从而增强了微环境的内在力学性能。反过来,ECM 在肿瘤中经历细胞诱导的变形。癌症和基质细胞可以对 ECM 施加相当大的肌动球蛋白产生的力,这有助于增加 ECM 刚度。在涉及粘着斑激酶 (FAK) 激活的过程中,这些“由内而外”传递的张力主要由附着细胞的整合素依赖性粘附介导。因此,靶向肿瘤组织中的 FAK 可以调节肿瘤细胞、基质细胞和肿瘤 ECM 的机械特性。此外,抑制 FAK 活性可调节肿瘤免疫环境,导致 CD8+ 细胞毒性 T 细胞浸润升高。然而,浸润的 T 细胞会被肿瘤细胞上的PD-L1过表达抑制,PD-L1 通过向免疫系统发送关键的“找不到我”信号来抑制 T 细胞反应。鉴于此,德克萨斯大学西南医学中心Daniel J. Siegwart等人开发了一种复合纳米粒子 siRNA+Cas9mRNA+sgRNA方法来降低肿瘤力学和细胞外基质 (ECM) 硬度,增强纳米粒子内吞作用和组织渗透,并降低治疗性修饰阈值,使基因编辑疗法能够为患有侵袭性肿瘤的基因工程小鼠提供显著的生存益处。

摘要图
研究人员将 siRNA(抗FAK)、mRNA(Cas9)和靶向 sgRNA 共同包装到自组装脂质纳米颗粒(LNP)中,以解决癌症治疗的两个关键障碍(僵硬的 ECM 和 PD-L1 过表达)。基于该课题组先前发表在Nature Nanotechnology(点击链接查看:Nature Nanotech:器官选择性靶向纳米颗粒,去哪个器官它来sort(附专访))上的研究,研究人员选用可以特异性靶向肝脏的可离子化氨基脂质树状大分子5A2-SC8,来结合带负电荷的RNA,构建了自组装LNP(siFAK+CRISPR LNPs),并对其质量比进行优化(5A2-SC8:胆固醇:DOPE:DMG-PEG2000:DSPE-PEG2000=15:30:15:2:1),从而导致靶向 LNP 能够以高 RNA 封装效率装载三重RNA。此外,该LNP由于内体pH下降而改变电荷,从而促进细胞摄取LNP后的内体逃逸。

细胞实验表明,复合LNP 成功地将所有三种类型的核酸递送至人类癌细胞系,以实现高效的基因沉默和基因组编辑,总体基因编辑增强了> 10 倍。值得注意的是,研究人员还发现了一个有趣的现象,即 FAK 敲低显著增强了纳米颗粒在多个肿瘤细胞系中的基因编辑功效。此外,在细胞球实验中表明,FAK 敲低可以克服肿瘤球的物理障碍并显著增加 RNA的递送。图|FAK 敲低增强了 LNP 介导的 mRNA 传递和 CRISPR 基因编辑为了研究 FAK 敲低如何增强 siFAK + CRISPR-LNPs 的基因编辑功效的机制,研究人员进行了细胞摄取途径实验,结果发现FAK 沉默主要通过调节网格蛋白和小窝依赖的内吞途径增加 LNP 的细胞摄取。膜内陷和内吞作用是这两种途径的主要步骤,涉及由肌动蛋白丝(F-肌动蛋白)和肌动球蛋白网络产生的张力调节的膜张力。进一步研究发现,用siFAK +CRISPR-LNPs处理的细胞应力纤维和肌动球蛋白网络均减少,这表明其处理的细胞收缩力明显降低。因此,siFAK+CRISPR-LNPs 通过降低收缩力以增强细胞纳米颗粒的内吞作用和渗透。
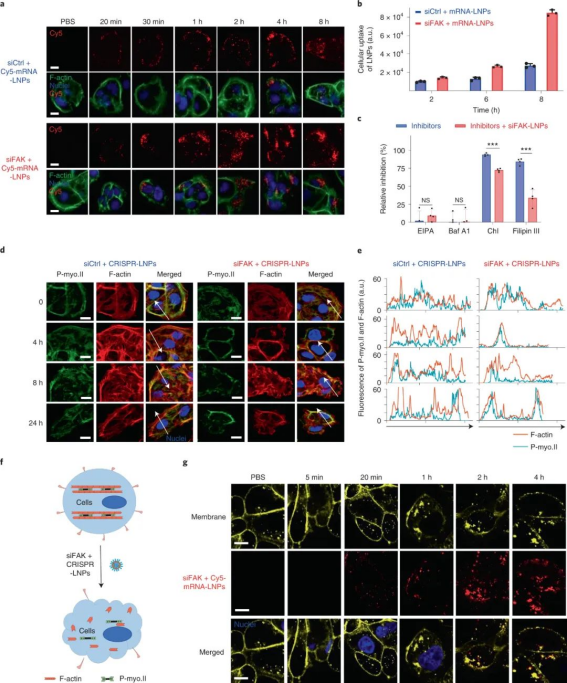
图|FAK 敲低通过动态改变收缩力和细胞膜张力来增强 siFAK + CRISPR-LNPs 的内吞作用
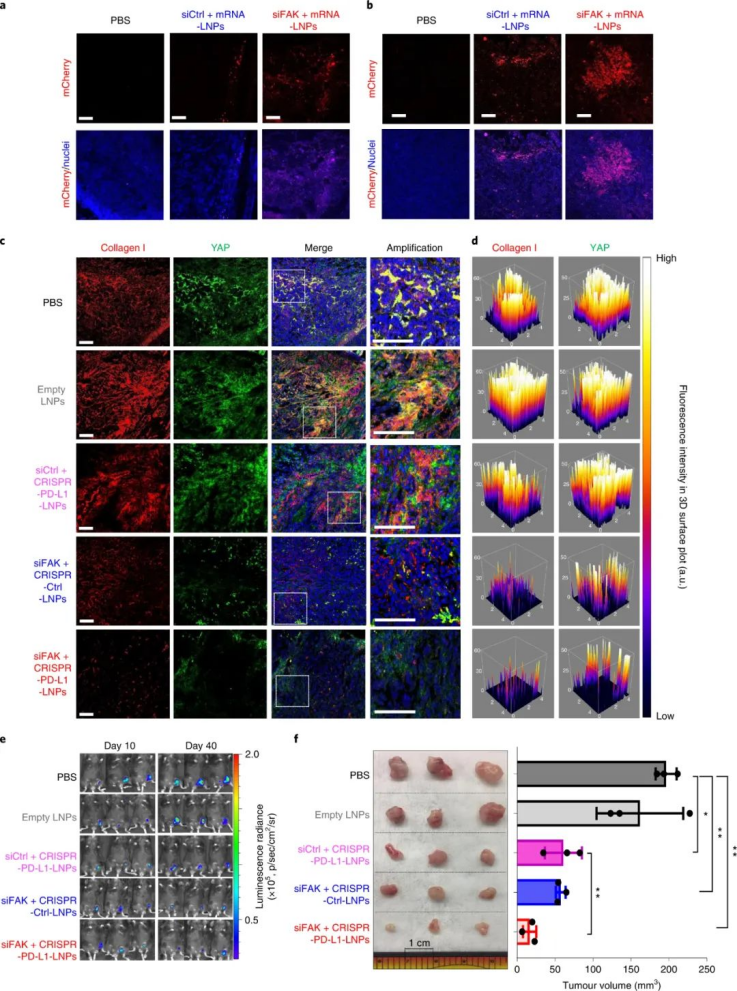
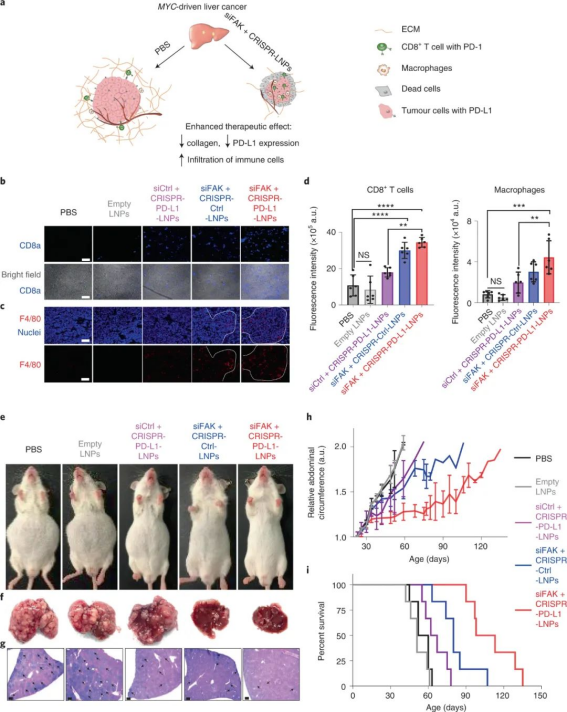
FAK在几种晚期实体癌中过度表达,尤其是卵巢癌,这会增加肿瘤细胞的收缩力和 ECM 的硬度。因此,研究人员评估了 siFAK +CRISPR-PD-L1-LNPs 的基因编辑和抗肿瘤功效。实验结果证明,通过 FAK敲低调节 ECM硬度有利于PD-L1的基因编辑,从而显著抑制肿瘤生长。此外,复合LNP还降低了卵巢癌小鼠转移模型中的潜在转移,改善了异种移植肿瘤小鼠模型中的癌症治疗,并显著延长了MYC驱动的侵袭性转基因肝癌小鼠模型中的生存期。研究人员还发现了,使用 siFAK +CRISPR-PD-L1-LNP 治疗的小鼠肿瘤中浸润的 CD8+ T 细胞和巨噬细胞数量也显著增加。图|siFAK + CRISPR-PD-L1-LNPs靶向肿瘤硬度和PD-L1抑制异种移植肿瘤生长图|siFAK + CRISPR-PD-L1-LNPs的全身给药显著延长了携带侵袭性、MYC驱动癌症的小鼠的生存期综上所述,该研究提供的证据表明,通过调节肿瘤组织的硬度可以增强肿瘤中的基因编辑,这种多路复用、可推广的策略可用于各种癌症类型的各种癌症靶点,为使用 CRISPR 基因编辑治疗癌症提供一种新方法。Zhang, D., Wang, G., Yu, X. et al. Enhancing CRISPR/Cas gene editing throughmodulating cellular mechanical properties for cancer therapy. Nat. Nanotechnol.(2022).https://doi.org/10.1038/s41565-022-01122-3

DanielJ. Siegwart是德克萨斯大学西南医学中心的副教授。他的研究计划专注于开发先进的基于聚合物和脂质的系统,该系统可精确控制大分子的结构、顺序和响应性,以用于药物输送、成像、遗传疾病和癌症。他是ReCode Therapeutics公司的共同创始人,致力于修饰tRNA负载的纳米颗粒,用于纠正引起囊性纤维化和其他疾病的无义突变。