过去几年,癌症免疫疗法取得了巨大的成功,它利用患者的免疫系统进行癌症治疗。免疫检查点阻断疗法、嵌合抗原受体 T 细胞疗法、溶瘤病毒、双特异性抗体和癌症疫苗已经彻底改变了癌症治疗,许多新的免疫治疗策略目前正在临床和临床前研究中。然而,这些免疫疗法仍然面临的一个重大障碍是到达致密肿瘤组织的免疫抑制区域。因此,环状 GMP-AMP 合成酶(cGAS)-干扰素基因刺激因子(STING) 途径已成为癌症免疫治疗的有希望的靶点。已经发现和开发了许多天然和合成的 STING 激动剂。这些激动剂已在临床前模型和临床癌症免疫治疗中进行了测试。环状二聚核苷酸 (CDN),如环状二聚体单磷酸鸟苷 (c-di-GMP)、环状二聚体单磷酸腺苷 (c-di-AMP) 和环状 GMP-AMP (cGAMP),是一类可引发强免疫反应。然而,使用CDN 进行癌症免疫治疗存在三个主要挑战。1)天然 CDN 是亲水性小分子,带高负电荷,不能穿过细胞膜。2)CDN 具有非标准的2',5'-磷酸二酯键和或标准的 3',5' 键(c[G(2',5')pA(3',5')p]),易受酶降解,导致靶组织生物利用度低。3)最后,将CDN 直接递送至肿瘤组织具有挑战性,因为脱靶组织中的 STING 激活会诱导毒性,从而导致治疗窗口狭窄。鉴于此,麻省理工学院Darrell J. Irvine等人利用CDN结合脂质纳米盘(lipid nanodisc, LND)解决了这些局限性,与金标准球形脂质体相比,LND可改善癌症免疫治疗。成果发表在Nature Materials上!
图|脂质纳米圆盘用于癌症免疫疗法
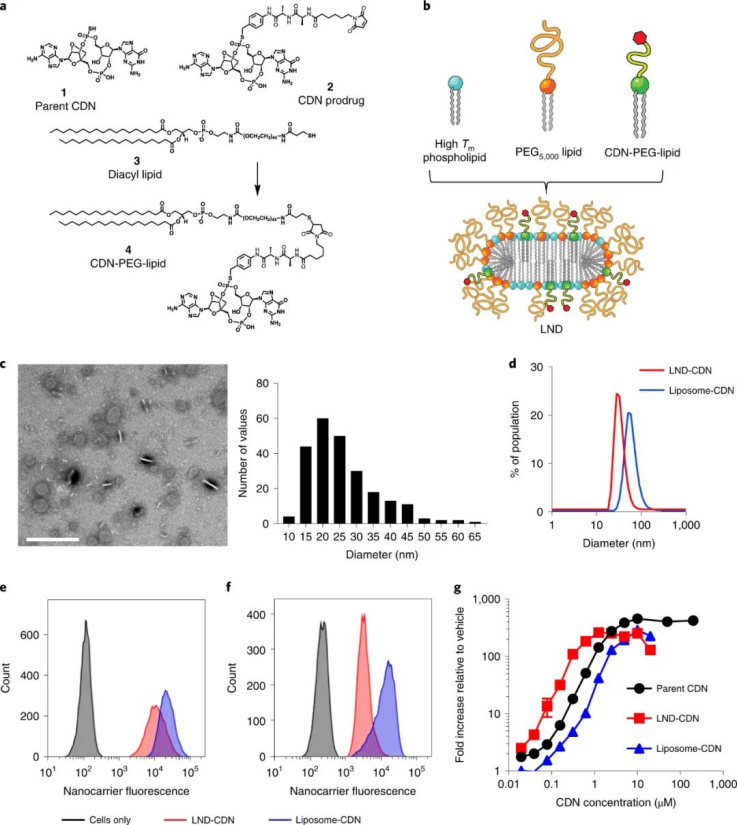
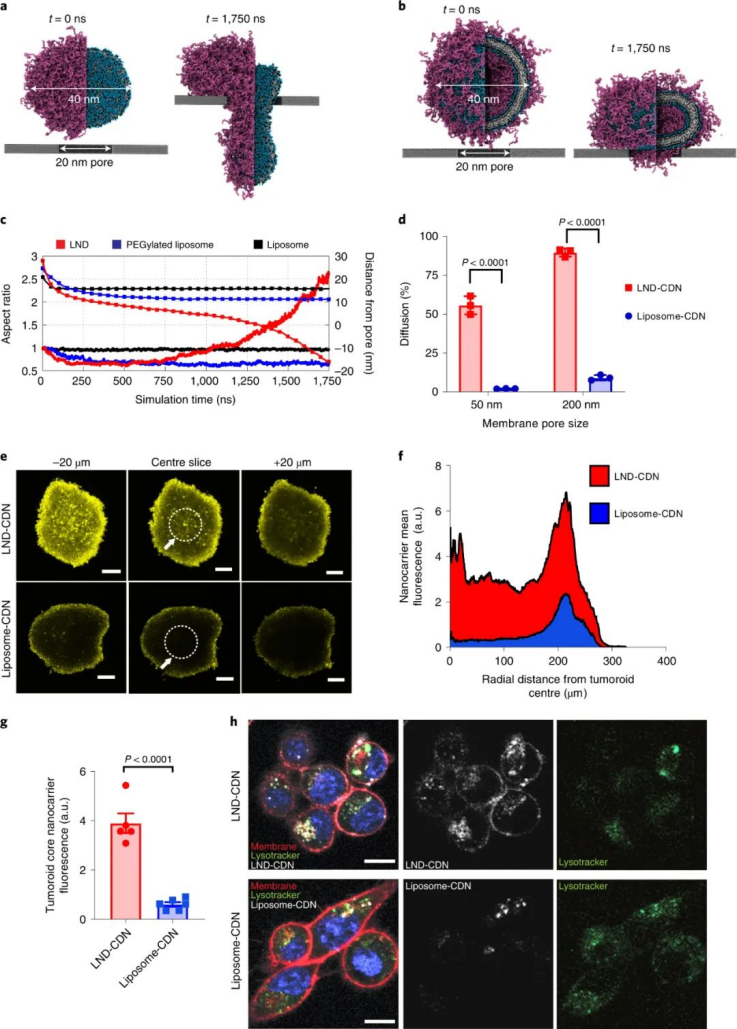
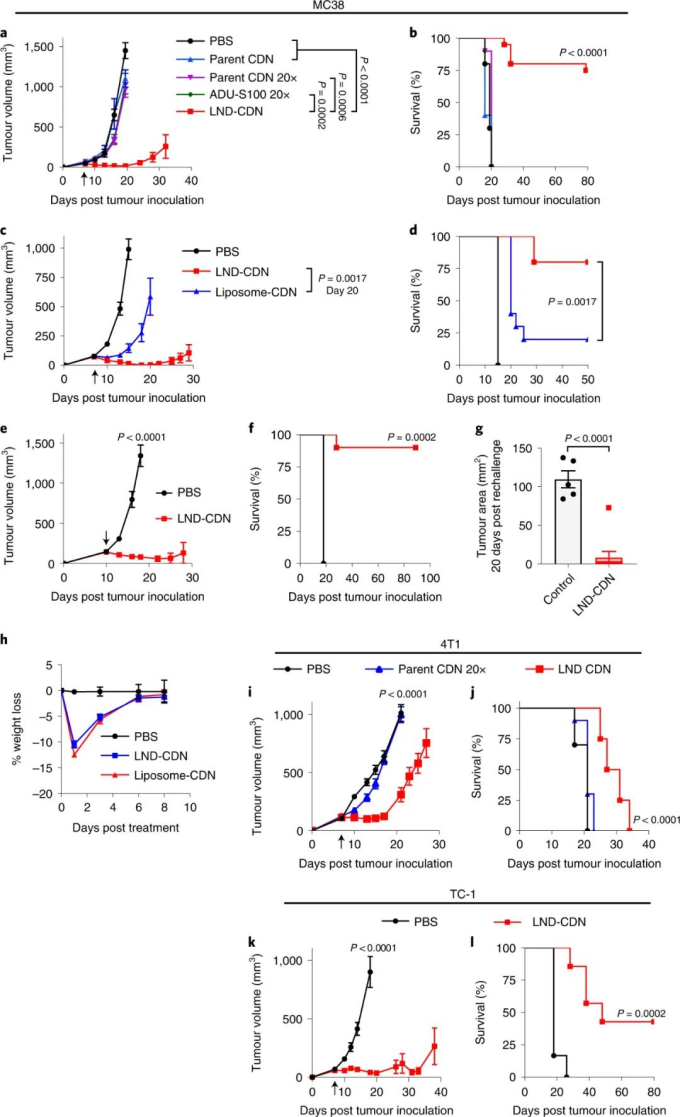
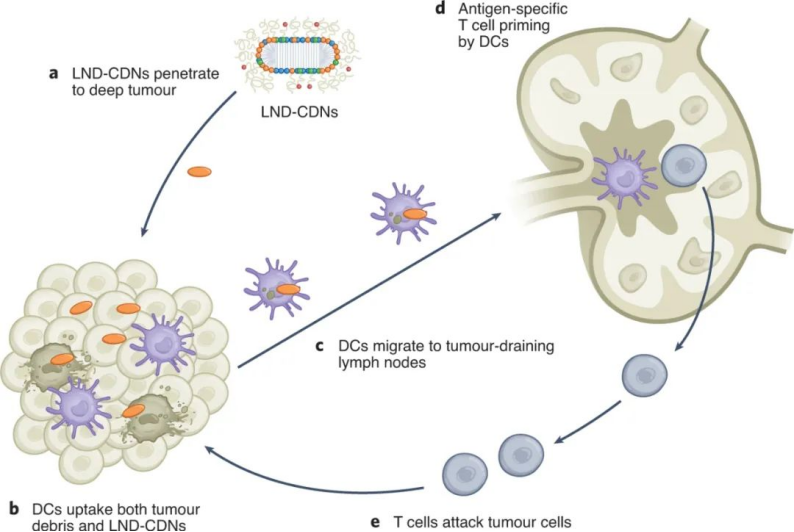
该课题组合成了一种CDN前体药物,通过将CDN与LND的聚乙二醇(PEG)脂质成分连接在一起,并使用一个在细胞摄取时被细胞内蛋白酶切割的肽连接体。与正常细胞相比,这种蛋白酶在肿瘤细胞中高度表达,这确保了肿瘤细胞中CDN释放的增加和靶向毒性的降低。与游离CDN相比,LND-CDN大大提高了CDN的半衰期。图|用于 STING 激动剂递送的纳米颗粒的设计和表征与使用脂质体递送的CDN相比,在小鼠体内全身施用LND CDN可实现CDN在整个肿瘤组织中的更大聚集,以到达垂死的肿瘤细胞和DC。与球形脂质体相比,由于LND的高宽高比和独特形状,使得LND具有更大的灵活性,增强了肿瘤的穿透力。重要的是,这使得在DC迁移到肿瘤引流淋巴结之前,肿瘤和淋巴中的DC可以同时吸收LND-CDN和肿瘤碎片,其中DC提供肿瘤抗原以引发长期适应性免疫反应。因此,这种疗法能够诱导原位抗肿瘤疫苗接种。图|与脂质体-CDN 相比,LND-CDN 在体外显示出优异的被动扩散和肿瘤穿透性然后,研究人员在三种不同的肿瘤模型(这些模型使用了来自相同小鼠品系的肿瘤细胞)中测试了单剂量疗法,研究人员发现 LND-CDN 在 MC38 结肠癌小鼠模型中实现了约 80% 的肿瘤排斥,在4T1乳腺癌小鼠模型中,中位生存时间增加了约50%。然而,当使用LND-CDN治疗携带 MC38 肿瘤的 STING-/- 小鼠却完全无效,这证实了 STING在这种治疗方法中的作用。图|单剂量的 LND-CDN 在多种同基因肿瘤模型中显示出治疗效果令人惊讶的是,LND-CDNs 仅在小鼠中引起短暂的体重减轻,在几天内恢复,在给药剂量下没有出现主要器官毒性的迹象。总之,这些小鼠模型证实了 LND-CDN 能够诱导急性肿瘤缩小,同时启动适应性免疫系统以产生强大的抗肿瘤反应。综上所述,这些结果拓展了癌症治疗领域,因为这种脂质纳米圆盘平台可以潜在地用于将一系列的其他治疗货物输送到肿瘤中。例如,携带在肿瘤中积累的化疗药物的 LND 可能会在降低毒性的同时增强抗肿瘤功效;提供成像方式的 LND 有助于早期肿瘤诊断;携带编码细胞因子、检查点阻断剂或其他肿瘤抑制蛋白的信使 RNA (mRNA) 的 LND 可能会产生更好的抗肿瘤结果。此处描述的 LND-CDN 的主要优势之一是,与球形脂质体相比,由于其蛋白酶响应的连接头和独特的形态,它可以诱导肿瘤细胞中更高的 CDN 积累。这可以减轻系统性递送治疗性货物的潜在脱靶效应。此外,探索这种非靶向 LND 和被动肿瘤积累方法与用主动靶向配体(如单克隆抗体)进一步功能化的制剂相比,将会很有趣。未来的工作还应解决 CDN 是否辅助针对纳米盘的 PEG 成分的体液反应,这可能会诱导抗 PEG 抗体反应,从而导致纳米盘的快速清除。这种反应可以通过用 PEG 替代品代替 PEG 来避免,例如目前在纳米医学和生物材料领域正在研究的其他两性离子聚合物。虽然需要进一步研究以充分利用 LND 用于癌症免疫治疗的潜力,但与传统的球形脂质体载体相比,LND 平台在治疗效果方面取得了显著进步。1.Dane, E.L., Belessiotis-Richards, A., Backlund, C. et al. STING agonistdelivery by tumour-penetrating PEG-lipid nanodiscs primes robust anticancerimmunity. Nat. Mater. (2022).https://doi.org/10.1038/s41563-022-01251-z2.Gong, N., Mitchell, M.J. Lipid nanodiscs give cancer a STING. Nat. Mater.(2022).https://doi.org/10.1038/s41563-022-01270-w

Darrell Irvine ,麻省理工学院教授和霍华德休斯医学研究所研究员。其研究重点是工程工具在细胞免疫学问题上的应用以及疫苗和药物递送新材料的开发。目前的努力集中在与 HIV 疫苗开发和癌症免疫治疗相关的问题上。这项跨学科工作已获得众多奖项的认可,包括贝克曼青年研究员奖、美国国家科学基金会职业奖、TR35等奖项。发表Nature、Science、Nature Materials、Nature Biotechnology、Nature Biomedical Engineering等70多篇研究论文,并拥有众多专利。以下列出该课题组近年来在高水平期刊上发表的部分研究成果