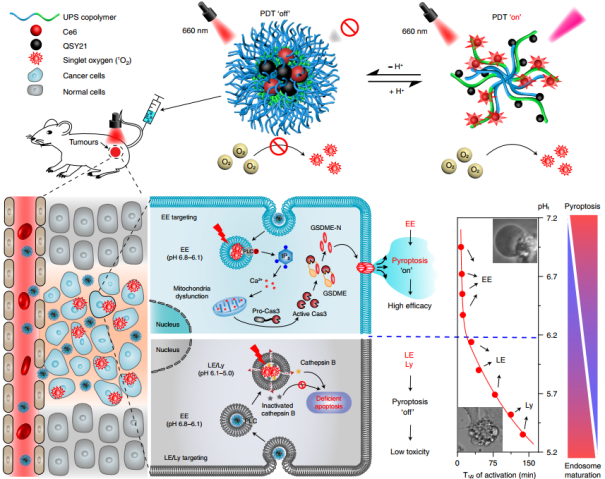
焦亡是一种由gasdermin介导的程序性坏死,通过膜穿孔发生,可用于癌症治疗。然而,如何在不影响正常细胞的前提下同时诱导特异性的癌细胞焦亡仍是一项严峻的挑战。越来越多的证据表明,细胞焦亡可以由内吞细胞器应激诱导。各种无机纳米粒子,包括金属氧化物纳米粒子、炭黑纳米粒子、介孔二氧化硅纳米粒子和金属有机骨架纳米粒子,以不受控制的方式诱导不同细胞类型的细胞焦亡。这些纳米粒子引起的细胞焦亡代表了潜在的生物医学应用和生物安全问题。因此,在癌症治疗中,迫切需要开发一种强大的纳米技术来实现针对癌症而不是正常组织的细胞焦亡杀伤。近年来,纳米粒子被设计于靶向溶酶体并诱导不同模式的程序性细胞死亡,例如不依赖半胱天冬酶的溶酶体细胞死亡、铁死亡、自噬和细胞焦亡。然而,整个内体/溶酶体成熟阶段是否参与程序性细胞死亡的信号通路以及如何调节纳米材料的焦亡诱导活性仍然未知。鉴于此,北京大学汪贻广教授、张强教授和游富平研究员开发了一种酸激活的纳米光敏剂库,其可用于时空靶向核内体成熟的不同阶段,从而实现可调的细胞焦亡。

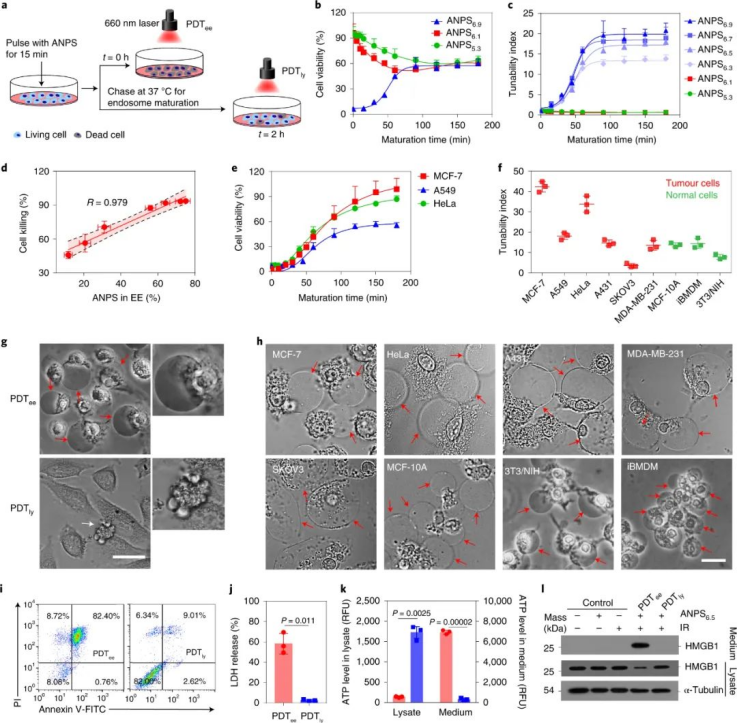
图|ANPS 的示意图和 ANPS 库通过内体成熟的时间分化引起的可调焦亡研究人员设计了一个小的酸激活纳米光敏剂 (acid-activatable nanophotosensitizer, ANPS) 库(整体基于mPEG-bP(R1-rR2)),具有从 6.9 到 5.3 的明显 pH 转变 (pHt),涵盖了内体成熟阶段的整个 pH 范围 (pH = 7.0–5.0)。库中的每个 ANPS 在 pH 7.4 时保持“关闭”,而在预先设计的 pHt 从 5.3 到 6.9 时分解并触发光动力疗法 (PDT) “开启”。使用这个 ANPS 平台,研究人员成功地在时空上将内溶酶体途径区分为 10 个不同的成熟阶段,pH 间隔为 0.2,并系统地研究了它们通过在体外精确靶向每个酸性内吞区域来微调癌细胞中焦亡诱导活性的能力和体内。通过细胞实验发现,研究人员证明了纳米颗粒通过早期内体(EE )中 PLC 激活的线粒体凋亡途径引发了强大的 GSDME 介导的细胞焦亡,而它们的焦亡诱导活性在后期内体(LE) 和 溶酶体(Ly )中受到抑制。简单地理解就是说:在纳米粒子进入细胞早期,内体的pH没那么酸时候,该处理的细胞具有光细胞毒性;到了后期,随着内体的酸度持续增加后,光细胞毒性减弱。
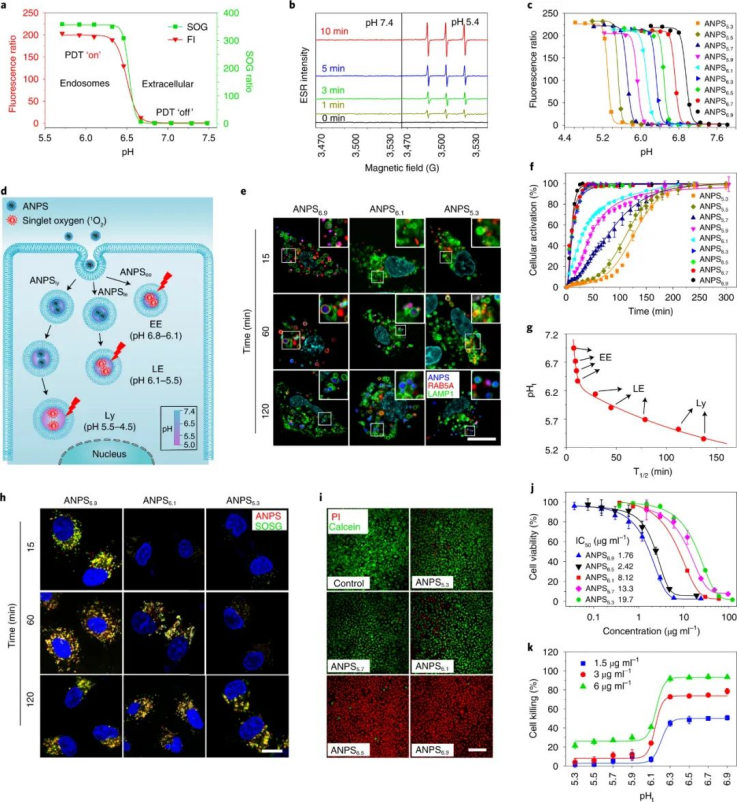
图|通过设计具有 pH 分化能力的 ANPS 文库来调整细胞器特异性细胞毒性
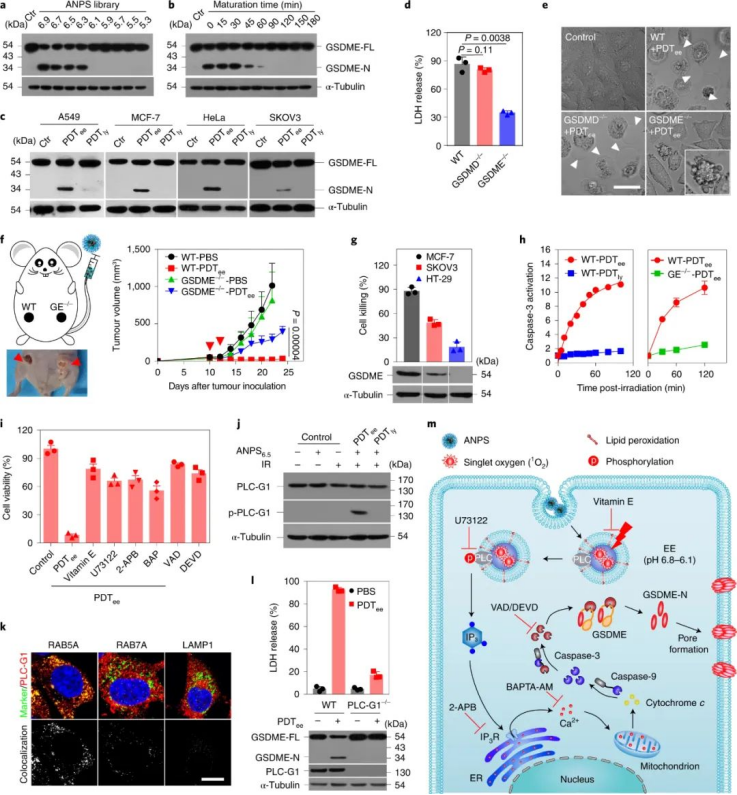
图|EE 靶向 PDT 通过细胞焦亡获得出色的抗肿瘤功效此外,研究人员还揭示了这些纳米材料微调细胞焦亡形式的细胞死亡的潜在机制。研究人员发现 ANPS 可以通过特异性激活磷脂酶 C (phospholipase C,PLC) 特异性地引发 GSDME 介导的各种 GSDME 阳性癌细胞的细胞焦亡,脂质过氧化的信号转导是由纳米光敏剂介导的早期内体中的氧化应激引发的过程;然而,在纳米货物运输到晚期内体和溶酶体后,其诱导焦亡的活性显着降低。因此,这种细胞焦亡纳米调谐器对各种表达人类 GSDME 的癌症类型实现了惊人的治疗效果,同时体内的全身副作用最小化。图|PLC 激活和 caspase-3 介导的 GSDME 切割有助于 PDTee 诱导的细胞焦亡综上所述,该研究为内体成熟如何精确调节纳米材料的细胞焦亡诱导活性提供了新的见解,并为细胞焦亡介导的癌症免疫治疗提供了基础。Chen, B., Yan, Y., Yang, Y. et al. A pyroptosis nanotuner for cancer therapy. Nat. Nanotechnol. (2022). https://doi.org/10.1038/s41565-022-01125-0