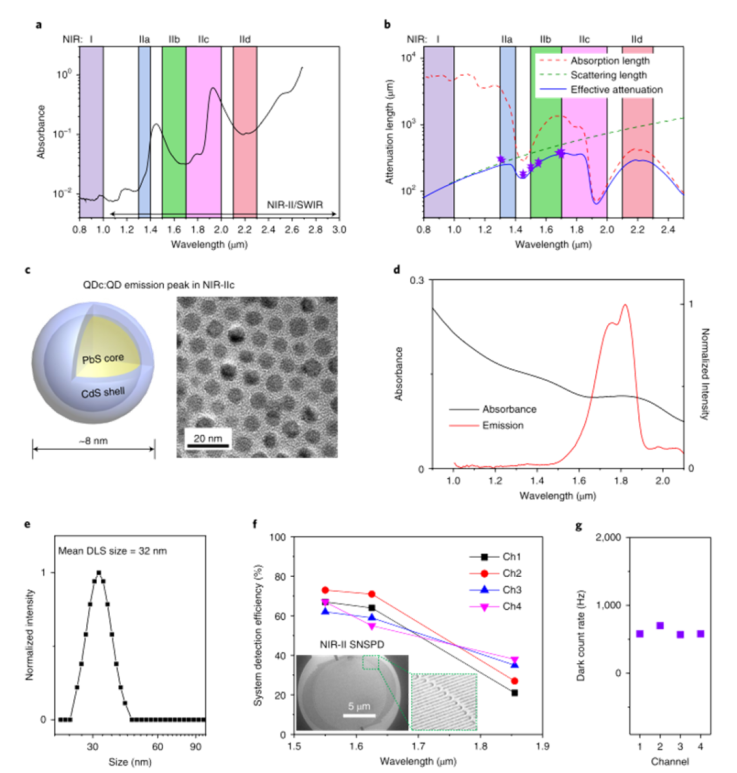
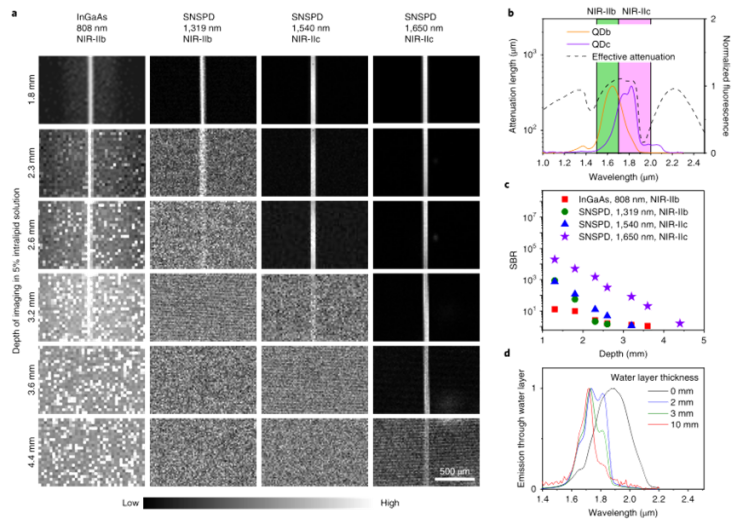
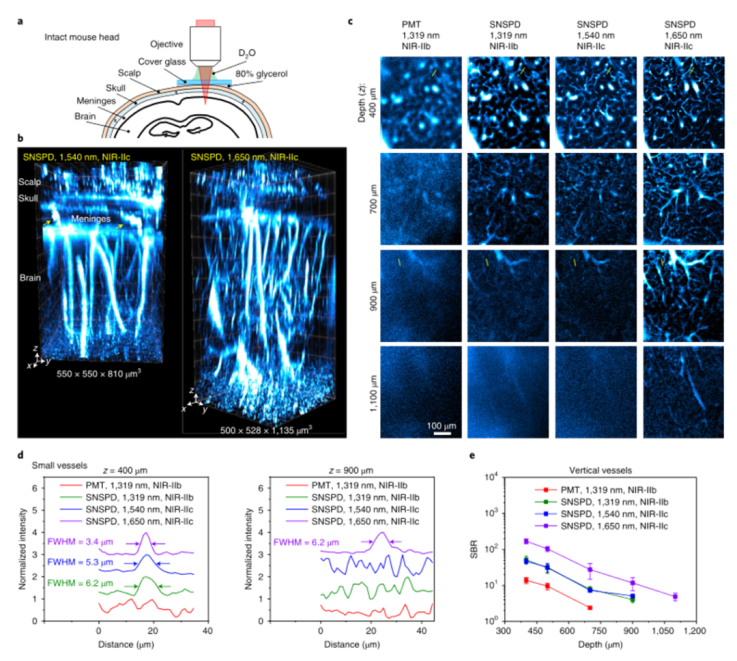
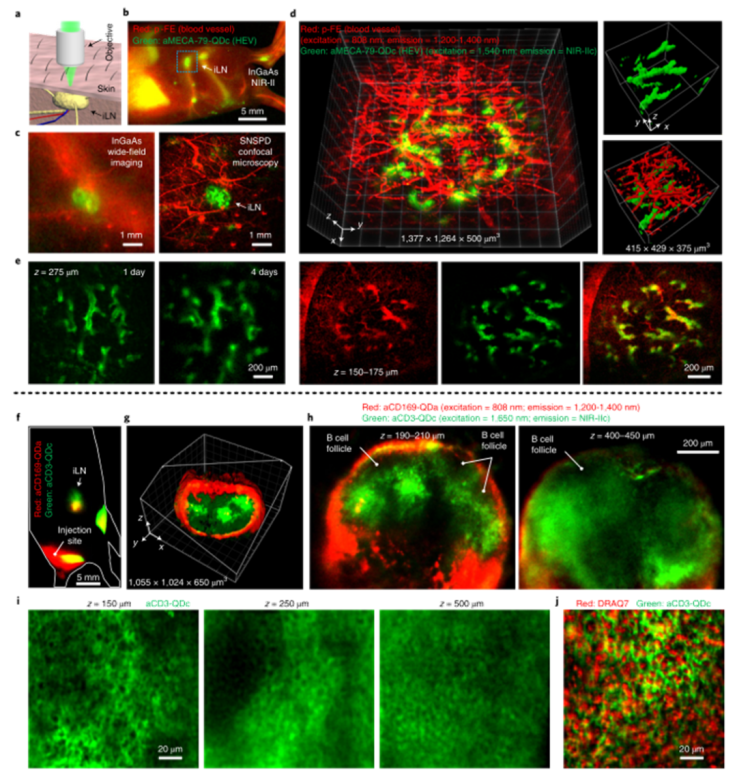
小鼠的活体高分辨率光学显微成像使生物结构、细胞表面受体的分子性质和特性;以及单细胞水平上的细胞过程、事件和功能的研究成为可能。然而,生物组织的异质性和复杂成分是一个重大挑战,由于光散射和内源性组织自发荧光,限制了成像穿透和信号背景比(SBR)。通过多光子成像将激发波长扩展到近红外(NIR)和短波红外(SWIR)(900–3000 nm)范围,在抑制散射和提供更大穿透深度方面非常成功,但仍然依赖于侵入性手术来暴露潜在器官,如脑和淋巴结,以提供足够的成像深度和分辨率。 近年来,已开发出各种荧光/发光染料和发射范围在1000–1700 nm的纳米粒子探针,包括有机小分子、碳纳米管、量子点(QD)和稀土纳米粒子。然而,水的吸收和散射仍然是限制光学成像深入生物组织的主要因素。鉴于此,来自斯坦福大学的戴宏杰团队展示了发射波长约为1880 nm的生物相容性核壳硫化铅/硫化镉量子点和用于高达2000 nm单光子检测的超导纳米线单光子探测器,启用1700–2000 nm(NIR IIc)范围内的单光子激发荧光成像窗口,激发波长为1650 nm,是迄今为止活体小鼠成像中最长的单光子激发和发射。近红外IIc共聚焦荧光成像通过一个完整的小鼠头部达到约1100μm的成像深度,可以在无需任何手术的情况下对小鼠腹股沟淋巴结进行无创细胞分辨率成像。该研究实现了直径小至6.6μm的高内皮微静脉以及淋巴结中CD169+巨噬细胞和CD3+T细胞的活体分子成像,为在单细胞/血管水平上纵向进行淋巴结免疫运输的无创活体内成像开辟了可能性。研究人员通过改进的有机金属路线合成了发射峰约为2009 nm的PbS量子点。然后通过阳离子交换法在PbS核上生长CdS壳,以保护PbS核免受降解。壳层生长步骤将核心的发射峰移动至约1880 nm。产生的PbS \CdS量子点在NIR IIc中具有发射峰(本文中称为QDc),显示出约8 nm的窄尺寸分布。最终水稳定的P3 QDc在NIR IIc中显示出约1820 nm的峰值发射波长。P3 QDc的动态光散射分析表明,水溶液中的平均流体动力学尺寸约为32 nm。InGaAs探测器的光谱检测上限为1700 nm,这被1550 nm至2000 nm波长的SNSPD所克服。单光子探测器是在优化的铌钛氮化物(NbTiN)超导薄膜上制造的,该薄膜具有优化的超导纳米线宽度和探测器几何结构。SNSPD通过在1200–2000 nm范围内传输的单模光纤连接到自制的共焦显微镜,允许在非散射介质中进行衍射限制分辨率。图|硫化铅量子点和超导纳米线单光子探测器,可实现1700 nm以上的荧光成像研究人员首先对直径为50μm的毛细管进行成像,该毛细管充满P3 QDb或P3 QDc的水悬浮液,发射峰位于近红外IIb(1500–1700 nm)或近红外IIc(1700–2000 nm)区域,该区域浸入约5%的脂内溶液中,模拟小鼠脑组织中的血管。通过2-10 mm厚的水层检测到的QDc荧光信号显示,由于吸水,减少了>1900 nm的信号。对于使用InGaAs相机(激发=808 nm)在NIR IIb范围内对填充QDb的毛细管进行宽场成像,在SBR为1.28的脂内溶液中,毛细管在约3.2 mm的浸入深度处被解析,但在4.4 mm的深度处SBR较低。由于吸收和散射的综合效应,与其他波长的激光(800 nm、1000 nm、1319 nm和1540 nm)相比,通过混浊介质传输的1650 nm激光显示出最低的强度衰减和最低的光束展宽,这是近红外IIc成像的理想选择,可以优化激发光和发射光通过生物组织的穿透深度。NIR IIb和NIR IIc子窗口中完整的小鼠头部成像:在尾静脉注射P3 QDc后,研究人员通过完整的小鼠头部对血管进行NIR IIc无创三维共焦成像。在1540 nm或1650 nm激光激发下,分别在高达800μm或1100μm的深度进行三维体积NIR IIc成像,解析完整小鼠头部各层(包括头皮、颅骨、脑膜和约550μm或约900μm厚的大脑皮层)中循环的P3 QDc标记血管。观察到穿过连接颅骨和大脑皮质的脑膜的血管样通道。NIR IIc共焦显微镜和NIR IIb LSM18都可以抑制散射光和离焦光,从而实现小鼠头部的高对比度三维成像。图|NIR IIc窗口中完整小鼠头部的无创活体共焦显微镜检查小鼠淋巴系统的无侵入性活体NIR-IIc共聚焦显微镜成像:淋巴系统在感染、癌症和疫苗接种的免疫反应中起着至关重要的作用。研究人员通过完整的小鼠皮肤对淋巴结进行成像,这与之前通过侵入性手术安装透明窗口的活体显微镜不同。首先在小鼠ILN的HEV上进行PNAd的无创体内NIR IIc分子成像。研究人员将抗MECA-79抗体与P3 QDc(aMECA-79-QDc)结合,通过尾静脉注射到小鼠体内,24小时后注射有机探针(p-FE;激发=808 nm;发射=1200–1400 nm)作为血管NIR-II显像剂。在注射p-FE 10分钟后在NIR IIb中进行宽场成像(QDc在NIR IIb和NIR IIc中均显示发射),并在ILN中观察到抗MECA-79靶向QDc发射,在1200–1400 nm发射范围内通过循环p-FE成像标记血管。为了在细胞分辨率下实现无创性活体近红外IIc共聚焦显微镜成像,研究人员对完整小鼠IL-N中的CD169(表达于囊下窦巨噬细胞)和CD3(表达于T细胞)进行了双色分子成像。宽视野图像显示ILN中有较强的aCD169 QDa和aCD3 QDc信号。共聚焦显微镜显示由aCD169 QDa标记的CD169+巨噬细胞勾勒出囊下窦;用aCD3-QDc标记淋巴结内部T细胞区的CD3+T细胞。1650 nm激发下NIR IIc窗口中CD3+T细胞的高分辨率共聚焦显微镜成像,在完整的ILN中,在细胞外侧(中间深色)标记的T细胞分辨率高达500μm。体外,DRAQ7和aCD3 QDc的体外共焦显微镜清楚地分辨出aCD3 QDc在细胞核内标记DRAQ7的T细胞。这些结果在体内完整淋巴结中建立了细胞分辨率的无创近红外IIc共聚焦显微镜成像。图|小鼠淋巴系统的非侵入性活体NIR-II共焦显微镜具有单光子探测器的NIR IIc共焦显微镜通过完整的小鼠头部和淋巴结纵向提供无创细胞分辨率成像。单光子激发NIR IIc共焦显微镜采用1650 nm激发,接近双光子或三光子显微镜所用的最长激发波长约1700 nm。这些类似的激发光在穿过组织厚度z时会经历类似的衰减。然而,尽管单光子激发显微镜中的荧光发射与光强I(z)成线性比例,但双光子和三光子荧光是非线性的,分别与激发光的二次方和三次方成比例,并且衰减速度比单光子情况更快。NIR IIc共焦显微镜以较低的成本提供了多光子显微镜的替代方法。将近红外IIc共焦显微镜和多光子显微镜与约1650–1700 nm的激发相结合,可以使用更广泛的探针对复杂的生物系统进行多通道成像。在激光安全方面,通过这项工作用于体内成像的大约60只小鼠在成像后都是安全健康的,没有激光引起皮肤灼伤的迹象(发红、疤痕等)。没有一只老鼠在成像后表现出任何异常行为,或疼痛或不适的迹象。成像后无需处死任何一只小鼠。此外该研究采用了一种方法,即在增加组织深度的同时线性增加激光功率,以保持在1650 nm激光的1 J cm–2激光安全极限以下(美国国家激光安全使用标准,ANSI Z136.1),同时最大化成像信号。还需要注意的是,成像所需的激光功率/注量取决于所用染料/探针的亮度。虽然目前的QDc在安全极限范围内足够明亮,可用于体内成像,但探针开发的新进展可使安全成像远低于1 J cm–2极限。F. Wang, F. Ren, Z. Ma, L. Qu, R. Gourgues, C. Xu, A. Baghdasaryan, J. Li, I.E. Zadeh, J.W.N. Los, A. Fognini, J. Qin-Dregely, H. Dai, In vivo non-invasive confocal fluorescence imaging beyond 1,700 nm using superconducting nanowire single-photon detectors, Nature nanotechnology, (2022).https://doi.org/10.1038/s41565-022-01130-3