CT、超声、核磁共振、PET等等,病人面对着繁杂的影像检查往往都是满心抱怨,他们奔走在各个检查室门口,急于看病的他们却不得不一直排着队做检查。其实,不仅仅是病人对此有所抱怨,医生在手术台上等待病理检查结果也是常态,可以说一次检查一份数据一种结果的传统影像方式带来的时间与金钱成本给医患双方都带来了困扰。
影像成像诊断早已在临床上被广泛用于包括癌症在内的多种疾病的确诊、定位以及扩散的判读。尤其是癌症通常拥有异质性的,它们的分子指纹随时间、位点之间和治疗反应而变化。因此单通道的检测方式面对复杂的病理进程,其检测窗口与敏感度都是受到限制的。反观多重检测,用于指示检测和跟踪多个过程或生物标志物,多参数的相互比对可以有效克服上述困境。例如医学成像获得的诊断信息的准确性和价值可以通过进行液体活检来佐证。多模态临床成像的进步使正电子发射断层扫描(PET)与X射线计算机断层扫描(PET-CT)和磁共振成像(PET-MRI)的集成成为可能。这种多模态系统是检测多个分子靶标和生理生物标志物的有力工具。分子信息与全身成像信息的结合使得能够跟踪疾病的发作和进展,监测治疗效果并预测疾病复发。
近日,斯隆—凯特林癌症研究所的Chrysafis Andreou与哈佛医学院的Ralph Weissleder 和Moritz F Kircher等人讨论了一中提供多重信息的成像技术领域,包括术中,术前和离体方法。专注于在单次成像期间获得的“多通道”信息,这些信息来自连续获得的图像或从复杂的多变量图像中计算得出,其中每个像素包含不同参数(例如光谱强度)的测量值。多通道联用可以跨越解剖学,生理学和分子水平等诸多层面,并且随着更多的通道同时成像,提供的信息可以大大增加。然后,这些信息可以随时间在空间上显示,可单独在通道中可视化,或为多个通道合并的组合图和定量图呈现。

多重成像技术
目前临床成像的诊断中很难考虑到肿瘤的异质性,而作为诊断金标准的活检也仅提供肿瘤的一小部分数据。因此,临床肿瘤病人的治疗决策往往是根据不完整甚至是具有误导性的信息做出的。同样具有挑战性的是,癌症的分子谱会随着时间的推移而改变,而重复活检明显是不现实的。所以,多重成像这种可以良好分辨肿瘤时空变化的多维度分析技术在实现患者肿瘤个性化治疗与精准治疗中有着极佳的潜力。并且多重检测还可以改善生物标志物之间空间相关性的探测,以确定药物分布和受体占用,或定量癌症中经常过度表达的信号通路激活。虽然本文将癌症的诊断、治疗和复发监测作为多重成像的主要针对领域,但在许多其他类型的疾病中也存在类似的需求。
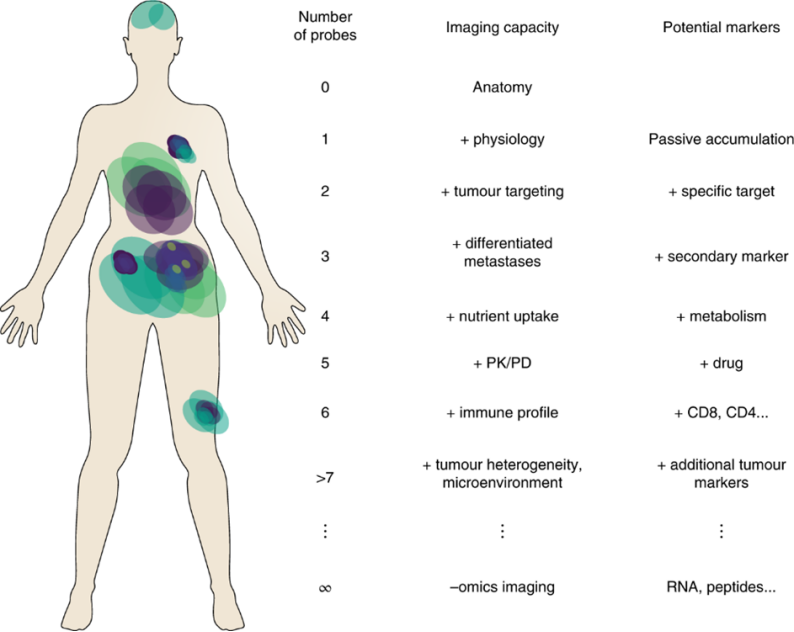
图1 用于多重成像最佳的生物标志物组合
多重检测的价值取决于基础成像技术的空间分辨率和面临的临床问题,医生或研究人员需要为疾病特定环境选择最合适的工具。图2中显示了适合于一个或多个靶标的分子成像主要模态。很明显,目前构成医学成像支柱的快速检测在分辨率和多重检测性上都受到限制。光学方法在分辨率和多重性方面都更好,但主要适用于术中环境,因为光的组织穿透能力不强,而高分辨率方法通常需要在成像前切片和处理样品。它们不适合快速诊断或用于资源匮乏地区。最为快速,经济高效的方法主要基于细胞分析,虽然可以提供丰富多维度的分子信息,但是由于这些方法依赖于非原位收集的细胞,因此它们不提供与肿瘤扩散相关的空间或解剖学信息。正是单一技术的诸多局限性,促使了多技术联合克服彼此的缺陷构成了多重成像技术。
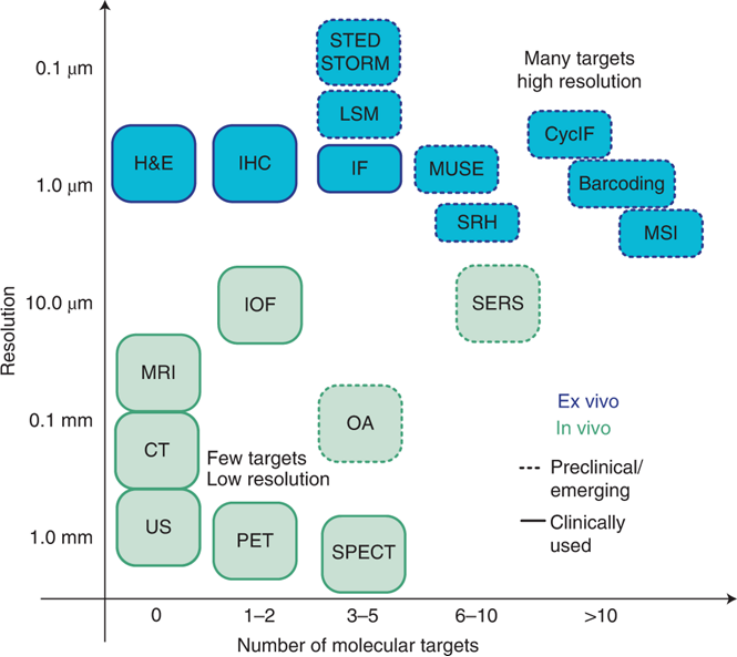
图2 根据分辨率和多重成像能力进行排列的常见成像技术
取样的离体成像:

图3 基于细胞的多重成像技术
细胞条形码技术
最近出现了一种FNAs技术,有望替代以图像引导为核心的活检方法,其利用细胞样本而不是组织。作为一种侵入性较小的方法,FNAs的耐受性要好得多,并且引发并发症的概率较低;然而,FNAs提供的样品量有限,使得使用传统方法(如染色和流式细胞术)处理它们更具挑战性。事实上,在临床上对这种细胞进行有效的分析是困难,耗时和昂贵的。
最近,抗体-DNA条形码方法允许通过使用定制设计的寡核苷酸-荧光团偶联物快速重新染色收集的细胞。这是一种强大的方法:每个探针都标有定制的可读序列,并且识别具有唯一性。一种相关的技术,肿瘤表型的单细胞分析(SCANT),鉴定不同的抗体-DNA条形码存在,并依次成像,使得查询相关蛋白信号通路并使用相关药物成为可能(图 3a)。
细胞全息显微成像
数字全息显微成像是一种无透镜、可实现具有相对较大视场的技术,它不是对特定的焦平面进行成像,而是检测来自失焦微观物体的基于衍射的全息图案。通过用微米大小的磁珠标记细胞以实现分子特异性是,可以使用图像处理或计算机视觉技术来确定磁珠的存在和类型。由于不需要复杂的成像设备,因此在资源有限的环境中,数字全息显微成像已成为了一种独立诊断工具。
虚拟组织学
虽然组织学鉴定仍然是临床和临床前应用最为直观的金标准,但它提供的多重检测潜力与信息量有限。而虚拟组织学这种新兴的成像技术旨在取代或增强传统的组织学染色,并通过以最少的处理量计算推断细胞和组织结构来提供一种静态组织结构分析。如紫外表面激发显微镜(MUSE)、受激拉曼组织学(SRH)、光片显微镜(LSM)等等。虽然这些方法都补充了传统组织学染色鉴定的缺陷,但每种方法都有各自的优势和挑战,这影响了它们各自的临床转化、监管批准和临床使用的潜力。
循环组织染色方法
最近,已经开发了几种在福尔马林固定组织中使用循环免疫荧光(CycIF)的多重染色方法,该方法可以通过顺序应用靶向荧光团,对样品进行成像,然后在应用下一个荧光团之前将其灭活,从而在单个切片或样品上对大量的靶标进行成像。通过这种方式,小样本量活检标本可以提供更多关于肿瘤中多种分子生物标志物表达的信息。
组织清除功能显微镜
这种成像将允许检测整个切除的组织标本,组织清除使生物组织透光性大大增加来促进大样品的3D光学成像效果,从而可以在不衰减的情况下检测造影剂(图 3c)。到目前为止,引入更快的图像采集方案和各种组织清除方法已经大大改善了深部组织成像,主要是在神经生物学应用中。然而,标记和成像肿瘤仍然存在一些局限性,例如抗体穿透缓慢、标记不均匀和成本较大等等。
质谱成像
质谱成像(MSI)使用不同的质谱方法,根据其分子量获得组织样品中代谢物,药物,肽和蛋白质的空间分布。最常见质谱成像即二次离子质谱成像(SIMS)。其的独特之处在于它能够在未知的情况下分析组织中的生物分子,并绘制药物及其代谢物在组织中的分布。虽然MSI的多重检测能力很高,但是设备成本相对较高,破坏样品,以及分析的复杂性,耗时性和半定量性都是该技术走向临床面临的挑战。
体内全身成像:
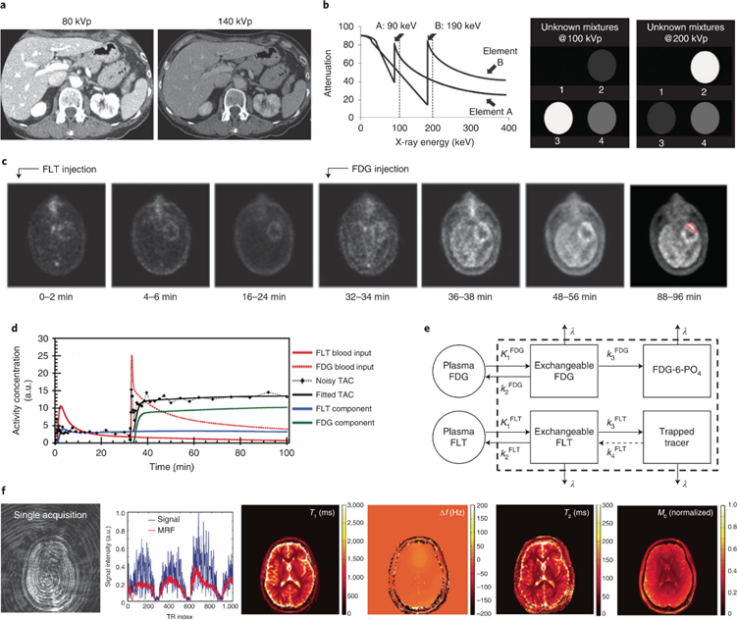
图4 临床多重成像模式
X射线计算机断层扫描
CT依靠内源性造影剂绘制解剖特征图,基于不同化学成分的组织对X射线的不同吸收。因此,CT根据身体结构的固有对比度提供精细的解剖图像,并可用于放射分析,以便根据肿瘤的形状、纹理和其他特征识别和表征肿瘤。此外,外源性造影剂可用于增强血管系统(使用碘)或胃系统(使用钡)的图像。双能CT使用两个不同能量的X射线发射器提供差异元素图。通过额外的造影剂和额外能量射线的测量,可以通过简单的线性拟合来确定更复杂的混合物。然而,CT 的敏感性有限,需要摩尔浓度的造影剂,这阻止了CT成为靶向分子成像方式。同时更高能量的射线进行成像会增加患者辐射暴露的风险。
基于放射性同位素的成像
PET广泛用于医学成像,在癌症护理中有许多应用。今天,大多数PET检查都与CT相结合,以改善图像构建和解释。因此,这两种成像技术具有高度互补性。PET依赖于放射性同位素发射的正电子的湮灭,产生光子,然后检测和重建以提供3D图像。通过使用不同同位素的组合和不同PET示踪剂的配合,PET成像可用于检测更多的靶标。
磁共振成像
MRI可以提供丰富的解剖和生理信息。它基于组织中质子(或其他核)的核自旋松弛度。通常,自旋弛豫时间(T1和 T2) 用于生成经过加权的图像,以在组织之间产生不同类型的对比度。磁共振指纹识别技术,可以根据“指纹”响应将扫描中的每个体素分配给已知的引用库,并且以这种方式识别重建图像的每个体素,或用于提取传统的临床磁共振图像(T1和 T2)。用于MRI的外源性造影剂可以用改变局部磁性的物质进行设计,并且已被用于各种生物标志物成像应用。然而,与CT一样,MRI的有限灵敏度使得难以检测体内低丰度的生物标志物。
术中影像学检查
由于手术干预是肿瘤学的主要治疗模式之一,因此帮助外科医生可视化肿瘤边缘和残留物以改善术后前景至关重要。荧光成像基于细胞和组织的离体成像方法,已被用于手术和显微内窥镜检查。分子探针的使用可以增强荧光引导手术,以更好地定义肿瘤边缘并可视化难以看到的重要结构,或探测功能信息。如图5a、b的量子点前哨淋巴结映射技术、图5c、d的小分子近红外荧光团的荧光成像技术、以及图5e的基于显微镜与荧光探针相结合的技术以可视化肿瘤微环境的不同组分。
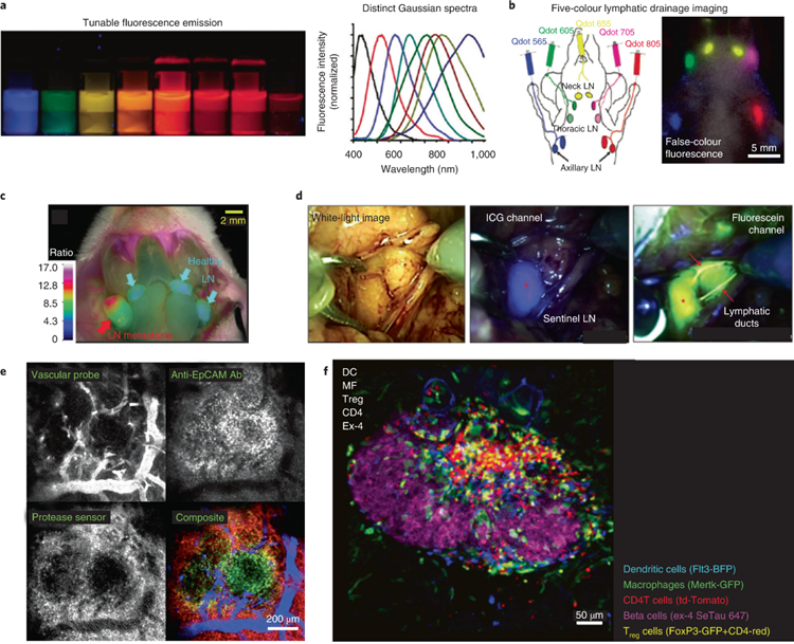
图5:术中多重荧光成像
新兴技术:
光声成像
光声成像使用超声波和光的组合在体内产生对比度。当分子被光脉冲激发时,不同数量的吸收能量被转化为热量。因此,脉冲激光器产生重复的热弹性膨胀并生成声波,基于此通过声波实现成像。通过使用一系列激发波长并遵循层析成像方法来照射和检测,多光谱光声层析成像(MSOT)就是利用光声效应提供组织中光吸收分子的3D图像。
通过使用相同的光声成像原理和广泛的可检测超声频率域,光栅扫描光声成像技术可以对真皮和真皮下微血管进行详细成像,从中可以根据血管直径得出病理生理参数(图6c)。由于微血管密度指示炎症,获得的定量信息可用于客观推断评估银屑病斑块和糖尿病的评分。
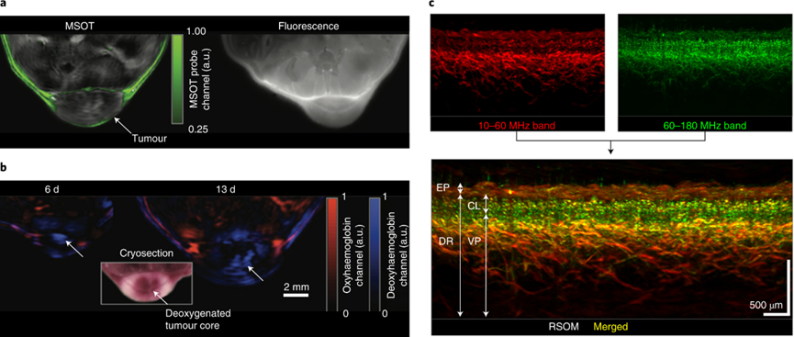
图6 光声成像技术的多信号区分
对比度增强拉曼成像
表面增强拉曼光谱(SERS)为超灵敏生物标志物检测和癌症成像带来了巨大的希望。虽然它需要纳米级造影剂,但它所基于的原理与许多其他纳米颗粒成像方法的原理有本质上的不同。在SERS中,在贵金属表面激发的表面等离子体会极大地放大附近分子的拉曼效应,而不会影响信号特异性。纳米颗粒可以合成具有明亮而独特的光谱(图7a),从而实现快速的SERS成像。SERS施用纳米颗粒造影剂的要求需要单独的监管批准。然而,与许多其他纳米颗粒剂不同,这些纳米颗粒可以使用惰性材料进行设计,并且用于治疗用途的几种金或金-二氧化硅纳米颗粒正在临床试验中进行测试。
基于SERS的纳米颗粒的一个主要优势是它们具有多重检测的潜力。与荧光发射光谱不同,其单峰和宽峰使它们难以解耦,拉曼光谱具有多个相当窄的峰,并作为不同的光谱“指纹”。从理论上讲,通过设计具有明亮而独特的SERS光谱的分子靶向纳米探针,应该有可能创建指纹,从而允许同时检测大量目标分子。
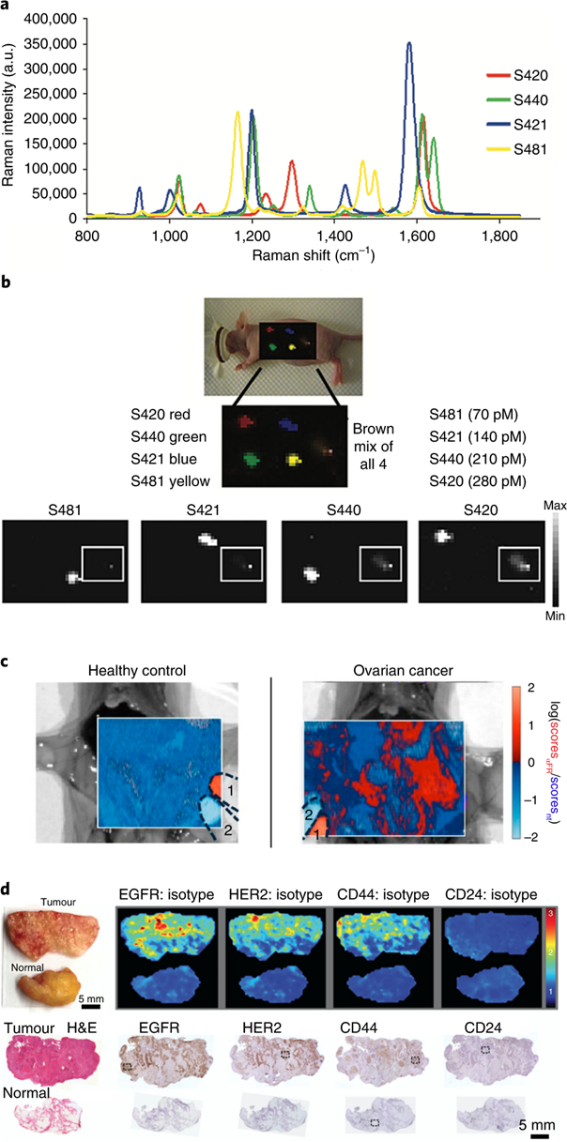
图7 使用SERS纳米颗粒进行拉曼成像
展望:
在一次扫描中同时对多个分子靶标进行成像可以提供更多有价值的临床信息,同时还可以减少与单独测量相关的时间和成本。临床前模型的工作表明,从理论上,信号通路的多重成像是可行的。然而,临床准入的过程存在诸多挑战。首先,多重成像技术可能需要施用多种造影剂,每种造影剂都需要自己的临床试验和批准。此外,连续成像方法可能会增加扫描时间,超出患者的预期承受能力并提高了医源性损伤的风险。此外,对多个数据通道的解释将需要复杂的数据处理。尽管这些数据意义重大,但从临床角度来看,这些数据处理的速率并不一定满足需求。
因此,为了实现多重成像的临床应用,让患者从中受益,应该不仅仅局限于减少检测次数。设计控制良好的前瞻性观察性临床试验,以测试多重成像诊断技术的有效性,将具有最重要的意义,并且应该与介入性临床试验相结合。多重成像技术对于临床的价值不言而喻,通过最少的成本获得最多的信息,实现临床影像检测效率质的飞跃。但是在这么多年的发展后,这个新兴的领域依旧稚嫩,其核心的检测手段仍有提升的空间,更多的检测方式也仍待开发,仍然需要更多的研究同僚们投入心血。
参考文献:
Chrysafis Andreou, Ralph Weissleder, Moritz F Kircher. Multiplexed imaging in oncology. Nat Biomed Eng. 2022 May;6(5):527-540.
https://www.nature.com/articles/s41551-022-00891-5











