酶是非常强大的催化剂,它使用复杂的活性位点来处理化学转化。酶可实现的巨大速率加速和无与伦比的选择性使它们成为可用于可持续制造过程的有吸引力的催化剂。生物催化领域已经发展到现在被视为发展更绿色、更高效化学工业的关键赋能技术的阶段。几项重大方法创新支撑了快速进展,包括:
1)提供快速、准确和低成本的DNA合成和测序服务;
2)开发先进的生物信息学工具和计算建模方法;
3)以及用于高通量结构和生化酶表征的日益复杂的实验工作流程。
这些进展导致了具有有趣催化功能的天然酶组合日益多样化,原则上合成化学家在设计目标分子的路线时可以利用这些组合。然而,天然酶很少适合在化学过程中直接使用,通常需要蛋白质工程来优化其特性以用于实际应用。近年来,出现了高通量蛋白质工程策略,最显著的是定向进化,用于开发生物催化剂,以高效和选择性地处理非天然底物,并在商业可行的工艺条件下有效运行。
尽管功能强大,但定向进化既昂贵又耗时,这限制了生物催化对许多工业过程的潜在影响。此外,对于许多理想的化学转化,没有已知的酶可以作为进化优化的起始模板。为了解决这些限制,已经开发了超高通量筛选方法和持续进化平台,这为加速蛋白质工程提供了令人兴奋的途径,而机械混杂酶的发现为实现天然未发现的催化功能提供了途径。然而,这些策略仅适用于少数化学转化,因此不能提供通用解决方案。
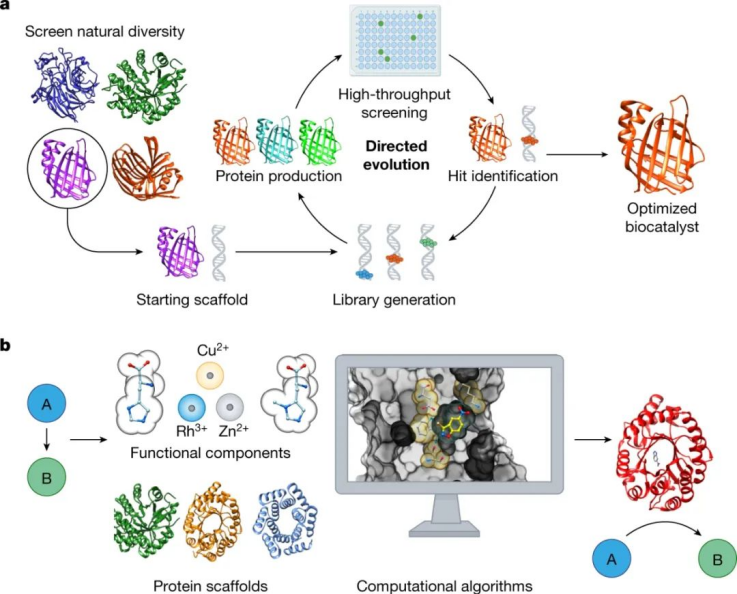
图|自上而下的酶工程与自下而上的设计
鉴于这些局限性,现在是时候考虑我们作为一个领域将如何实现阶跃变化,以允许快速、可靠和具有成本效益地开发用于广泛应用的生物催化剂。尽管天然酶的自上而下工程无疑仍然是生物催化剂开发的黄金标准,但这种方法只能带我们到此为止。在我们看来,自下而上或从头设计的酶设计,即在蛋白质宿主内创建全新的催化中心,可以为未来生物催化剂交付的速度和范围提供通用解决方案。
鉴于此,曼切斯特大学Anthony P. Green和苏黎世联邦理工学院Donald Hilvert院士、以及联合华盛顿大学David Baker等人在Nature上综述这一新兴领域的关键进展,包括人工金属酶、具有非标准有机催化基团的酶和从第一原理的从头设计酶。该分析可作为一个平台,讨论当前设计方法的局限性,以及如何进一步解决这些挑战。

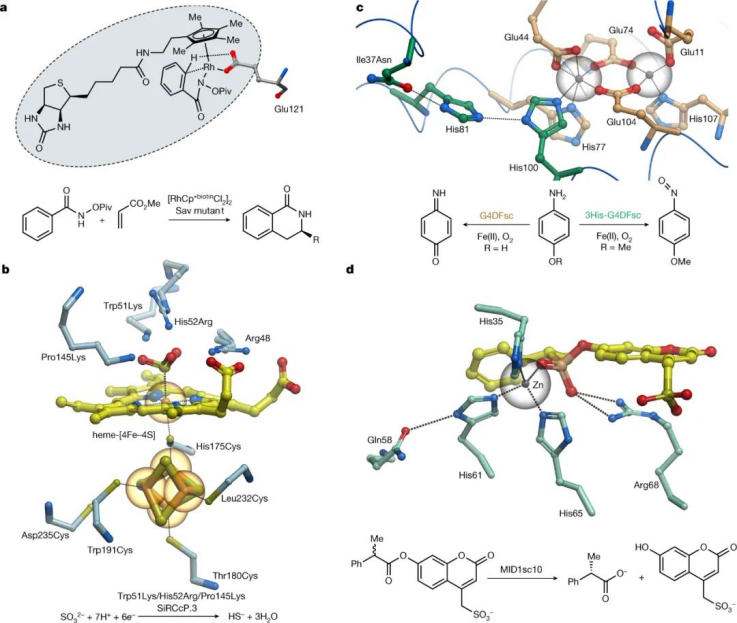
人工金属酶
通过招募金属离子辅因子,促进氧化还原化学、自由基过程和挑战性的官能团转化,极大地扩展了天然酶的功能能力。这些金属酶受益于金属辅因子和蛋白质支架的协同作用,以加速一些最具挑战性的自然发生的转化。这些系统令人羡慕的催化性能激发了设计人工金属酶的互补方法的发展。一种已被证明特别通用的策略涉及将预组装的过渡金属复合物锚定到选定的蛋白质支架中。这种方法已经产生了用于各种非生物转化的活性催化剂,包括烯烃复分解和转移氢化。然而,总体而言,设计蛋白质、底物和过渡金属络合物之间的有效相互作用已被证明具有挑战性,因此这些混合系统实现的催化效率通常低于孤立的小分子络合物。
另一种已证明特别有效的金属酶设计方法包括重新设计天然金属蛋白以安装与天然辅因子协同工作的新功能元件。与天然酶相比,这些从头金属酶的异核中心被构建在一个小而坚固的蛋白质支架中,可以很容易地生产、设计和结晶,以进行高分辨率的结构表征。这种系统为阐明天然金属酶实现的高效率和选择性的关键结构和机制特征提供了理想的基础。这种方法的威力最近通过设计一种催化亚硫酸盐还原的人工酶得到了证明,这种转化迄今为止一直未能通过合成催化剂实现。
“从头开始”创造金属酶,设计新的蛋白质支架来结合金属辅因子和调节催化,为完全控制金属蛋白序列、结构和功能提供了前景。该领域的大多数研究集中于将金属离子和金属卟啉辅因子的结合位点引入设计的α-螺旋束,从而产生用于水解反应、氧化还原过程和卡宾转移的蛋白质催化剂。金属结合位点也被设计在多肽或蛋白质亚单位的界面上,以指导高阶结构的组装。
图|从头开始人工金属酶
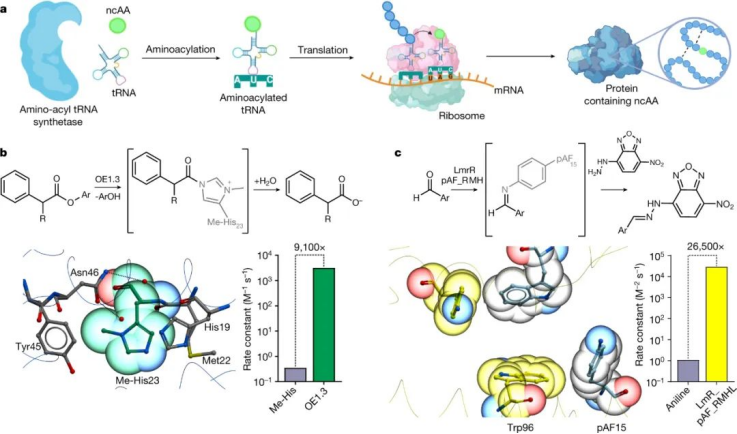
加入非标准氨基酸
酶设计策略通常依赖于20种典型氨基酸,其中包含一组狭窄的官能团。这种有限的功能限制了可以安装到从头活性位点中的催化机制。然而,现在可以使用遗传密码扩展方法访问更广泛的功能组件,该方法允许将结构多样的非标准氨基酸 (ncAA) 选择性地掺入蛋白质中。这些方法通常采用正交氨酰-tRNA合成酶-tRNA对来指导ncAA的掺入,以响应引入感兴趣基因的未分配密码子(最常见的是UAG)。基因编码的 ncAA 为探索酶如何在分子水平上发挥作用提供了新的途径,并已被用于提高生物催化剂的活性和稳定性。氨基酸构建模块的扩展也为设计具有非天然产生的新催化机制的酶提供了令人兴奋的机会。
目前已有的研究表明,将“有机催化”模块引入可进化的蛋白质支架可以提供一种通用策略,以提供比单独使用的小型有机催化剂效率高几个数量级的酶。
图|具有扩展的氨基酸字母表的酶
稳定关键过渡状态
如果我们要利用我们将新功能成分安装到蛋白质中的能力,我们必须学会如何在过渡态稳定的基本原则基础上可靠地设计酶,这是催化的基础。最近,计算机辅助酶设计已成为一种强大且更灵活的方法,它不依赖于不完美的过渡态类似物的可用性,并且不限于抗体折叠。
设计过程涉及以下一般步骤:
(1) 设计和生成“theozyme”——一种理想化的活性位点模型,包括量子力学计算的过渡态和过渡态稳定所需的氨基酸侧链的关键官能团。
(2) 将 theozyme 与结构特征的蛋白质对接,以识别空间互补支架,该支架可以容纳关键催化基团作为与蛋白质骨架连接的氨基酸侧链。
(3) 重新设计活性位点内和周围的残基以优化 theozyme 的包装。
到目前为止,这个过程已经使蛋白质催化剂的设计能够用于少数模型转换。在有利的情况下,计算机辅助的设计和定向进化的这种结合提供了具有与天然酶相当的效率的生物催化剂。然后,可以使用对提高活性的分子变化的全面了解来为改进设计方案的开发提供信息。
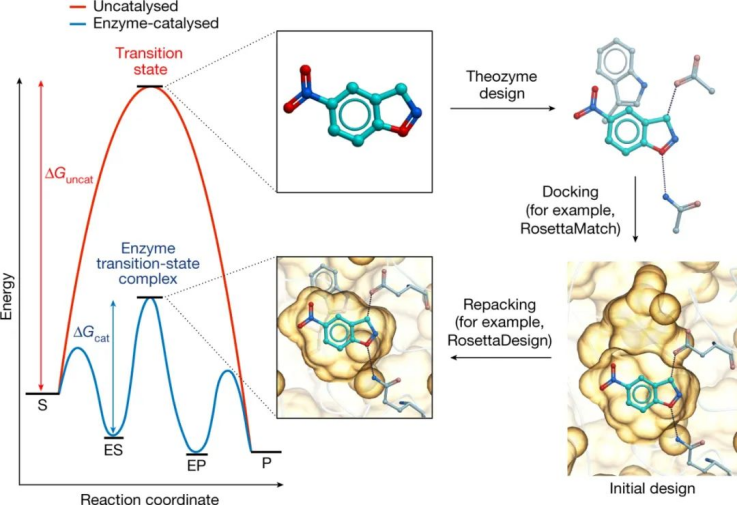
图|酶的计算设计
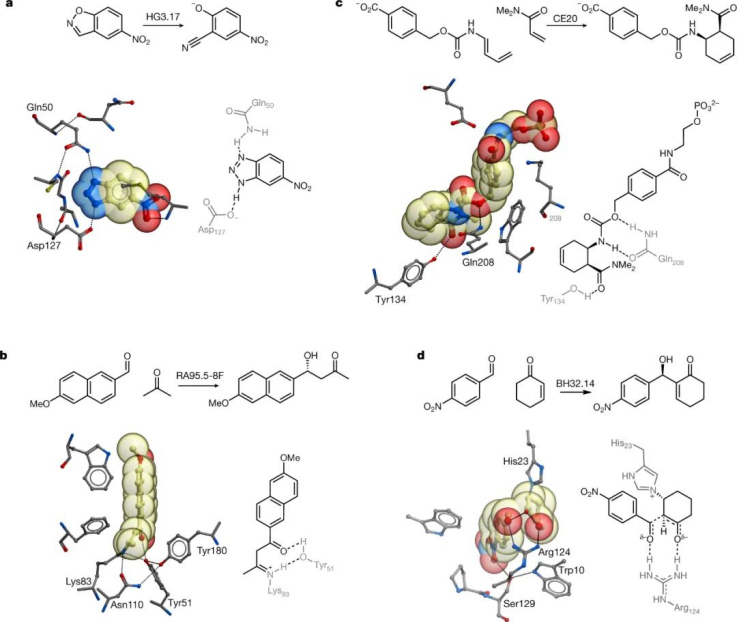
图|通过计算辅助设计和定向进化从头酶
设计酶的未来之路
这篇综述中的例子说明了过去十年酶设计和工程领域取得的巨大进展,并提供了一个令人兴奋的机会。如果设计要达到或甚至超过更成熟的自上而下的生物催化剂开发方法所达到的实际效用水平,那么这个研究领域现在必须解决两个核心挑战:
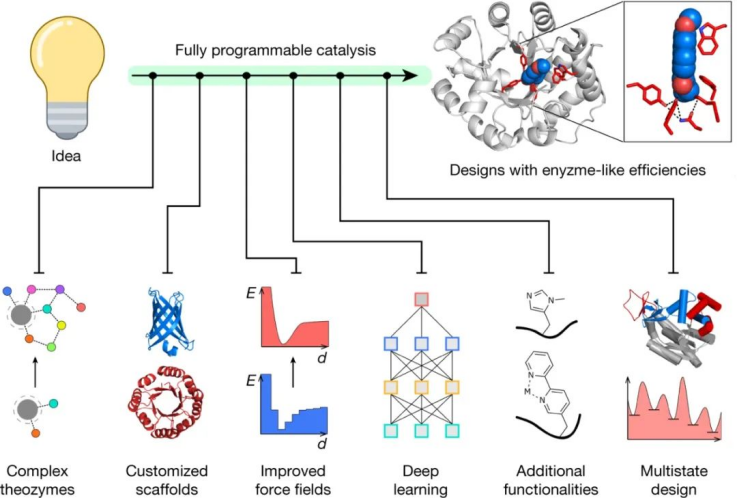
图|更好地设计酶的路线图
1)首先,我们必须学习如何设计效率更接近自然系统的高活性酶。目前,即使对于相对简单的转化,也必须产生许多设计并进行实验测试,以识别出一些表现出所需活性的设计,并且需要进行广泛的进化优化以弥合与天然酶的效率差距。当针对多步反应时,设计挑战被放大,其中需要精心策划的构象调整以精确识别多种化学状态。在活性位点预组织和构象动力学之间取得平衡对于酶设计的未来成功至关重要。
允许直接从一级序列准确预测蛋白质结构的深度学习算法的出现为设计这种定制支架提供了令人兴奋的新机会。除了预测蛋白质结构之外,机器学习已被用于在蛋白质功能的定向进化过程中更智能地导航序列空间,并从头开始生产满足与结合界面相关的一组约束的蛋白质。展望未来,预计将深度学习和基本生物物理理解的有益方面相结合的混合设计策略将证明是一条富有成效的探索途径。无论采用何种特定设计方法,在可预见的未来,定向进化都可能继续在改进从头酶的催化位点方面发挥核心作用。
2)其次,我们必须扩大从头酶可实现的化学范围,并为可大规模实施的有价值的化学过程开发催化剂。在这里,有机化学家和蛋白质设计者之间更广泛的合作对于确定合适的活性位点安排以进行新的目标转化特别有价值。通过工程化细胞翻译以将新的功能氨基酸引入蛋白质中,可以大大扩展可及化学物质的范围,这些氨基酸可用于调节金属离子辅因子的催化作用或用作小分子有机催化剂的基因编码替代物。未来,酶设计师和工程师将通过开发用于日益复杂的转化的催化剂,继续推动该领域的发展。
总之,尽管仍有相当大的挑战需要克服,但我们谨慎乐观地认为,完全可编程的催化将在未来成为现实,在这种催化中,可以从头开始预测新的蛋白质序列,以提供具有所需功能的高效生物催化剂。作者认为,只有通过利用计算化学和生物学、有机化学、酶学、结构生物学、蛋白质设计、定向进化等领域的专业知识,才能实现这一雄心勃勃的目标。
参考文献:
Lovelock, S.L., Crawshaw, R., Basler, S. et al. The road to fully programmable protein catalysis. Nature 606, 49–58 (2022).
https://doi.org/10.1038/s41586-022-04456-z











