多重成像技术可以说是近些年来医学生物技术开发的重点领域之一,更少的样本、更少的成像次数以获得更多有价值的临床信息,以此实现更加高效的更加精准的成像模式。虚拟组织学、质谱成像、核磁共振、表面增强拉曼光谱等等,可以说多重成像领域中有着诸多成员,同时也有更多的生物技术即将加入。循环免疫荧光的多重染色技术通过依次标记再淬灭不同的荧光信号,实现了对单一样本的大量靶标同时成像,而这种看似原理简单的技术却面临着诸多挑战
在活细胞或者生物体内对于时间过程相关的分子研究,我们通常引入与启动子、蛋白质或相关生物分子相偶联的荧光探针,借此使用荧光显微镜以观察到特定的生理事件。这一策略尤其在细胞生物学上非常的成功。然而,这种方法并非没有缺点,例如(1)创建和验证细胞系需要大量的时间;(2)同时可视化的靶标数量有限;(3)使用荧光蛋白标记来分析原代细胞完整集合的可操作性。虽然优化的单克隆抗体使免疫荧光技术成为在体外和体内研究未经遗传修饰细胞的一种可行方法,但是仅限于少数(即1-4个)同时靶点。总的来说,这些劣势极大地限制了活体系统的成像效果。
针对当前难以多靶标成像的困境,美国麻省总医院和哈佛医学院系统生物系的Ralph Weissleder与Jonathan C T Carlson教授联手开发了一种剪切加速的荧光团交换(SAFE)方法。此技术通过快速生物正交化学从标记细胞表面去除先前的免疫荧光信号探针,借以实现相同样品的循环荧光染色,实现了利用免疫荧光对活细胞或组织的多重成像。作者团队在活体小鼠外周血单个核细胞(PBMC)、肝组织和骨髓标本中展现了此技术的多色染色与多重成像能力,证明了其无毒性与强大功能。

总体思路:
我们设想,新的生物正交化学技术可以实现活细胞中细胞外标记物纵向复合分析所需的特性。在这里,我们描述了剪切加速的荧光团交换(SAFE)方法的开发和应用,该方法利用生物正交机制,在淬灭后完全去除由抗体标记细胞产生的荧光信号。SAFE利用一种可剪切的C2对称反式环辛烯(C2TCO)构建的支架,利用非共价猝灭剂-荧光团相互作用加速已经很快的四嗪(Tz)-TCO点击反应,在几秒钟内达到99%以上的断裂。关键的是,这使得生物正交循环在无毒的纳摩尔浓度下可行,这在以前的方法中是不可能的,同时实现了序列分析所需的相对背景噪音较高的信号值。我们首先量化荧光分析中的加速化学动力学,并通过时间分辨成像验证生物背景下的剪切性能。然后,我们继续验证活体小鼠外周血单个核细胞(PBMC)14色成像的准确性和生物毒性,在活体小鼠肝组织中进行多重成像实验,并在活体小鼠骨髓多色染色中显示髓样细胞亚群。最后,我们证明了超过六天连续生物正交循环跟踪永生化造血祖细胞向中性粒细胞分化的能力。
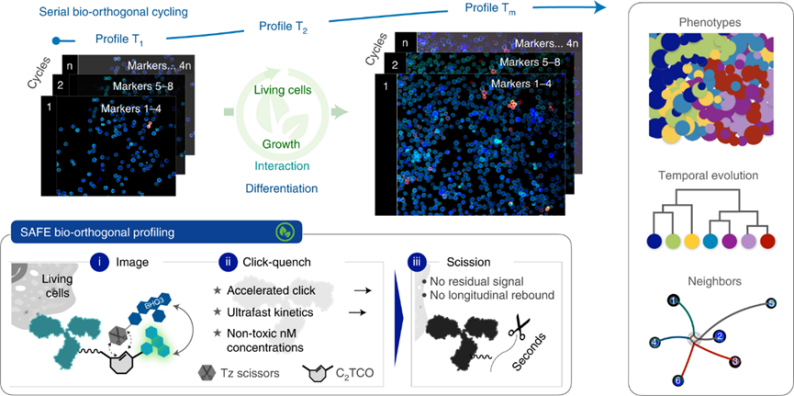
图 活细胞的多重时空分析
生物正交协同加速剪切:
提到生物正交技术的生物学应用就不得不面对两个挑战:(1)目前生物正交技术的常用浓度范围对于很多有机化合物而言是具有细胞毒性的;(2)强反应性的化合物通常是亚稳定或易快速降解的,这限制了它们在生物环境中的应用。为了避免这些问题,SAFE的设计利用了荧光猝灭剂BHQ3和Alexa荧光染料之间的协同作用,以在低无毒试剂浓度下快速开启/关闭标记抗体的荧光信号。
在合成BHQ3-N-Tz(2)后,与AF647–C2TCO(SAFE647)标记抗体反应后,监测荧光强度与时间的关系。断开C2TCO连接的双相荧光时间过程,其非线性拟合得出的速率常数为0.143±0.005 s−1(t1/2 = 5s)。对于切断连接键或淬灭荧光本身,其速率比Tz(3)与C2TCO的反应快2900倍以上。为了在生物背景下验证动力学,细胞表面的前荧光信号猝灭/裂解都很快(半衰期约1.9s),在40s后信号强度降低99.7%。
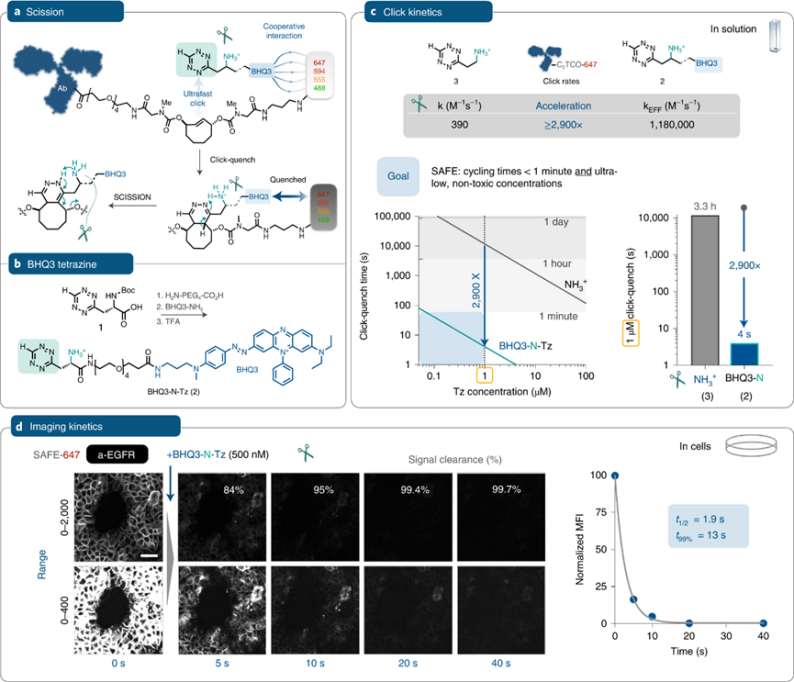
图 合成、机理与动力学
SAFE使得活细胞循环染色成为可能:
我们在用Hoechst和SAFE647结合抗N-钙粘蛋白抗体染色的活A549细胞上进行了初步的短期循环实验。BHQ3-N-Tz迅速消除了N-钙粘蛋白信号。为了进行更长期的评估,我们将A549循环荧光实验扩展为连续成像,以测试剪切性能和细胞毒性。细胞用SAFE647结合的抗EGFR抗体染色,用BHQ3-N-Tz荧光淬灭/剪切,然后在37℃下返回常规培养条件 ,每个阶段采集相同细胞区域的图像。预蓝色的细胞活力读数证实,SAFE结合抗体和BHQ3-N-Tz剪刀在整个工作时间和浓度范围内均无毒。
与淬灭的荧光团完全剪除一致,细胞在第2天保持非荧光,未观察到信号反弹。而传统的TCO-Tz而言,它虽然进行生物正交淬灭荧光信号,但不能从抗体中切割荧光团。对照实验表面在没有剪刀的情况下,可以观察到荧光信号的自发反弹。虽然这两种生物正交方法都能在活细胞中实现有效的短期循环,但在抗体内化预期较高且荧光反弹存在的较长循环时间段内,剪切对于多荧光信号序列分析至关重要。
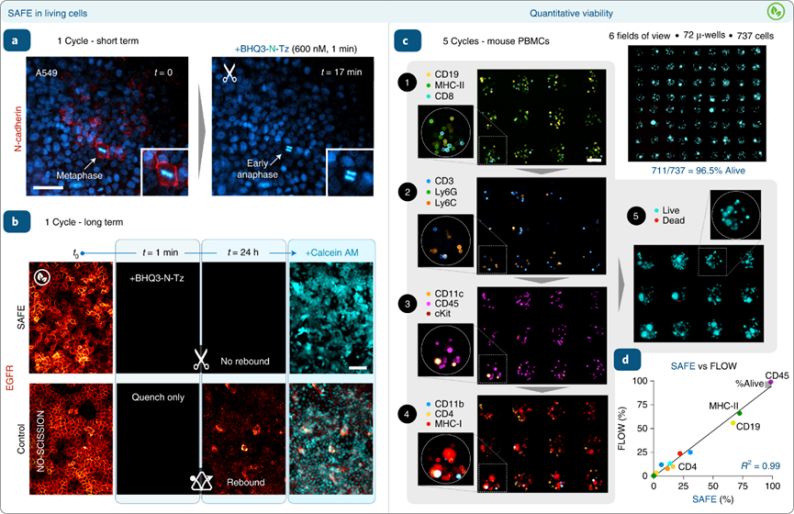
图 活细胞体系中快速、持久和无毒多重染色
SAFE使得活体组织循环染色成为可能:
虽然分散细胞的原位分析可以揭示复杂细胞群中的细胞相互作用,但活组织的多重成像将允许在完整的生物结构中可视化细胞动力学。为了探索SAFE在这种情况下的性能,我们从Mer酪氨酸激酶(MerTK)-GFP小鼠中制备了新鲜收获的肝脏切片。我们在三个周期内用SAFE修饰的抗体(抗CD8,CD4,CD11b,Ter119,CD45和MHC-I)染色新鲜的MerTK-GFP肝脏切片。成像结束时的亮钙黄绿素AM染色证实了循环后完整的组织活力,并添加了Hoechst作为核参考标记物。这些结果证明了SAFE在组织切片的循环成像中有着优异的表征细胞免疫表型能力。
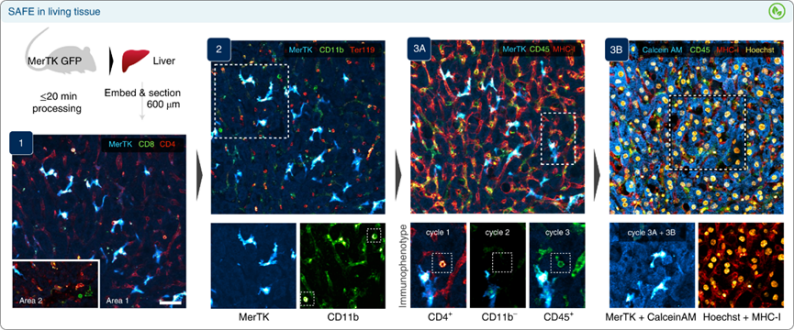
图 肝组织切片的SAFE成像
高空间分辨率下活体骨髓分化分析:
当多能干/祖细胞分化为成熟后代时,造血发育产生表型的多样性。高维度多重分析和单细胞基因表达/条形码技术追踪了造血谱系的发育层次。然而,在这些变化中直接观察骨髓细胞及其表面标记物的集合是不可能的。作为对SAFE分析活骨髓可行性的初步测试,我们对新鲜采集的小鼠骨髓细分析了12个免疫标记物(每个周期三个标记物,总共四个周期)。
CD8+细胞很少见,这表明非粘附性T细胞在这种染色形式中没有很好的保留。图像显示细胞群中存在红系(Ter119+)、淋巴系(CD19+)和髓系(CD11b+)亚群,也包括了跨功能分化谱的细胞。在高分辨率合成图像中,CD11b、Ly6C和Ly6G连续表达特征很明显(图5b),髓样前体(CD11b+和Ly6C+)呈蓝色/青色,成熟的Ly6G+中性粒细胞呈洋红色/红色。除了这些亚群之外,在四个完整的周期后,还可以观察到微不足道的细胞质信号,这表明在这种细胞背景下,精确、反复染色和剪切、淬灭前荧光信号是可行的。
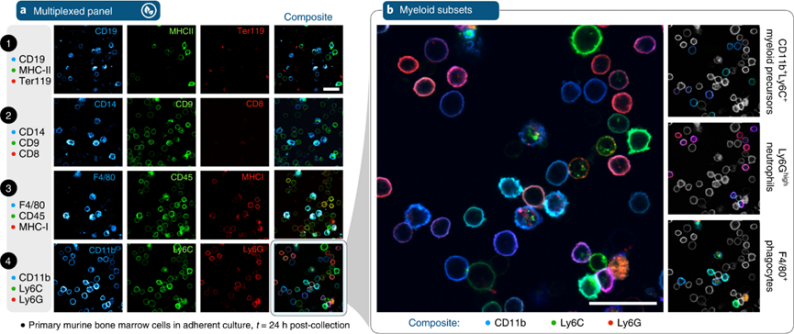
图 骨髓细胞群的SAFE成像
SAFE的长周期循环染色:
为了在更长的时间尺度上实施纵向生物正交分析,即不仅是跨越多个周期,而且实现跨越多天,我们选择了一个具有明确细胞动力学的模型系统。β-雌二醇-ER-Hoxb8分化模型,在去除β-雌二醇后细胞在第4-6天成为成熟的中性粒细胞,这一发育序列已通过流式细胞术和基因表达得到了很好的表征。
在第0天,如预期的那样所有的荧光细胞均为CD45阳性cKit阳性,其余细胞组为阴性细胞。到第2天,随着CD11b和Ly6C+细胞亚群的广泛上调,细胞数目迅速增长。活细胞密度在第4天达到峰值,同时出现明亮的Ly6G染色。由于分化的粒细胞寿命较短45,到第6天,种群密度略有下降,这与流式细胞术通常观察到的死亡细胞比例一致。在中性粒细胞选择性培养条件下,F4/80染色始终呈阴性,这与分化预期一致。
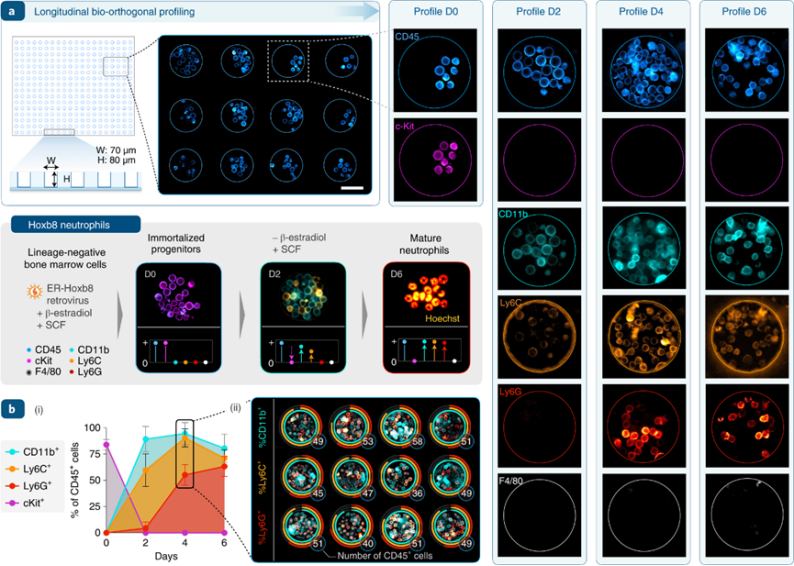
图 嗜中性粒细胞分化的纵向分析
小结:
SAFE的生物正交设计为活生物样品的多重纵向分析创造了一种新方法,应用于展示小鼠肝组织的9色成像和骨髓细胞群体的14色成像,时间尺度跨越几分钟到几天。SAFE方法绕过了信号反弹的缺点,并允许高效而持久的进行多重荧光循环标记,同时实现纳摩尔浓度级别的温和不可逆荧光团剪切反应。通过BHQ3-荧光团相互的协同作用加速剪断序列,SAFE试剂实现了内在生化的稳定性和高反应性。据我们所知,SAFE是目前唯一允许在活细胞和组织中进行这种时间空间分析的技术。
虽然已经探索了细胞内抗体传递的非致死性方法,但此类工具尚不能与常规免疫染色或多维度分析兼容;目前,这些局限性将SAFE多重分析限制在了仅仅对于活细胞和组织的细胞外标记。同样,目前的SAFE化学迭代依赖于清除分裂的染料,这是一个简单的细胞表面的靶点过程,但对于细胞质中的亲水性、膜不透性荧光团作用效果不够直接。
SAFE方法的一个关键优点是,其生物正交剪切反应可以与任何共轭染料兼容,包括聚合物荧光染料(例如BV染料系列)。由于一系列明亮的聚合物染料可以在紫外光下激发,因此它们与有机罗丹明/菁染料一起使用进一步拓宽多重荧光循环的靶标数,每个循环周期可标记约8个靶标,且光谱重叠最小。最后,虽然我们在这里的重点是在定义明确的模型系统中演示时间空间分析,但上述方法为移植后立即甚至在体内对广泛的活细胞和组织进行多重功能分析和纵向观察打开了大门。
参考文献:
Jina Ko, Martin Wilkovitsch, Juhyun Oh, et al. Spatiotemporal multiplexed immunofluorescence imaging of living cells and tissues with bioorthogonal cycling of fluorescent probes. Nat Biotechnol. 2022 Jun 2.
https://www.nature.com/articles/s41587-022-01339-6











