2016年7月,来自日本的大隅良典因为其对自噬机制的探究而被授予诺贝尔生理学奖,这是继Christian De Duve发现自噬现象后第二个在自噬领域实现开拓性进展的学者。自噬是指将一部分细胞质封存以形成双膜自噬体,随后将这些自噬体运输到溶酶体,其中其内容物被降解。自噬水平降低与神经退行性疾病、心血管疾病和癌症有关。然而,自噬也是诱导细胞死亡的主要机制之一。
自噬的保护作用和有害作用总是处于一种微妙的平衡之中。目前常用的LC3荧光检测可用于测量细胞中和暴露组织表面的自噬通量。然而,这种方法需要对细胞或动物进行基因转染,并且不支持体内自噬的检测,特别是在心脏等深层组织中。因此,迫切需要一种新技术实现对自噬过程的体内成像和测量。
近日,在Howard H Chen的领导下,哈佛医学院A.A. Martinos生物医学成像中心和塔夫茨大学分子心脏病学研究所的研究员们开发了一种自噬检测纳米颗粒(ADN),能够对自噬进行成像并在体内非侵入性地测量其通量。这些纳米颗粒修饰有组织蛋白酶可切割的富含精氨酸的肽,这些肽具有近红外荧光色素Cy5.5的功能,同时可以促进早期自噬体对纳米颗粒的摄取。自噬体的通量可以通过静脉注射的氧化铁纳米颗粒的磁共振或近红外荧光成像来测量。

设计理念:
ADN的核心由超顺磁性氧化铁纳米颗粒(FH)构成,其表面修饰有富含精氨酸的肽,这增强了自噬体对探针的摄取。平均每个NP可以提供五个肽链尾端,以供近红外荧光色素(Cy5.5)结合,提供可激活的荧光标记。自噬期间的溶酶体中组织蛋白酶活性上调,进而裂解ADN表面的裂解富含精氨酸的肽,将近红外荧光色素释放。吸收分光光度法显示,ADN上的Cy5.5荧光色素在625 nm处有一个显著的峰值,而用胰蛋白酶激活探针后,吸收峰恢复为675nm。675/625nm峰与荧光信号强度的比率的强度变化时间分布也是相似的。组织蛋白酶/蛋白酶对肽的切割导致Cy5.5从FH-肽结构中分离并产生强大的荧光。
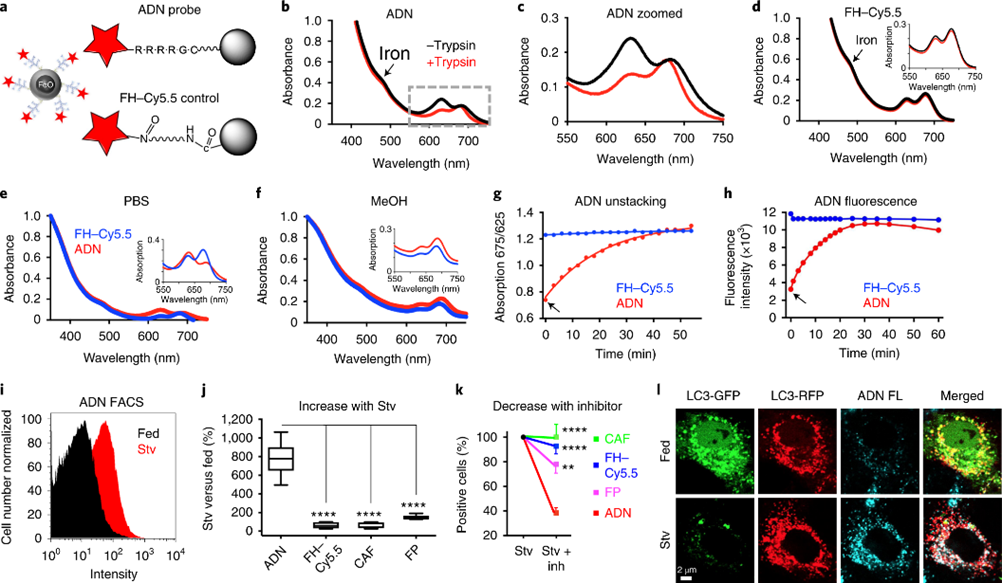
图 ADN的表征及其体外验证
NPs对自噬的特异性:
为了进一步证明ADN对自噬的特异性,设计合成了探针的D-异构体(FH-D-ISO),使得肽链无法切割。与ADN不同,FH-D-ISO暴露于蛋白酶/胰蛋白酶不会改变其吸光度光谱或导致荧光发射。在H9C2细胞中,也只有ADN探针可以正确表达信号。
对于自噬蛋白ATG5和ATG7遗传缺陷,ADN并未表现出应有的信号变化。在siRNA敲低ATG7的H9C2细胞中也观察到ADN激活障碍。为了更好地表征溶酶体活化前ADN的动力学,使用抗体(DX-1)联合葡聚糖在NP表面形成涂层。在暴露后15分钟内,在饥饿的H9C2细胞的细胞质中观察到大量的ADN,即使在预冷至4°C以消除内吞也是如此。1小时后,ADN浓缩到早期自噬体中,并与细胞质中>80%的LC3-GFP点状物共定位。总的来说,ADN可以通过直接易位进入细胞,并被早期自噬体内化,输送到溶酶体并被溶酶体组织蛋白酶原位激活。
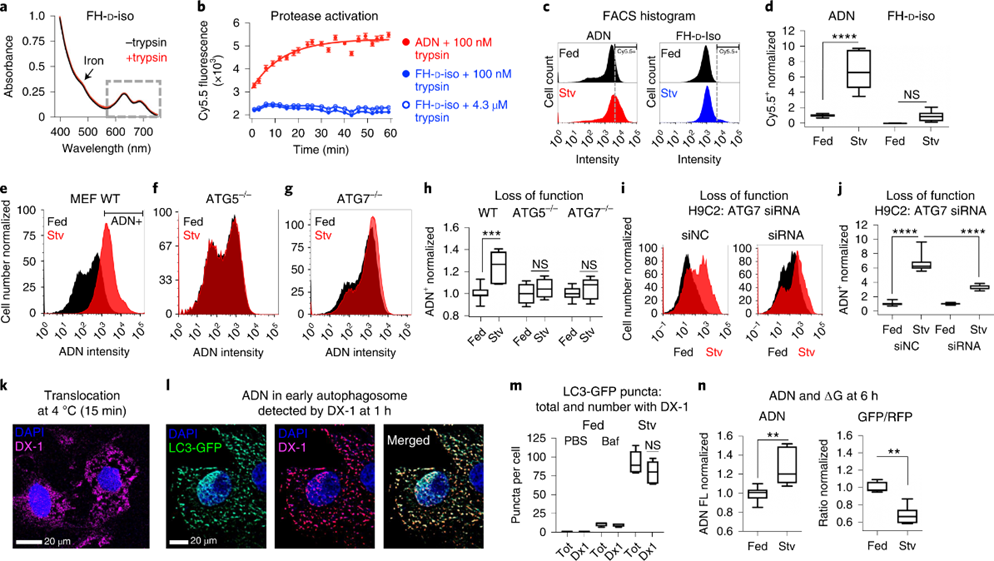
图 ADN激活的特异性及其在早期自噬体中的摄取
NPs在自噬小鼠模型中的验证:
使用三种模型系统测试了ADN在离体鼠心肌细胞自噬成像的能力。对于IR损伤模型,在再灌注4小时后,在缺血区观察到仅观察到ADN荧光。在24小时饥饿模型中,在整个心肌中观察到ADN激活,饥饿小鼠的荧光强度比对照小鼠高1.4±0.1倍。而具有对照探针的饥饿小鼠中未观察到荧光增加。饥饿期间的ADN荧光在心脏,小肠和脾脏中增加最多,这表明在饥饿期间这些组织中自噬特别上调。
作者团队先前报道了一种心肌细胞特异性过度表达转录因子DNA损伤诱导转录物4样(DDiT4L)和自噬的转基因小鼠的开发。在DDiT4L转基因小鼠中,心脏的三维多平面表示出强大的ADN荧光,但在对照小鼠中没有。这一结果,结合在IR、饥饿和H9C2细胞中获得的结果,表明ADN是一种敏感和特异的自噬通量标记物。
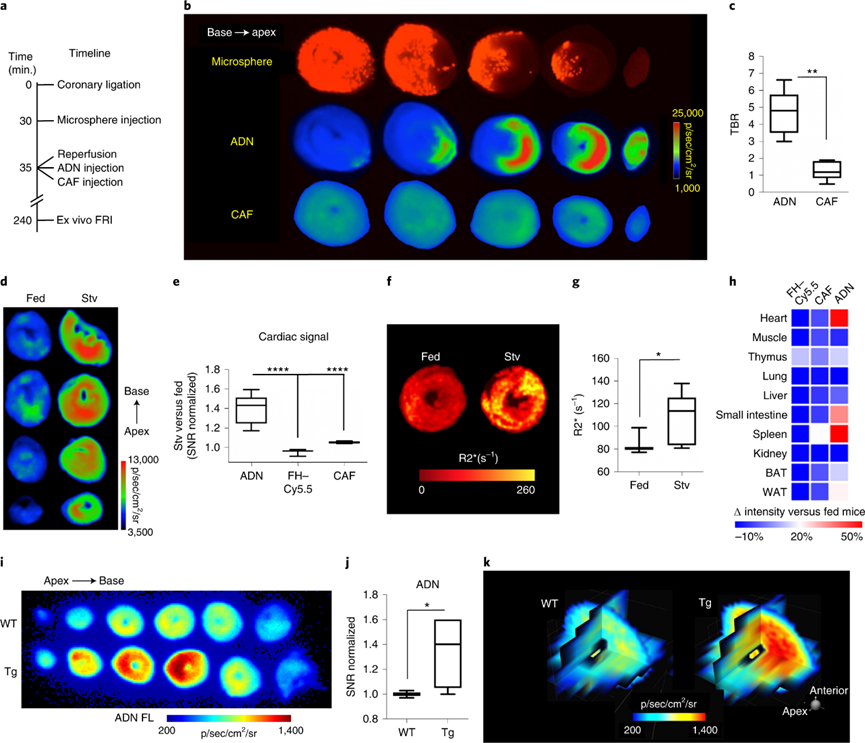
图 使用ADN进行心肌细胞自噬体外成像
NPs检测Dox对心肌细胞自噬通量影响:
对于DOX的心脏毒性与自噬的关系,目前学界仍有争议。使用ADN进一步探究这个问题,将H9C2细胞暴露于Dox下24小时,并通过蛋白质印迹和荧光活化细胞分选(FACS)测量自噬通量。与载体对照相比,Dox暴露使自噬蛋白LC3 I降低,对LC3 II无影响,p62水平显着升高。将H9C2细胞暴露于Dox可显著减少ADN阳性细胞数量,并显著增加膜联蛋白V阳性细胞群。这些数据与Dox导致自噬通量延迟阻滞和凋亡细胞死亡增加的结果一致。
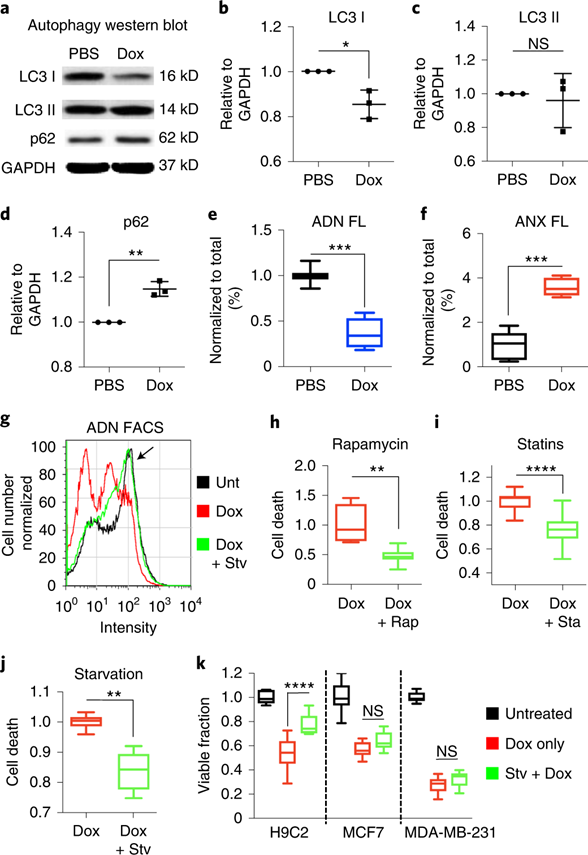
图 NPs检测Dox以及预饥饿对心肌细胞自噬通量影响
Dox给药的小鼠自噬成像:
在两种给药条件下在小鼠中测试Dox对体内心肌细胞自噬的影响。在用单剂量Dox小鼠中,Dox显着增加了ANX荧光并降低了ADN荧光。在给予Dox之前,饥饿24小时以激活自噬,进而将ADN信号恢复到基础水平,与注射PBS的对照小鼠相当。饥饿前自噬的激活与心肌细胞凋亡的减少有关。饥饿的正性结果不是由于心肌中Dox的摄取或保留减少,因为Dox荧光在两组中无显著差异。而Dox荧光的程度与来自ADN的信号成反比。
慢性低剂量方案持续 5 周在每次Dox注射前预先饥饿的小鼠中,在最后一次Dox给药后8周的超声心动图显示心输出量,每搏体积和应变率显着改善。此外,在随访的8周内,在预饥饿的小鼠中观察到死亡率显着降低。
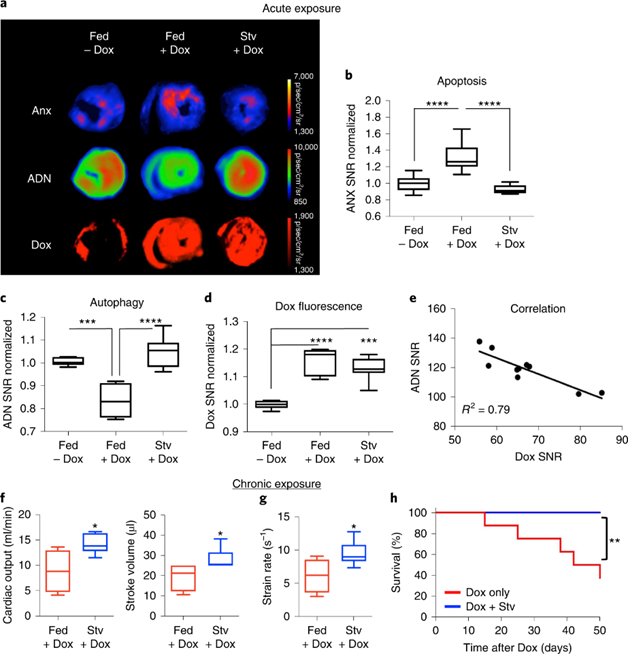
图 小鼠Dox前预饥饿处理的影响
小鼠体内心肌细胞自噬成像和通量检测:
接下来使用ADN对饥饿模型体内心脏中的自噬进行成像。在4-6小时进行与X射线计算机断层扫描(CT)共同记录的三维荧光成像,并确认饥饿小鼠中胸部信号升高来自心脏。通过进一步的动力学建模表明,饥饿将自噬通量增加到每小时每细胞40个自噬小体以上,并导致每个心肌细胞中累积超过130个自噬小体。
接下来,在更长时间(48小时)内测量体内自噬的动态变化。通过饥饿和再喂养来调节心脏自噬的效果快速而强大。相比之下,饥饿的小鼠给予雷帕霉素几乎没有任何影响。使用磁共振成像(MRI)检测信号,饥饿小鼠心肌中的R2显着升高。心脏切片的蛋白质印迹和共聚焦显微镜检查显示,在饥饿的小鼠中,表明自噬的LC3II / I的比例增加。总的来说,体内数据表明,ADN可以通过磁共振或荧光检测到,自噬通量检测是一个快速有效的过程,饥饿对自噬的刺激可以部分减轻心脏毒性药物的毒性。
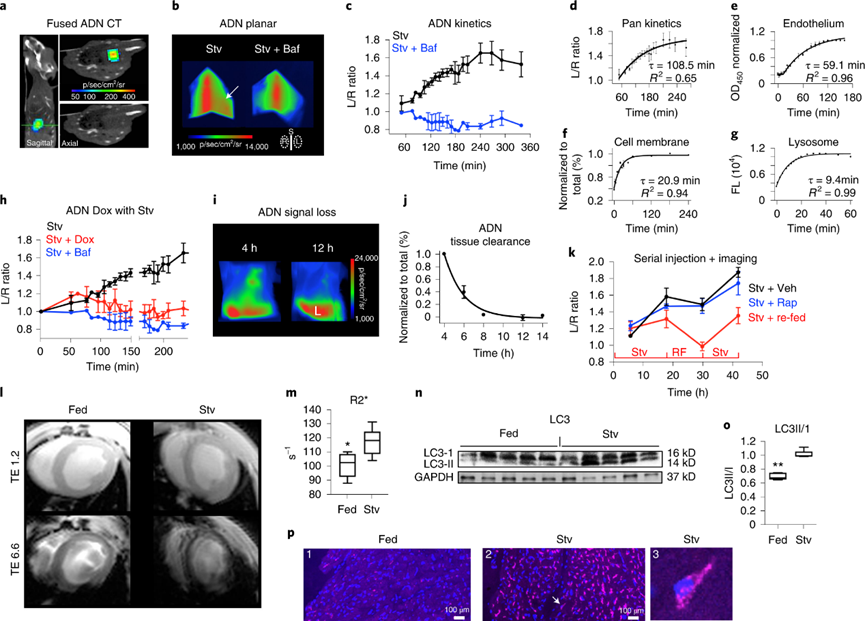
图 使用ADN进行自噬体内成像。
小结:
ADN可以通过直接易位穿过细胞膜进入细胞质,或通过内吞作用和随后的内体转移。这两个过程都是通过用细胞穿透肽(如聚精氨酸)修饰NPs来促进的。一旦进入细胞质,ADN被LC3-GFP阳性早期自噬体迅速吸收。因此,ADN上的聚精氨酸肽具有多种功能,包括细胞穿透,内体转移,刺激自噬体摄取和溶酶体组织蛋白酶的切割,从而激活荧光。
测量自噬体通量的重要性正日益得到认识。自噬体或溶酶体对ADN的摄取导致NPs的局灶性聚集,其磁弛度显着增加,便于MRI检测。ADN的荧光信号提供了更准确的通量检测,因为只有那些被输送到溶酶体的含有ADN的自噬体才会经历组织蛋白酶介导的表面肽的裂解并发出荧光。体内成像证明,心肌细胞每小时能够携带>40个自噬体,并在20分钟内消化潜在有害的细胞质内容物。这可能可以有效地中和大多数促凋亡刺激,同时避免细胞过度消耗能量。
迄今为止,自噬在体内尚无办法可以实现测量。作者团队开发了一种设计合理的ADN,可以通过荧光或磁共振成像进行检测。他们用ADN表明,心肌细胞能够将自噬体迅速输送到溶酶体,但这一过程被几种常见的心脏毒性药物所抑制。而在化疗期间诱导短暂自噬爆发也可以具有高度的心脏保护作用。ADN提供自噬通量的准确检测,有助于更好地了解自噬在各种疾病状态中的作用。
参考文献:
Howard H Chen, Zehedina Khatun, Lan Wei, et al. A nanoparticle probe for the imaging of autophagic flux in live mice via magnetic resonance and near-infrared fluorescence. Nat Biomed Eng. 2022 Jul 11.
https://www.nature.com/articles/s41551-022-00904-3











