研究背景:
自2019年新冠病毒疫情爆发以来,全球已有至少36款疫苗被批准。然而,这些疫苗大多通过肌肉注射途径来激活全身性免疫反应,无法特异性引起肺粘膜免疫。特别是对于目前推出上市的mRNA疫苗,还需要低温储存或运输条件来保障其有效性,这大大提高了疫苗成本。因此,开发能够激活肺粘膜免疫反应且不需低温储存的新冠疫苗至关重要。
基于此,北卡罗来纳州立大学的的程柯和李振华等人报道了一种可吸入的重组SARS-CoV-2受体结合域(RBD)修饰的外泌体疫苗RBD-Exo,用于激活高效的肺粘膜免疫。该研究表明,RBD-Exo吸入疫苗被证明可在室温稳定储存3个月以上。在小鼠及仓鼠感染模型中,两剂吸入疫苗可引起肺部粘膜特异性IgG和IgA抗体反应,并激活肺部CD4+和CD8+细胞的增殖及Th1型细胞因子的分泌,最终成功抑制病毒感染进展。因此,该吸入疫苗具有较好的预防新冠病毒的应用潜力。
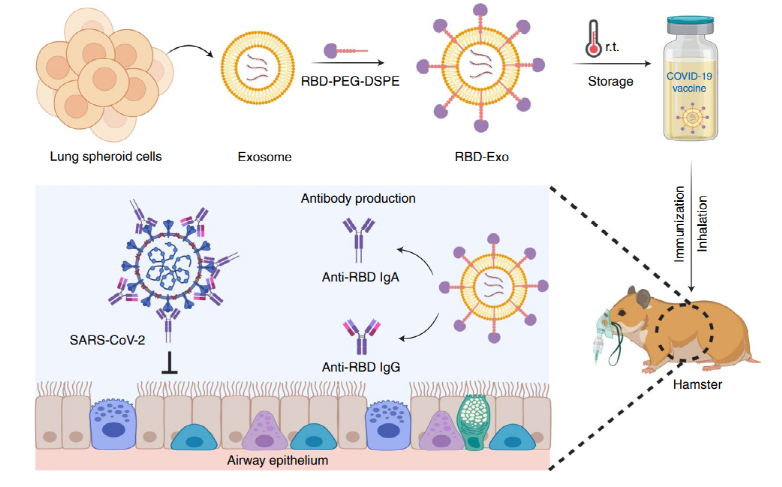
图 RBD-Exo吸入疫苗的设计与预防机制
外泌体具有相对脂质体更优良的肺滞留特性
目前用于新冠疫苗递送的多为脂质纳米颗粒载体,但是其难以实现靶细胞特异性递送。由于该课题组前期已成功制备肺球样细胞(LSCs)来源的可吸入外泌体用于特发性肺纤维化的治疗,该外泌体具有高度的肺部细胞同源靶向性,有望实现更优的肺部递送与滞留。以CD1小鼠为模型的体内分布研究结果表明,该外泌体在雾化吸入4 h后可递送至气管及细支气管,并在24 h后大量分布于肺实质中,表现出比商用脂质体更优良的肺部递送性能。此外,该吸入外泌体可更多的被树突状细胞所摄取,具有作为疫苗递送载体来激活抗原呈递的潜力。
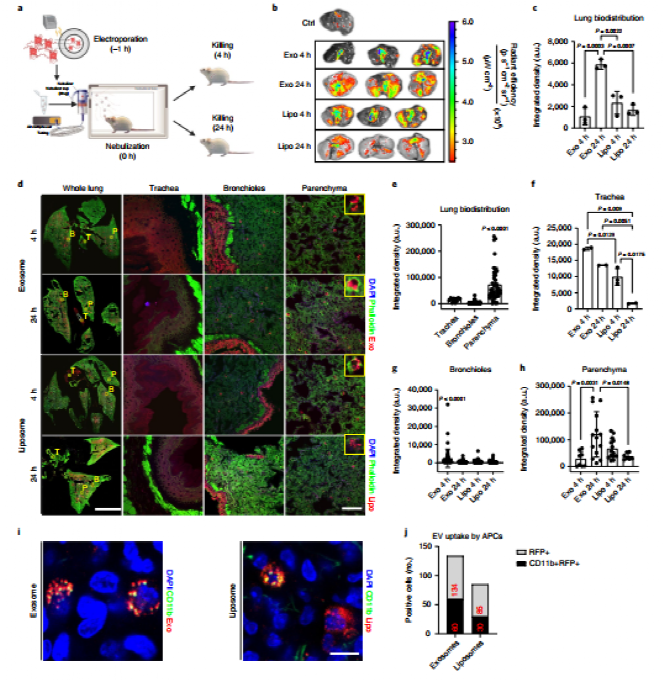
图 商用脂质体与外泌体的肺递送性能
RBD-Exo疫苗的制备与表征
在证明了吸入外泌体优良的肺部递送性能后,进一步将RBD与DSPE-PEG共价结合获得RBD-PEG-DSPE,并将其修饰于LSC-Exo表面获得RBD-Exo。通过TEM和免疫印迹法证明了RBD-Exo的成功制备,在装载前后其粒径从约136.7±4.2 nm略增长至145.3±4.1 nm,所得到的每1010个RBD-Exo中可装载约0.52 μg RBD。进一步, 作者检验了RBD-Exo在-80℃、4℃、室温3周和室温3个月的储存稳定性。通过分析储存后RBD-Exo的形貌、粒子浓度、粒径和RBD装载量等关键参数,证明RBD-Exo在室温条件储存3个月后依然可以保持结构和生物稳定性,显示出卓越的储存稳定性。此外,在C57BL/6小鼠模型中,作者发现相对于游离RBD,RBD-Exo提高了B细胞、巨噬细胞和树突状细胞(DCs)等抗原呈递细胞(APCs)对其的识别摄取,其中DCs是吞噬其的主要APCs。
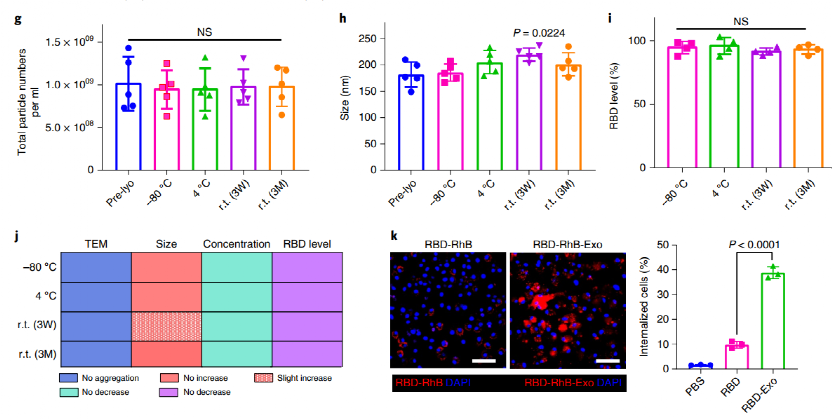
图 RBD-Exo的储存稳定性
RBD-Exo疫苗激活系统性和肺粘膜免疫反应
对CD1小鼠进行两剂吸入疫苗接种后,小鼠被气管内给予SARS-CoV-2模拟病毒感染,研究RBD-Exo吸入疫苗的抗病毒疗效和机制。结果显示,相对于静脉注射组,吸入RBD-Exo显著提高了病毒清除速率。血清抗体分析表明,吸入RBD-Exo显示出最高的血清RBD特异性抗体生成水平。对抗体亚型进一步分析证明静脉注射RBD-Exo激活Th2型免疫反应,而吸入RBD-Exo激活Th1型免疫反应。以上结果均表明吸入RBD-Exo疫苗可激活针对RBD的系统性免疫反应。接着,对鼻咽灌洗液(NPLF)和支气管肺泡灌洗液(BALF)中的RBD特异型IgA水平检测结果显示,静脉注射RBD-Exo组难以激活肺粘膜免疫反应,而吸入RBD-Exo组在NPLF和BALF中均可以激活最高水平的抗体产生,证明其可以诱发肺部粘膜免疫反应。对肺部CD4+和CD8+ T细胞分析表明,相对于游离RBD组,RBD-Exo组可诱导高水平Th1型细胞因子阳性T细胞(IFN-γ, IL-4和IL-17a)的增殖分化,且室温长期储存后的RBD-Exo显示出相似水平的免疫激活效应,证明其良好的储存稳定性。
进一步分析RBD-Exo是否能够激活脾脏免疫细胞产生细胞因子。结果显示,RBD-Exo吸入疫苗可显著提高小鼠体内IFN-γ,TNF-α和IL-6等促炎因子的水平,显示出比静脉注射更优良的免疫刺激效果。提取小鼠脾脏中的免疫细胞进行分析,RBD-Exo组和长期储存的RBD-Exo组能够刺激更大量的Th1型细胞因子阳性T细胞的增殖分化,且均优于游离RBD组。
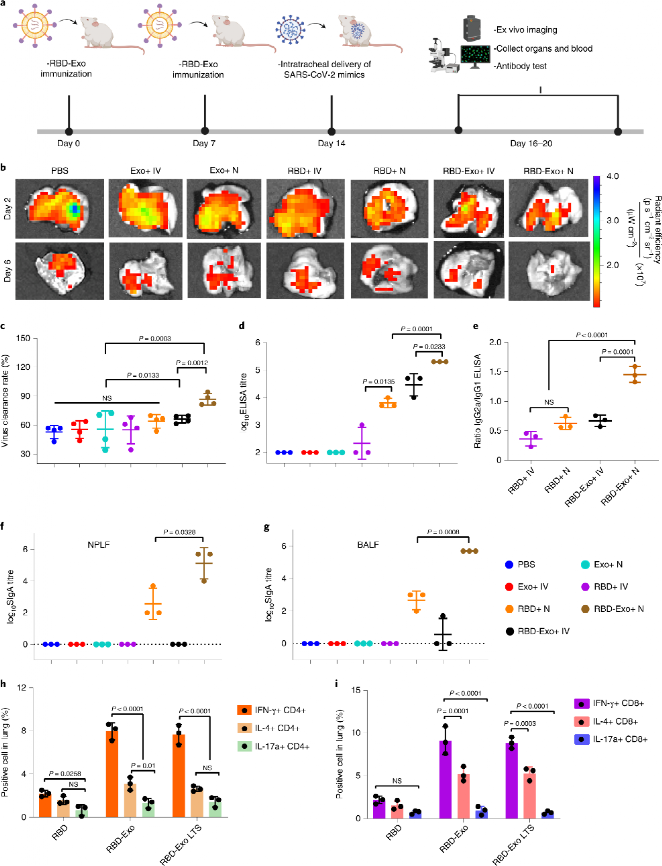
图 RBD-Exo疫苗接种激活免疫反应加快病毒清除
RBD-Exo疫苗预防大剂量SARS-CoV-2病毒感染
接着,在仓鼠模型中检验RBD-Exo预防病毒感染的效果。在两剂吸入疫苗接种后气管内给予感染剂量的活病毒,而后对其咽拭子和肺泡灌洗液中的病毒RNA进行检测。结果表明,在接种病毒4天后RBD-Exo组即可显示出相对PBS组和游离RBD组更低的病毒检出量,证明其优异的预防性能。RBD-Exo组在给予病毒前后均显示出最高的RBD特异性血清抗体滴度水平。肺组织的HE和Masson染色均表明RBD-Exo吸入疫苗组显著减轻肺炎症浸润水平和病灶结节数量。
接着,对肺组织进行多种染色以直观表征病毒分布情况。SARS核衣壳蛋白染色和全角蛋白染色共同表明病毒分布于多灶性肺细胞和肺泡间隔,且RBD-Exo组显著降低肺病毒水平。此外,采用原位RNA杂交法(RNAscope)检测肺部SARS-CoV-2病毒RNA,也证明了RBD-Exo组降低病毒水平的作用。此外,多种组织学染色也证明RBD-Exo可降低病毒水平,减轻炎症浸润。
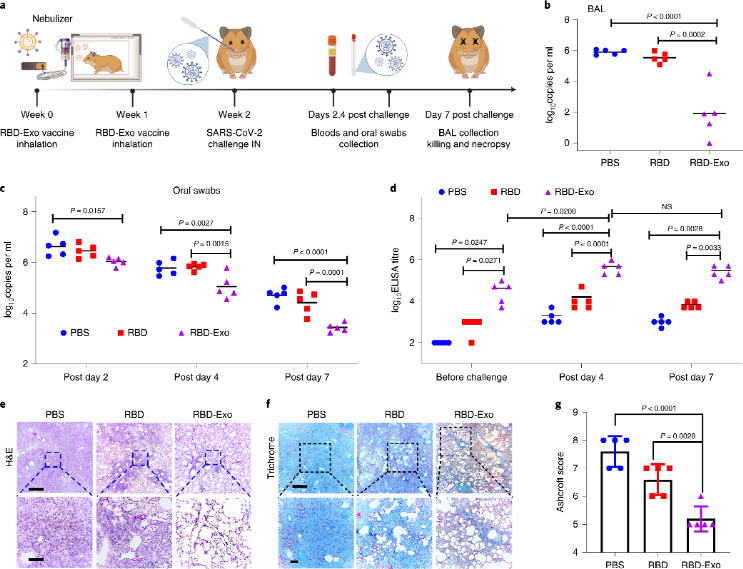
图 RBD-Exo在仓鼠SARS-CoV-2感染模型中的预防作用
RBD-Exo吸入疫苗的交叉保护活性
接着,采用更具感染性的SARS-CoV-2 D614G突变株研究RBD-Exo吸入疫苗的抗交叉感染效果。结果表明,接种RBD-Exo吸入疫苗后可显著降低全肺内病毒水平,包括气管、支气管和肺实质组织,且长期储存不影响疫苗效果。建立体外SARS-CoV-2感染模型以研究其交叉保护机制,将原代小气道上皮细胞与原代支气管/气管上皮细胞共培养于Traswell系统,以评估不同来源IgA的阻断活性。结果显示,RBD-Exo 吸入疫苗接种小鼠来源的IgA有效地抑制了SARS-CoV-2 D614G对支气管/气管细胞的感染。此外,对疫苗接种小鼠来源的IgA和IgG抗体中和病毒的能力进行比较,结果显示二者的IC50分别为53.6 ng/ml和65.4 ng/ml,表明IgA比IgG抗体具有更高的交叉活性。
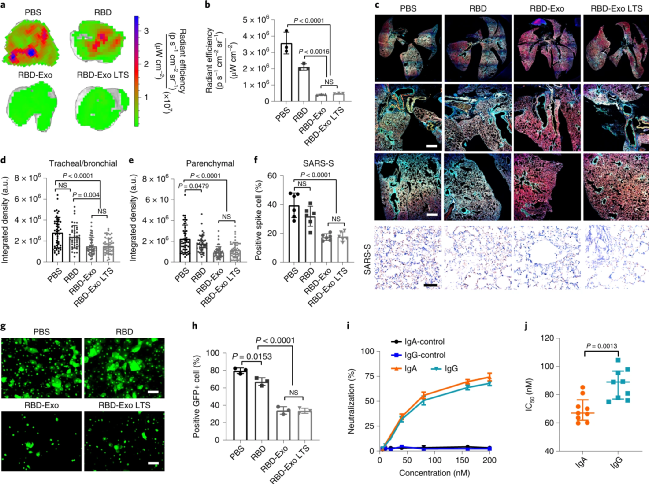
图 RBD-Exo吸入疫苗交叉保护SARS-CoV-2 D614G突变株感染
小结与展望
综上所述,本研究设计制备了一种可吸入的基于外泌体的疫苗体系RBD-Exo,可通过激活肺粘膜免疫反应,大量激活RBD特异性抗体生成,调节T细胞增殖分化,从而有效防止病毒感染,减轻肺部病变。相对于目前上市的疫苗产品,RBD-Exo不仅提高肺部递送效率,还能在室温下稳定储存3个月,大大降低疫苗接种成本,具有较大的应用潜力。
然而,该研究还有一些不足之处有待解决。
1)首先是外泌体的大规模生产颇具挑战,特别是RBD表面修饰的大批量生产稳定性难以保持。
2)此外,由于DSPE-PEG-NHS与RBD存在空间位阻效应,其接枝效率也需进一步提高。
3)另外,由于呼吸系统基础疾病患者的呼吸功能障碍,这种吸入型疫苗可能难以适用于该类人群。但是,这种室温稳定的吸入型疫苗为未来的疫苗开发提供了新的思路。
参考文献:
Wang, Z., Popowski, K.D., Zhu, D. et al. Exosomes decorated with a recombinant SARS-CoV-2 receptor-binding domain as an inhalable COVID-19 vaccine. Nat. Biomed. Eng (2022).
https://doi.org/10.1038/s41551-022-00902-5











