2015年,哈佛大学庄小威课题组在Science上介绍了一种称为MERFISH (multiplexed error-robust fluorescence in situ hybridization) 的成像技术,它是一种能够同时测量单细胞中成百上千个RNA种类的拷贝数和空间分布的成像方法,这使得我们可以对复杂组织中的细胞类型进行原位识别和空间映射,大大地促进了我们对于组织中的细胞情况的了解。


人类大脑皮层由数十亿不同类型的细胞组成。这些细胞的空间组织和相互作用在塑造和维持各种大脑功能方面发挥着关键作用。例如,神经元和非神经元细胞之间的相互作用对于轴突传导、突触传递和组织稳态至关重要,并且是大脑正常功能所必需的。这种细胞-细胞相互作用的破坏会导致各种神经系统疾病,例如自闭症、精神分裂症和阿尔茨海默病。然而,我们对人类皮层中不同细胞类型的组织和相互作用的了解有限。
最近的单细胞 RNA 测序 (scRNA-seq) 分析揭示了人类颞中回 (MTG,与语言和听觉相关) 中转录不同的细胞群的多样性。将 scRNA-seq 与显微切割相结合的努力,以及最近针对 120 个基因的原位测序,揭示了人类 MTG 中这些转录定义的神经元细胞类型(特别是兴奋性神经元)的层状组织。然而,这些研究并没有以高分辨率阐明细胞类型之间的空间关系,并且仍然缺乏对这种高度多样性细胞类型之间细胞-细胞相互作用的系统表征。单细胞转录组学和表观基因组学分析也为小鼠、狨猴和人类皮质中细胞多样性和细胞类型的分子特征的进化提供了丰富的见解,但不同细胞类型之间的空间关系和相互作用如何在不同物种之间发生变化仍然存在很大程度上不清楚。
单细胞转录组成像允许对单个细胞进行原位基因表达谱分析,因此可以对复杂组织中的细胞类型组织进行高分辨率空间映射。
鉴于此,哈佛大学庄小威院士等人使用MERFISH技术进行人脑单细胞转录组成像,以识别皮层内细胞类型的空间分布。

研究人员从新鲜冷冻的神经外科和死后大脑样本中针对4000 个基因对人类 MTG 和颞上回 (STG) 进行了 MERFISH 测量。这些基因包括来自 MTG 的单核 SMART-seq 数据的细胞簇中的 764 个差异表达的标记基因,以及在很大程度上随机选择以增加基因覆盖率的其他表达基因。为了克服由于脂褐质引起的人体组织中的高自发荧光背景,研究人员在 MERFISH 成像之前用发光二极管阵列对样品进行了光漂白。然后,使用扩展显微镜来减少与大量基因成像相关的分子拥挤。
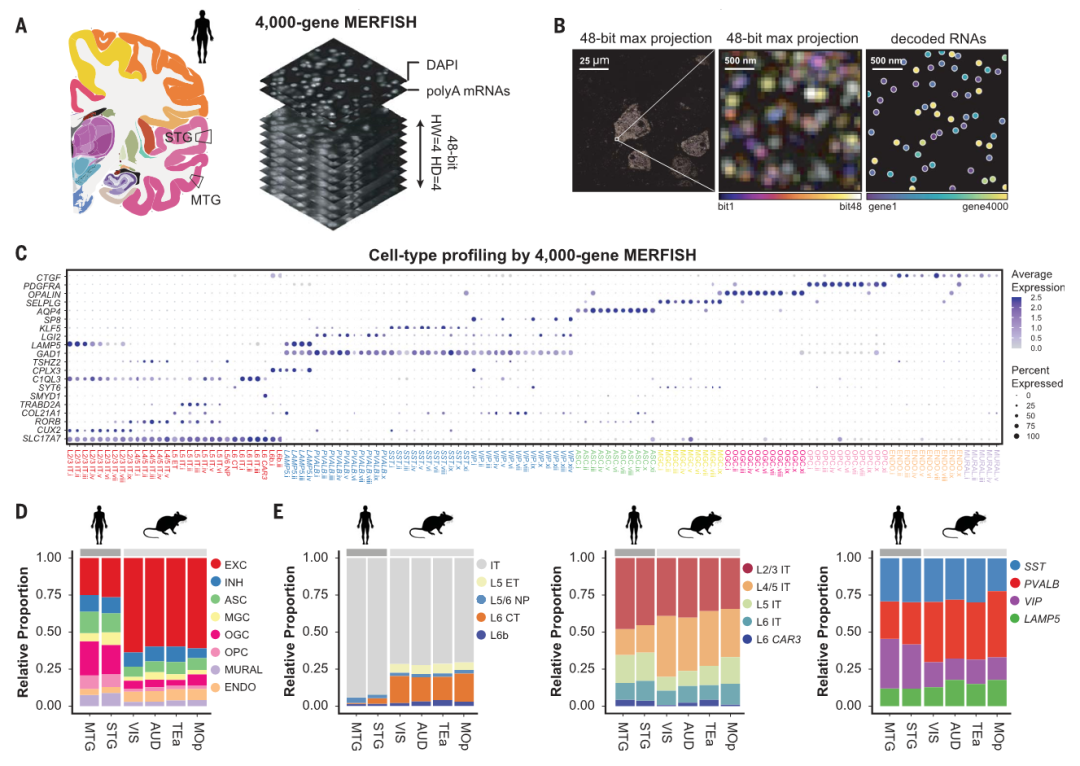
这些高空间分辨率细胞图谱使我们能够以细胞类型特异性方式系统地描述基于邻近性的体细胞相互作用,并揭示人类和小鼠之间细胞间相互作用的差异。对于神经元和非神经元细胞之间的相互作用,差异尤其明显。研究人员观察到与小鼠皮层相比,人类皮层中神经元和少突胶质细胞之间的体细胞接触或接近度显著增加。神经元周围少突胶质细胞可以为神经元提供代谢支持。因此,观察到的少突胶质细胞和神经元之间接触富集的增加可能是进化适应人脑中单个神经元放电过程中更高能量需求的结果。
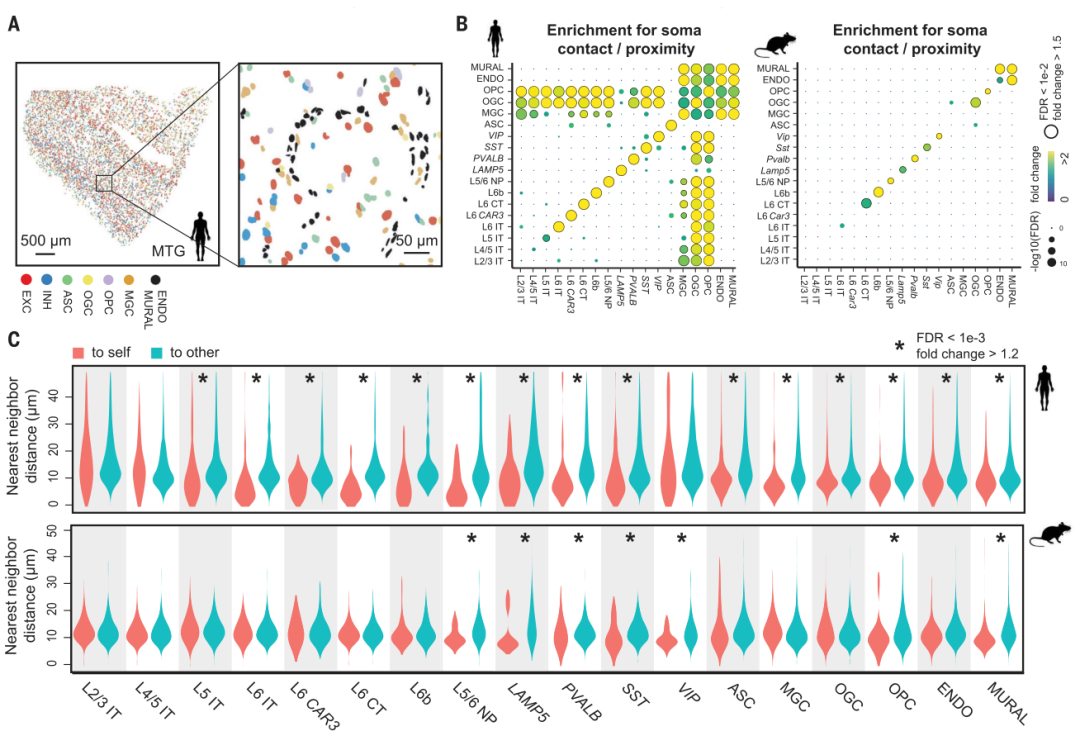
图|人和小鼠皮质中的细胞类型特异性细胞间相互作用
此外,研究人员观察到与抑制性神经元相比,人类皮层中小胶质细胞和兴奋性神经元之间的接触或接近优先富集,而小鼠皮层对这种小胶质细胞-神经元接触没有表现出显著的富集。卫星小胶质细胞可以帮助维持组织稳态,人类遗传学证据表明,小胶质细胞发挥保护作用,降低某些神经退行性疾病的发病率。因此,该观察可能代表人类小胶质细胞和兴奋性神经元之间的功能性相互作用。与非相互作用的小胶质细胞和神经元相比,与神经退行性疾病遗传相关的一些配体-受体对富含接触小胶质细胞-神经元对,表明观察到的小胶质细胞-神经元相互作用的潜在分子基础以及这些细胞-细胞相互作用与神经退行性疾病的潜在联系。
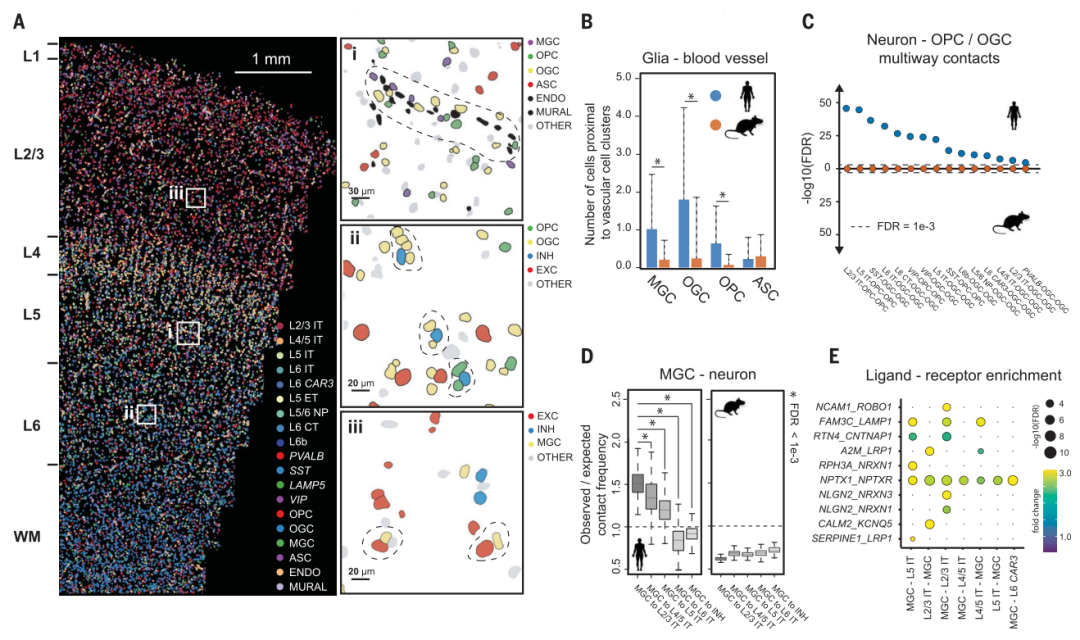
图|人和小鼠皮质神经胶质细胞和血管细胞之间以及神经胶质细胞和神经元之间的相互作用
综上所述,在这项研究中,研究人员展示了人脑组织的 4000 基因 MERFISH 成像。该 MERFISH 图像能够原位识别超过 100 个神经元和非神经元细胞群,并全面映射这些细胞在人类 MTG 和 STG 中的空间组织,从而产生具有高粒度的分子定义和空间分辨的细胞图谱。
研究人员确定了小鼠和人类大脑之间不同的细胞类型特异性关联模式。他们发现人类比小鼠拥有更多特定的神经元,并且这些细胞与类似的神经元细胞类型更接近并相互作用。通过研究受体-配体对,作者确定了神经元和小胶质细胞之间可能的接触,这可以解释为什么某些基因与神经退行性疾病有关。
参考文献:
Conservation and divergence of cortical cell organization in human and mouse revealed by MERFISH. Science 2022.
DOI: 10.1126/science.abm1741
https://www.science.org/doi/epdf/10.1126/science.abm1741

庄小威,生物物理学家。1972年1月生于中国江苏。1991年获得中国科学技术大学学士学位,1996年获得美国加州大学伯克利分校博士学位。2012年当选为美国国家科学院院士,2013年当选为美国国家艺术与科学院院士,中国科学院外籍院士、美国国家医学科学院院士。
庄小威的主要研究领域是生物物理学。她在高分辨率光学成像、单分子荧光共振转移等光子学方法及其应用方面的开拓性贡献,极大地推动了生物医学领域的突破性进展。
由阿贝确立的数百纳米空间分辨率的光学衍射极限制约了对亚细胞器精细结构的研究。2006年,庄小威实验室发明了基于单分子荧光检测的超高分辨率成像方法,即随机光学重构显微术 (STORM),并应用该方法实现三维超高分辨率成像。基于光化学机制,她的实验室合成了超亮的可光控的染料及具有最佳性能的荧光蛋白,将分辨率进一步推进到几纳米,比光学衍射极限高近两个量级。在此基础上也发展了活细胞快速三维高分辨荧光成像。这一系列技术发展使得荧光显微技术进入分子水平成像时代。全世界众多实验室采用了这些技术,而基于该技术的商用STORM显微镜已进入包括中国在内的世界各地的影像平台和实验室中,大大促进了生物医学研究。
庄小威不只是开发超分辨影像方法的先驱,同时也是应用这些方法的领军者。她将STORM广泛应用于从单细胞生命体到复杂的哺乳动物的大脑,发现新的细胞结构,揭示全新的作用机理。例如她发现神经元轴突的膜骨架有一种令人吃惊的规律的周期性结构;采用超高分辨率大容积成像绘制了神经元突触输入区的图谱,揭示该区域对方向选择性的作用;揭示小鼠端粒蛋白质TRF2在端粒环形成中的必要性;发现精子特有的钙离子通道和其它有关钙信号通路分子形成一种特殊结构,该结构对精子的超活化有重要意义。庄小威也是最早将单分子荧光共振转移技术发展成探测生物分子结构动力学的有效工具的研究者之一。她在RNA折叠方面的研究揭示了难以用常规实验探测的单分子短暂折叠中间态和多种折叠通路,展示了RNA折叠具有非常崎岖的能量面;
2015年,她还发明了一种高通量的单分子荧光原位杂交方法MERFISH,可以对单个细胞中天然状态下的数千种RNA进行成像和定量;她揭示了染色质重塑复合物新的调控机理;她发明的单病毒跟踪方法可研究单个病毒进入细胞与细胞内吞机器的相互作用。这些系列工作均为生物学中原创性的工作,发表在国际顶尖学术期刊。











