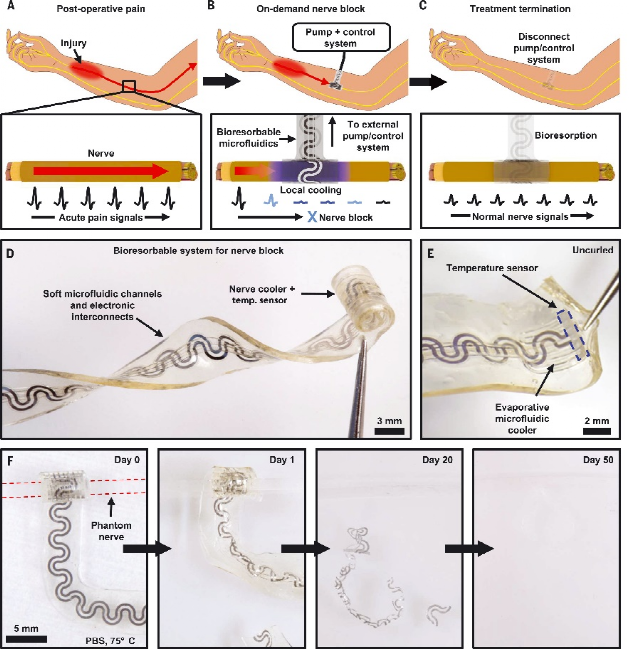
生活中总是有各种各样的不幸,大到车祸肿瘤,小到感染发炎,虽然大多数我们都能挺过去,但是他们总会给我们留下一些印记——比如神经痛。据一项2019的调查显示,一般人群中有3%到17%的神经痛发病率,而一般的治疗方法效果有限。一项英国的调查显示有近17%的神经痛患者可以达到痛不欲生的程度,因此阿片类药物因为其高疗效而被广泛使用。阿片类药物滥用引起的社会负担日益加重,促使局部、非阿片类和非累加性疼痛管理技术的发展。神经组织中代谢、发电和离子活性的时间测量都表现出负温度依赖性。周围神经局部冷却会降低神经活动的传导速度和信号幅度。应用于周围神经的冷却是阻断疼痛信号的一种很有前景的方法,因为它是非成瘾性的、快速可逆的,可局部应用的。冷却神经镇痛需要时空精确控制温度,以最大限度地实现预期结果,并将冷却引起的组织损伤的可能性降至最低。目前的神经冷却方法依赖于刚性、笨重的系统,这些系统阻止局部冷却作为周围神经疼痛管理的实用方法。近日,由美国西北大学的John A. Rogers院士带领其团队开发了一种柔软的,小型化的,可植入的冷却器,以液体到气体的相变作为冷却机制来暂时阻断神经疼痛。他们借用了电神经袖带的设计,并用携带微升生物惰性冷却剂的微流体通道代替了电线。袖带内集成的热薄膜传感器能够实时监控温度,从而实现闭环控制。水溶性与高生物相容性材料的设计消除了不必要的设备负载和二次手术带来的额外治疗风险。多周体内试验表明,该设备可以在大鼠模型中为神经性疼痛提供快速、精确地局部按需镇痛。

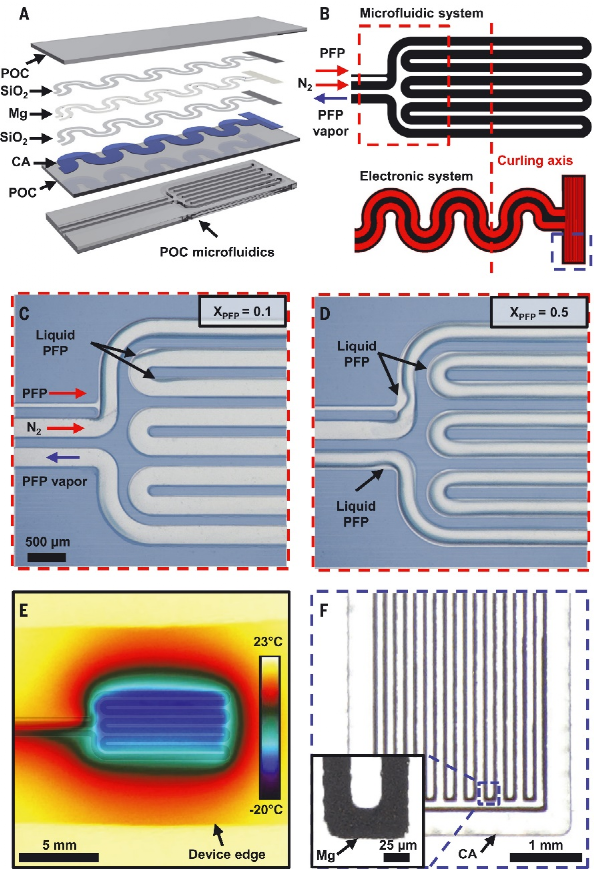
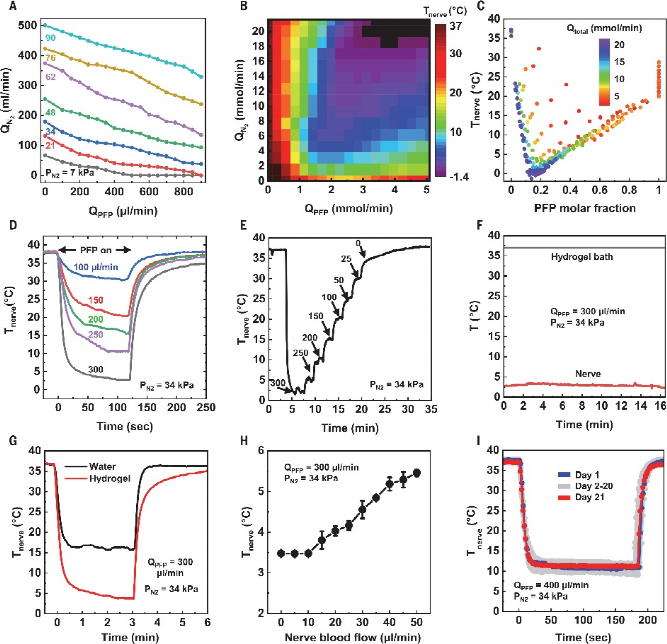
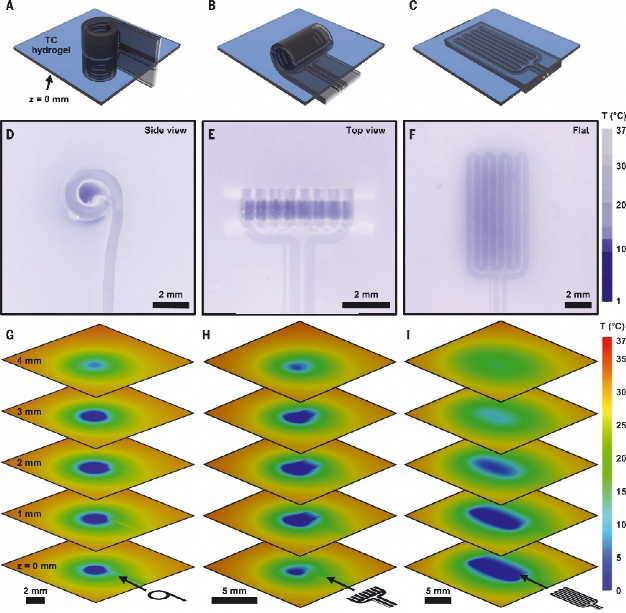
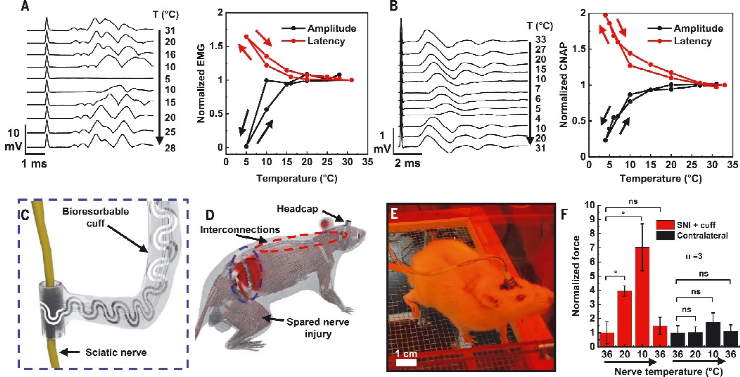
作者团队介绍了柔软、可生物吸收的周围神经冷却和温度传感单元的概念和设备设计,这个设备旨在通过在和患者需求相匹配的特定时间内,有针对性的冷却刺激来可逆地阻断疼痛信号。该技术由混合微流体和电子系统组成,用于冷却的同时监控周围神经的局部温度。微流体系统和电子系统形成蛇形排布以在设备水平上产生柔软,可拉伸的力学性质,有效模量不高于周围神经的弹性模量。这些电子和微流体系统终止于袖带结构中,其直径与大鼠坐骨神经(1.5毫米)相匹配,为神经提供紧密的机械和热界面,而无需缝合线。袖带的卷曲几何形状及其弹性和柔软特性使的移植术中手动展开扣合成为可能。该系统的一个重要特征是它完全由水溶性成分材料构成,这些材料溶解的最终产物与皮下组织有着良好的生物相容性。在75°C下浸没在磷酸盐缓冲盐水(PBS),材料在20天内基本上溶解,并且在50天后消除残留物。图 按需神经阻滞的柔软、可生物吸收的蒸发式微流体冷却器混合微流体电子设备的各层如下图所示。可生物吸收弹性体聚辛二醇柠檬酸盐(POC)形成微流体系统。POC表现出多种特性,包括2.8 MPa的弹性模量、通过表面侵蚀而可控的降解速率以及与神经的相容性。微流控系统包括经皮互连系统,将液体冷却剂[全氟戊烷(PFP)]和干燥N2输送到端部提供流体通道的完全密封系统中的蛇形蒸发室中。电子层与微流体系统共面,温度传感元件位于器件的远端。PFP和N2同时开始流入该结构,促使PFP在PFP和N2通道之间的微流控连接处以及沿着蛇形蒸发室蒸发。PFP和N2的流率以及蒸发室的几何形状决定了冷却效果的大小和局部性。在低PFP摩尔流量比下,PFP在通过三个蛇形管后完全蒸发,会有一定的PFP积聚在微通道的角落。在高摩尔流量下,PFP通过环形流并沿着微通道的侧壁流动。这种相变促使展平的器件温度在室温条件下2分钟内降至−20°C。该装置的冷却区域主要局限于蛇形蒸发室,由微流控通道设计和流体流速决定。宽度和长度分别为25μm和72 mm的蛇形镁迹线通过镁的电阻温度系数提供温度反馈信号。在37°C水凝胶组织模拟物内模拟装置的整体与神经冷却效果。将N2压力常数保持在7至90 kPa的范围内,并将PFP流速从0扫至900μl/min,得到的数据揭示了N2流速对PFP流速的依赖性。在相同的范围内系统地扫描PFP和N2流速的实验揭示了摩尔流速对神经温度的影响。在300μl/min的情况下,最大冷却速率为3°C/s。周围神经在15min内持续稳定地冷却到3.0°C。尽管皮下生物流体和神经血流有助于对流热传递,但神经中的热传递主要通过传导发生。将纯传导环境(水凝胶,37°C)和包含对流效应(水,37°C)的测量值进行比较,证明了上述结论。同时神经周围的血流也是另一个热通量来源。验证50μl/min的神经血流量对流,可以发现神经降温温度增加2.0°C。在不需要绝缘层的情况下,在预定位置达到冷却效果是蒸发微流体冷却方法的一个关键能力。以三种不同配置嵌入热致变色组织模拟物中的神经冷却器的实验研究模型。在袖带内包含10°C温跃层,从袖带外部向下延伸约500μm且不沿神经纵向延伸超过装置边缘的区域除外。该温跃层几乎延伸到扁平装置中的整个蛇形蒸发室。热三维有限元分析证实,冷却效果在很大程度上受到径向和纵向的限制,限制在冷却套的范围内以及平冷却器的上方。蒸汽的温度仍然限制在微流控通道内,在z=0 mm平面内径向下和向右延伸的冷区如图所示。急性动物实验表明,蒸发微流控冷却器能够可逆地消除诱发神经信号。胫骨前肌肌电图(EMG)显示,在8分钟内从31°C冷却到5°C期间,肌电图幅度减少92%,神经肌肉活动的信号延迟增加64%。复温3分钟后,振幅和延迟分别恢复到初始值的108%和100%。从冷却套远端坐骨神经进行的电记录提供了通过单个刺激脉冲诱发的复合神经动作电位(CNAP)的测量。在15分钟内从33°C冷却到4°C,信号幅度下降77%,延迟增加97%。在随后的3分钟复温后,振幅和延迟分别恢复到其初始值的101%和97%以内。在为多天长周期实验构建的设备中,安装在坐骨神经上的微流控蒸发冷却器和温度传感器的经皮连接沿着脊柱皮下到达小鼠颅顶。在保留性神经损伤(SNI)后3周内对两只对照动物进行的机械伤害敏感性测试显示,与对侧相比,SNI侧的机械敏感性阈值预期增加,持续时间超过3周。使用另外三只同时接受SNI和冷却套的动物进行的研究表明,植入3周后,SNI处理的神经从37°C冷却到10°C,导致机械敏感性阈值增加七倍,这与显著的冷却诱导镇痛作用一致。植入式装置在规定的时间内提供按需局部镇痛,随后进行溶解和生物吸附,将代表疼痛管理技术的质的进步。截肢、神经移植或脊柱减压手术后的疼痛管理就是一个例子。在这里,相关神经已经被分离和识别;因此,袖带的应用将直接集成到临床工作流程中。在该方案中,在神经周围植入一个生物可吸收的冷却器,该冷却器通过集中应用冷却能力,能够可逆地消除神经活动和疼痛信号。由水溶性材料制成的结构在愈合过程完成后自然会导致冷却系统溶解,并且无需进行二次手术。实验表明,在自由活动的动物模型中,按需镇痛具有治疗神经病理性疼痛的能力。这些概念、材料和设备设计为一类植入式冷却系统奠定了工程基础,该系统能够在一系列临床应用中实现靶向神经阻断,包括靶向、按需、非阿片类疼痛管理。
值得注意的是,5月26日,西北大学John A. Rogers院士、Igor R. Efimov和Rishi K. Arora等人在Science上报道了一种可生物降解的闭环传感器-执行器系统,用于心率监测和控制,最终目的有望实现控制有心动过缓(心率缓慢)术后风险的患者的心脏功能。(Rogers院士这篇Science,很走心!)

Jonathan T Reeder, Zhaoqian Xie, Quansan Yang, et al. Soft, bioresorbable coolers for reversible conduction block of peripheral nerves. Science. 2022 Jul;377(6601):109-115.https://www.science.org/doi/10.1126/science.abl8532#tab-contributors