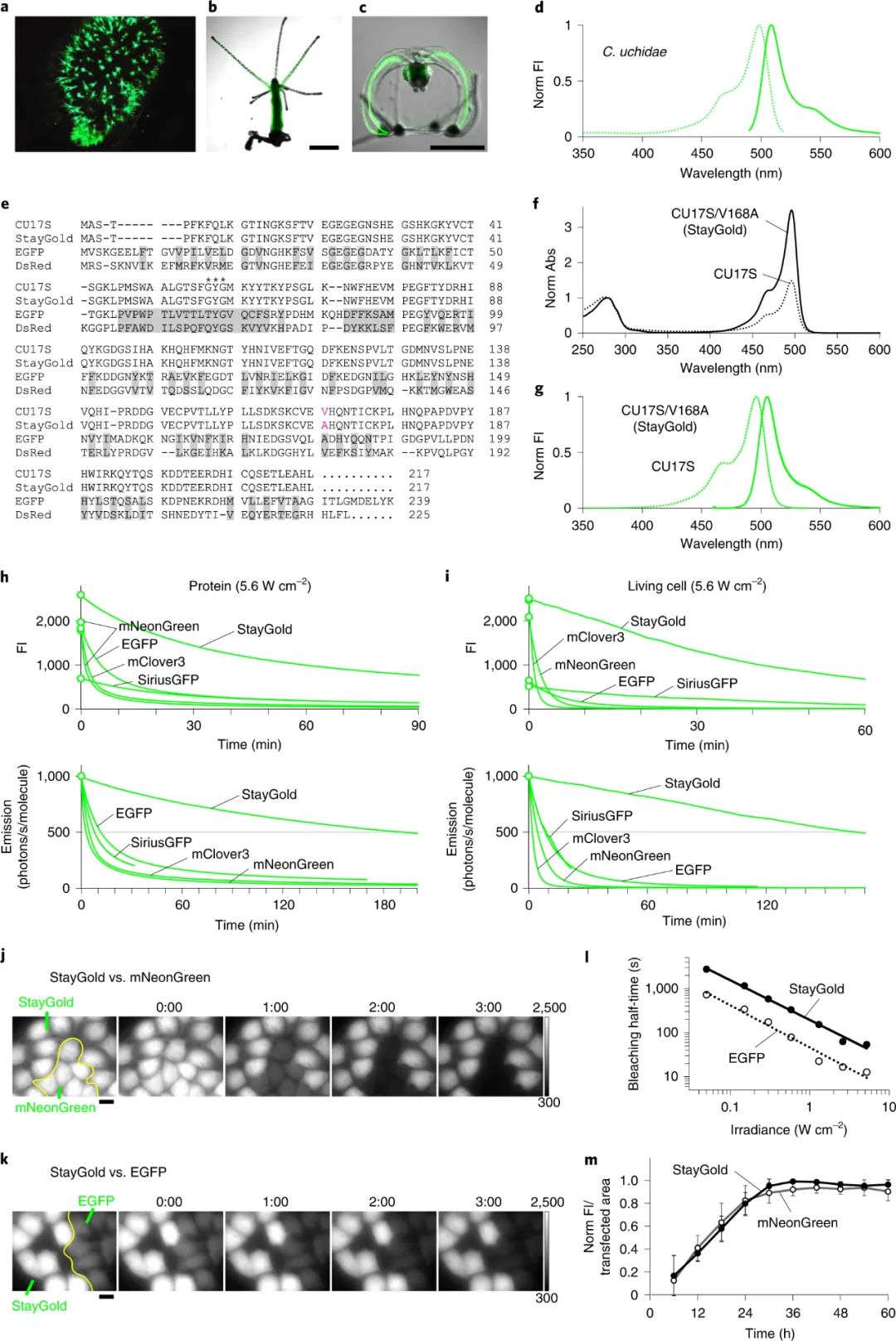
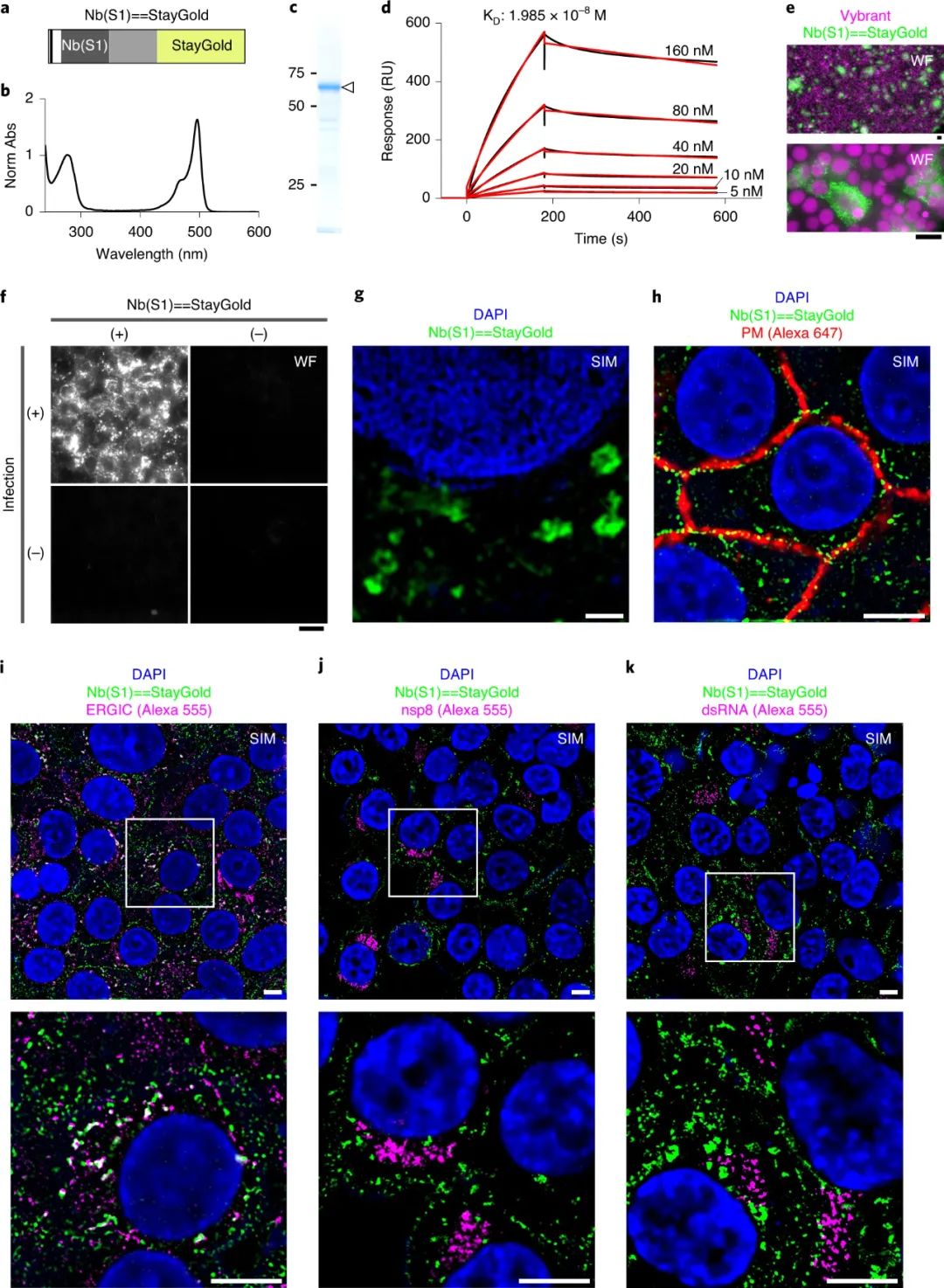
荧光蛋白的低光稳定性是荧光显微镜许多应用中的限制因素,如何改进该特性是目前成像界(特别是生物成像领域)想要解决的关键挑战。由于基因转移和蛋白质靶向技术的改进,现在可以使用荧光蛋白标记并有效观察细胞器和细胞骨架等亚细胞成分。此外最近对亚细胞成分进行的时间分辨率良好的观察揭示了它们精细结构的快速运动。然而,与化学染料相比,荧光蛋白因其快速的光漂白而臭名昭著,这意味着研究人员必须使用明亮标记的细胞,尽量减少照明功率,并使用延时成像。然而,有人担心,由于过度表达,明亮标记的细胞可能会产生人为信号,低照明功率可能会导致光子预算不佳,从而阻碍大多数超分辨率成像技术的使用,而时间下采样(延时)可能会错过瞬时但重要的信号。因此,需要高光稳定性的荧光蛋白来改善这些不良情况。 近日,日本理化学研究所先进光子学研究中心Atsushi Miyawaki和日本北里大学Kazuhiko Katayama等人使用水母 Cytaeis uchidae 来解决荧光蛋白光稳定性差的问题。他们发现其主要荧光蛋白的光稳定性比目前使用的任何荧光蛋白高10倍以上。通过设计一个不仅提高了光稳定性而且亮度与其他荧光蛋白相当的版本,他们创建了StayGold,为成像界提供了一个强大的新工具。这种增强的光稳定性很有趣,因为开发荧光蛋白似乎涉及亮度和光稳定性之间的权衡。在使用荧光蛋白时,分子氧 (O2) 通常是一把双刃剑。一方面,荧光蛋白发色团的成熟需要氧化反应,而对O2 的高可及性有助于提高实际亮度。另一方面,荧光蛋白发色团的分解是由O2 引起的,而荧光蛋白发色团处于单重或三重激发态,因此增强的O2可及性会降低光稳定性。使用StayGold,研究人员优先选择了适度的明亮细胞,可以在长时间进行细胞范围内、快速、连续的超分辨率成像。该课题组主要采用了三维结构化照明显微镜(3D-SIM),该显微镜使用三束照明创建了3D干涉图案。图|水母衍生荧光蛋白 StayGold 的光稳定性在多个细胞中对内质网(ER)网络动力学进行了6分钟的成像,而不降低超分辨率图像质量。6分钟的观察期足够长,可以连续施用两种药物,一种启动钙动员,另一种关闭钙动员。研究发现,钙离子动员后,ER网络的整体重排被减弱。但是,一旦固定样品,光细胞毒性就不再是一个问题,通过使用强烈的长时间照明进行激发,可以大大增加信号强度。在固定SARS-CoV-2感染细胞后,研究人员通过纳米体-StayGold融合的超分辨率体积成像实现了病毒棘突蛋白的精细细胞内定位。
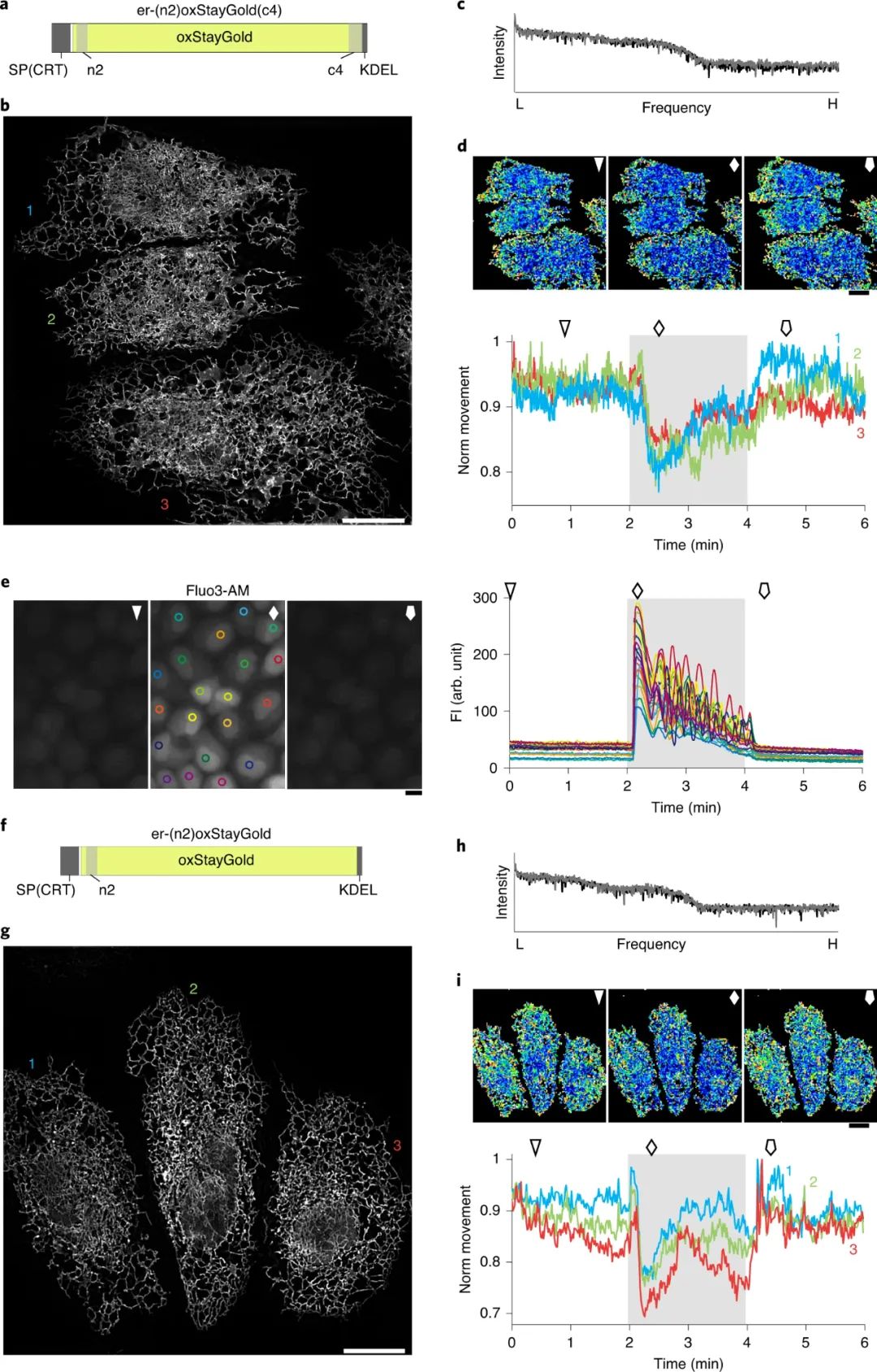
图|通过快速、可持续、宽3D-SIM显示,激动剂诱导和拮抗剂诱导的内质网结构纵向变化图|通过StayGold SIM技术可视化细胞中的SARS-COV-2组件荧光蛋白的光稳定性是现代生物成像中最重要的障碍之一,该StayGold展示的性能使可持续生物成像成为可能,而不受显著光漂白的限制。该课题组仍在进一步开发 StayGold 技术。由于 StayGold 是二聚体,因此正在开发用于蛋白质融合应用的单体StayGold (mStayGold)。与此同时,通过融合荧光蛋白构建体的两个副本创建了一个串联二聚体 StayGold (tdStayGold),研究人员成功地将其用于可视化微管相关蛋白复合物和兴奋性突触后密度蛋白的动力学。研究人员还通过进一步修饰其氨基和羧基末端来开发完全融合耐受的 StayGold 变体。目前正在进行的晶体结构的研究,将有助于通过设计的诱变来实现StayGold的定向进化。重要的是要认识到,所有野生型荧光蛋白都经过了广泛的工程改造,以提高其荧光成像性能。使用基因组编辑技术将 tdStayGold(或更高版本的 mStayGold)整合到特定位点,将能够以低拷贝数定量可视化荧光蛋白标记的蛋白质,并在较长时间内跟踪细胞中的此类蛋白质。研究人员巧取了亮度-光稳定性的权衡,开发出了StayGold,它具有优异的光稳定性和出色的亮度,这些特性促使研究人员去思考StayGold如何与O2相互作用,以使生色团成熟和分解。一旦对StayGold独特的光稳定性机制有了原子水平的理解,确定光稳定性机制是否可转移到其他流行的荧光蛋白将是一件有趣的事情。Hirano,M., Ando, R., Shimozono, S. et al. A highly photostable and bright green fluorescent protein. Nat Biotechnol (2022).https://doi.org/10.1038/s41587-022-01278-2