几十年来,化疗纳米药物的前景一直吸引着临床医生和患者。纳米颗粒 (NPs) 可以直接靶向肿瘤细胞,这将减少化疗的剂量及其全身毒性,提高患者的生活质量,并在终生剂量限制的情况下延长治疗的效用。然而,这些希望在很大程度上仍未实现。脂质体药物载体几乎构成了所有临床批准的纳米药物,与单独使用药物治疗相比,并没有延长患者的总体生存期。这些失败归因于向靶细胞的传递不良,因为 NPs 必须首先穿过一系列生物屏障。尽管纳米载体的组成、表面化学、尺寸和形状已被优化以促进细胞进入,但细胞摄取信号的异质性阻碍了进展。近日,美国四院院士、麻省理工学院Paula T. Hammond教授等人利用高通量筛选方法nanoPRISM揭示了NP材料特性与细胞内化之间的相互关系。成果发表在Science上。
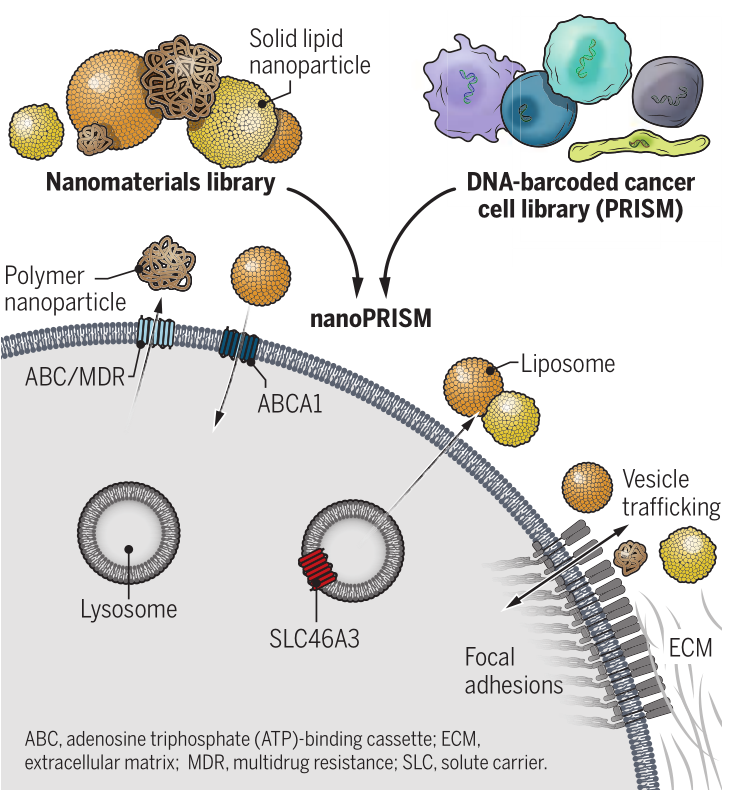
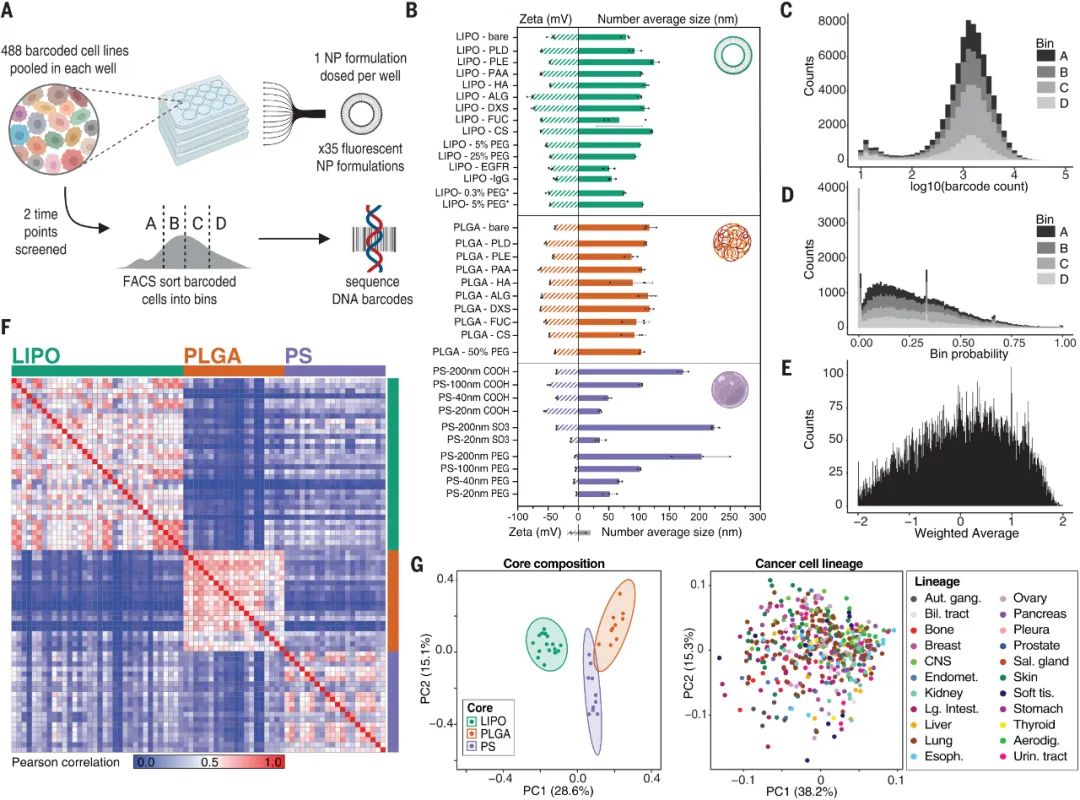
nanoPRISM 技术使用分子条形码PRISM方法(profiling relative inhibition simultaneously in mixtures)生成约500 个癌细胞系的筛选库,这些细胞系带有不同的 DNA 序列,允许通过高通量基因组测序识别细胞。该细胞库与一组35种不同的荧光标记 NPs 组合,这些 NPs 具有不同的核心成分、表面化学性质和粒径,以识别细胞摄取的协同相互作用。PRISM标记的细胞根据摄取水平分为四组,对它们的DNA进行测序以识别它们并筛选可归因于 NP 特征或细胞信号传导的 NPs 内化的关键驱动因素。研究人员在过表达该受体的细胞系中比较了与靶向表皮生长因子受体 (EGFR) 的抗体结合的 NPs 与单独的 EGFR 抗体的摄取效率。NanoPRISM 揭示了细胞摄取的差异,这很可能是由NP共轭的空间位阻引起的。这些结果表明,nanoPRISM可能适用于评估抗体-药物偶联物(ADC),这是一个不断增长的治疗类别。
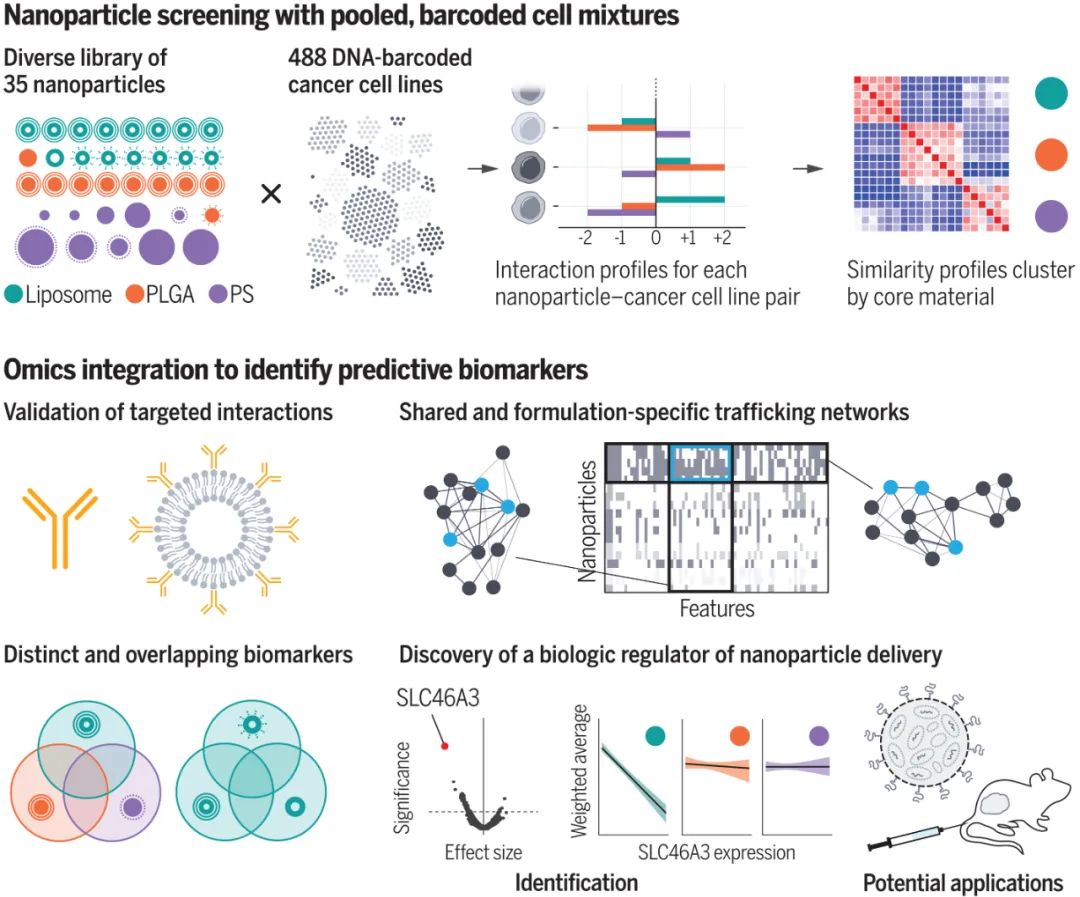
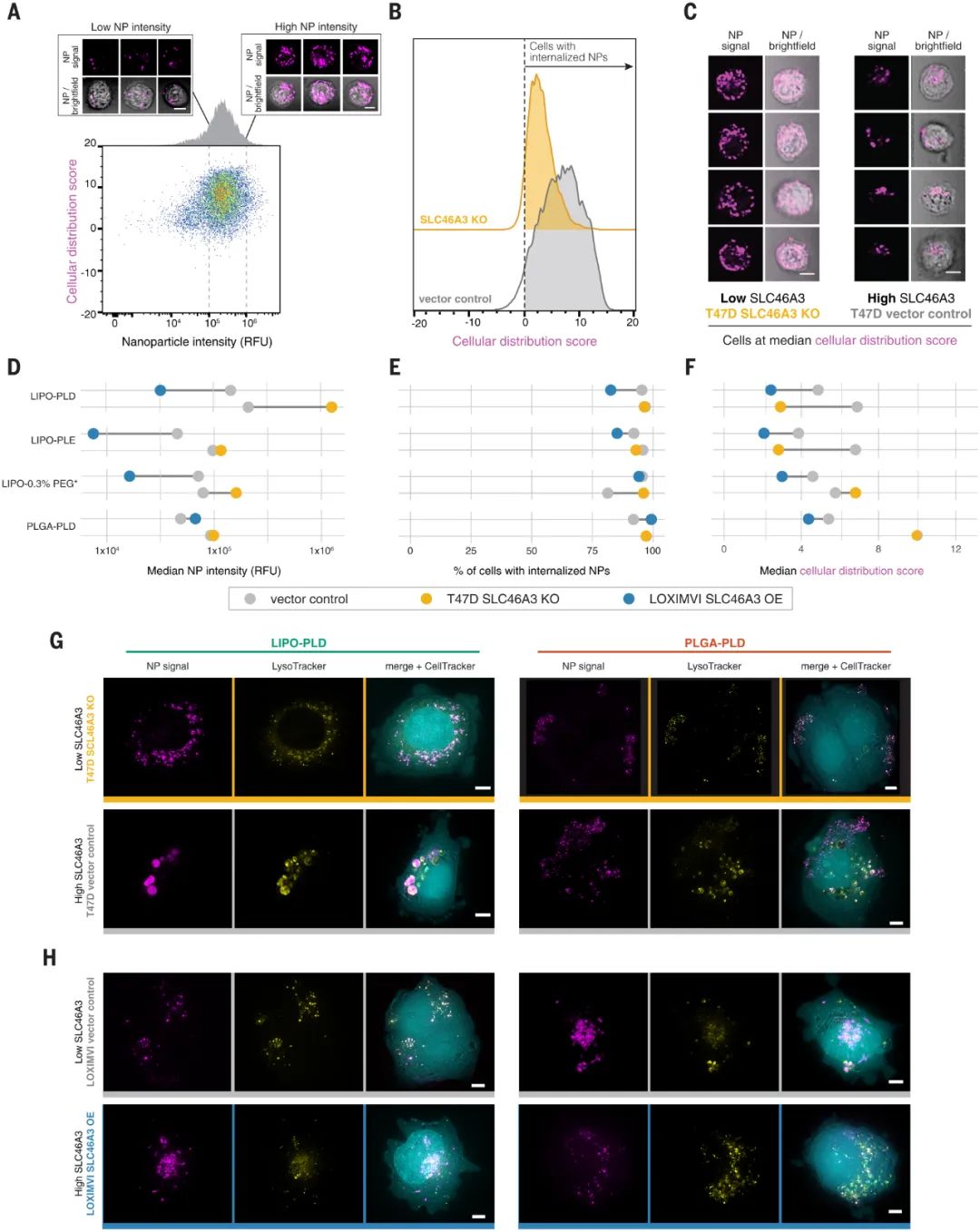
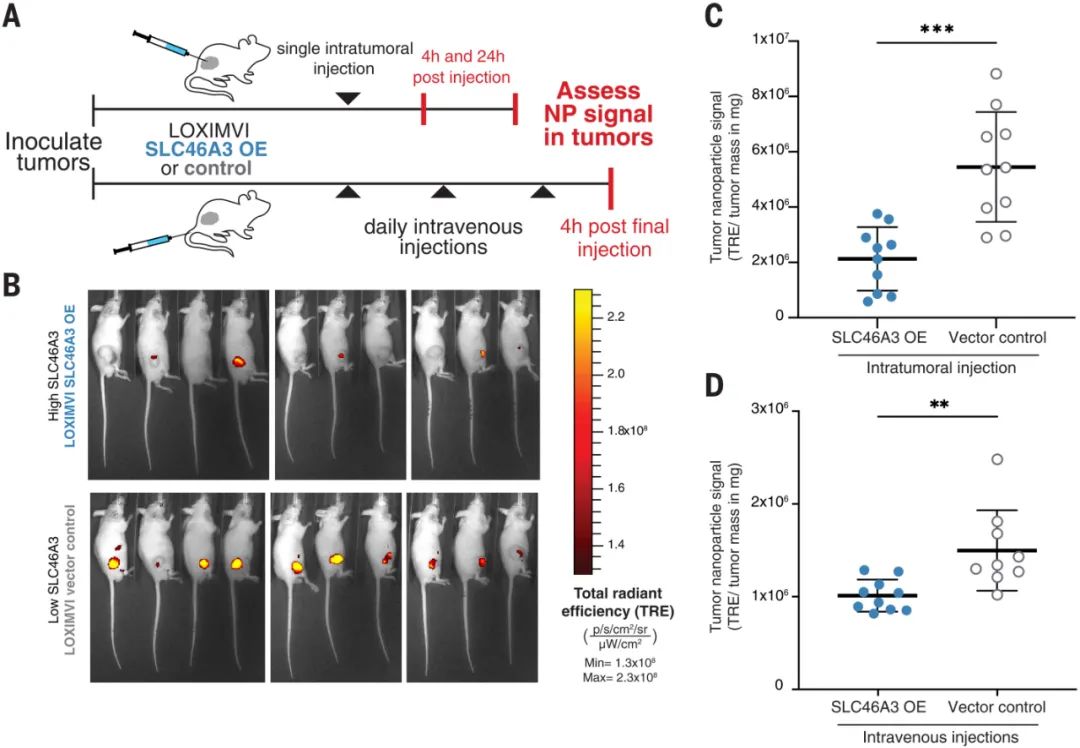
研究人员还使用nanoPRISM 来检测具有最常应用于纳米医学的成分的NPs:由脂质双层和固体脂质制成的球形脂质体和由无序球形脂质或或聚合物聚集体组成的聚合物NPs。他们还检查了带有或不带有聚乙二醇 (PEG) 修饰的NPs,PEG常用于减少全身摄取和改善循环时间。研究人员发现 NPs核心成分是细胞摄取的主要决定因素(下图F和G)。这一出人意料的发现颠覆了多年来在调节NP表面化学以改变蛋白质吸附模式和随后的细胞粘附方面的工作。尽管检测的是NPs的表面化学与细胞作用,但研究人员的发现支持早期研究表明,由核心成分决定的NP刚度和可变形性是摄取过程的更强调节剂。图|同时评估数百个癌细胞系中的 NP 细胞相互作用通过将这些发现与癌细胞系百科全书相结合,进一步说明了nanoPRISM方法的魔力,该百科全书量化了常见癌细胞系的突变基因组特征。研究人员确定了与NP内化最相关的基因组特征和信号网络。许多结果并不令人惊讶,例如溶质载体 (SLC) 转运蛋白或三磷酸腺苷 (ATP) 结合盒 (ABC) 家族的参与,这些家族以前与NPs细胞进入和转运有关。nanoPRISM 筛选还突出了与有助于NPs细胞进入过程的质膜和细胞外基质相关的基因网络。然而,nanoPRISM 方法也揭示了一个未被研究的基因(SLC46A3)的参与,该基因与NP内化无关。该基因编码一种与脂质分解代谢相关的溶酶体跨膜蛋白,影响ADC的溶酶体运输。SLC46A3 的表达负调控脂质体和固体脂质NPs细胞摄取,而缺乏脂质的聚合物 NPs不受影响。即使在NPs表面涂有非脂质分子时,也证明了SLC46A3与基于脂质的 NPs的关联。这进一步表明了NPs核心成分在细胞摄取过程中的重要性,并且还表明细胞可以通过表面涂层检测核心成分,表面涂层更类似于多孔网而不是壁。这可能对预测核酸疫苗和使用脂质载体的疗法(如 COVID-19 mRNA 疫苗)的功效具有重要意义。例如,可以实施 SLC46A3 生物标志物测试,以确定最有可能对基于脂质的纳米疗法产生反应的患者。图|高通量成像细胞术证实了 NP 内化并揭示了 SLC46A3 依赖性细胞内运输的变化nanoPRISM 筛选的结果也在动物模型中得到证实,表明该技术可用于确定最有希望的下游分析配方,从而减少临床前动物试验的需求。这种高通量方法对于癌症纳米药物的快速发展至关重要,因为美国和欧洲监管机构尚未根据与现有产品的相似性制定纳米药物批准标准。鉴于药物开发的时间很长,可能长达十年或更长,安全地加速这一过程的技术是可取的。图|LOXIMVI 肿瘤中 PEG 化脂质体 (LIPO-0.3% PEG*) 的保留和积累取决于 SLC46A3 的表达nanoPRISM方法代表了对NPs内化的不太严格和定性研究的重大进步,该研究是该领域早期的特征。研究单个细胞系中的一些NPs特性无法捕捉NPs细胞进入的复杂性。结合机器学习、迭代模拟和材料合成方法,nanoPRISM可以筛选针对特定细胞类型的纳米材料,类似于目前的肽生物筛选方法或通过指数富集(SELEX)方法发现适体的配体系统进化。虽然该研究仅检测了35种不同的纳米颗粒,但可以向库中添加额外的纳米材料,例如无机纳米颗粒(如金、二氧化硅和碳)和具有复杂几何形状的材料(如DNA折纸)。nanoPRISM 的一个限制是它专注于细胞进入,这是生物分布过程的最后一步。然而,很容易设想将这种方法扩展到细胞摄取之外,以研究 NP 材料特性与细胞粘附和运输中基因表达之间的关系。此外,使用该研究提供的模板,类似的方法可以与微流体、芯片上的器官或肿瘤类器官培养物相结合,以模拟其他传递障碍,如循环、外渗和组织扩散。因此,nanoPRISM 方法可以催化快速材料优化,加速纳米载体设计,并使癌症纳米医学的前景更接近现实。1. Massively parallel pooled screening reveals genomic determinants of nanoparticle delivery. Science 2022.DOI: 10.1126/science.abm5551https://www.science.org/doi/10.1126/science.abm5551
2. One step closer to cancer nanomedicine. Science 2022.
https://www.science.org/doi/10.1126/science.add3666

Paula T. Hammond, 麻省理工学院教授兼化学工程系主任。2013年当选美国艺术与科学学院院士,2016年当选美国国家医学院院士,2017年当选美国国家工程院院士,并在2019年当选美国国家科学院院士。她是入选所有三个国家科学院院士的仅有的 25 位杰出科学家之一。Hammond 教授发表了 320 多篇论文,并申请了 20 多项专利。她是 Layer Bio, Inc. 科学顾问委员会的联合创始人和成员,也是 Moderna Therapeutics 科学顾问委员会的成员。Hammond 教授课题组专注于利用静电和其他互补相互作用来生成具有高度可控结构的功能材料。她在纳米医学方面的研究包括开发新的生物材料,以使药物从具有时空控制的表面输送。她还研究了用于靶向纳米颗粒药物和基因传递的新型响应聚合物结构,并开发了用于电化学能源设备的自组装材料系统。