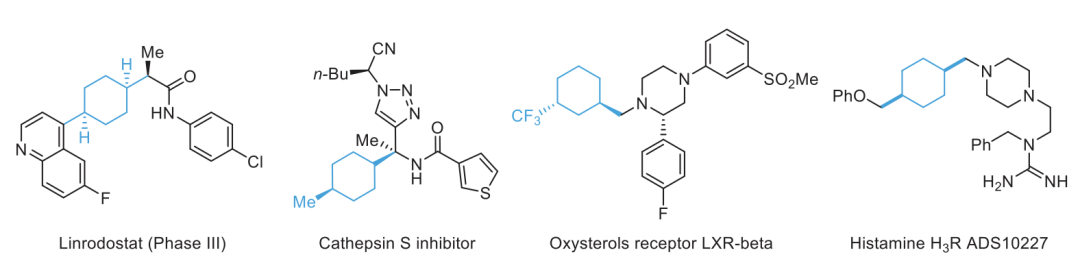
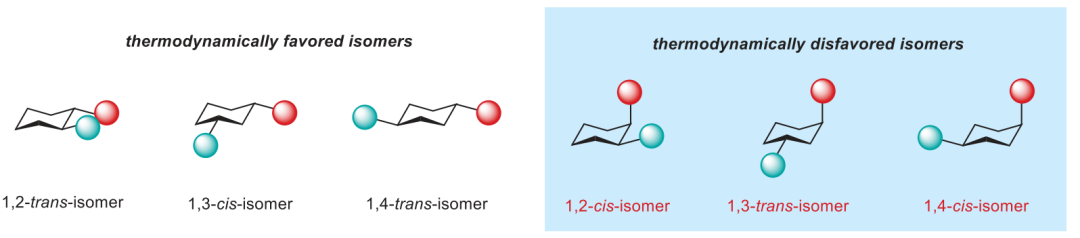
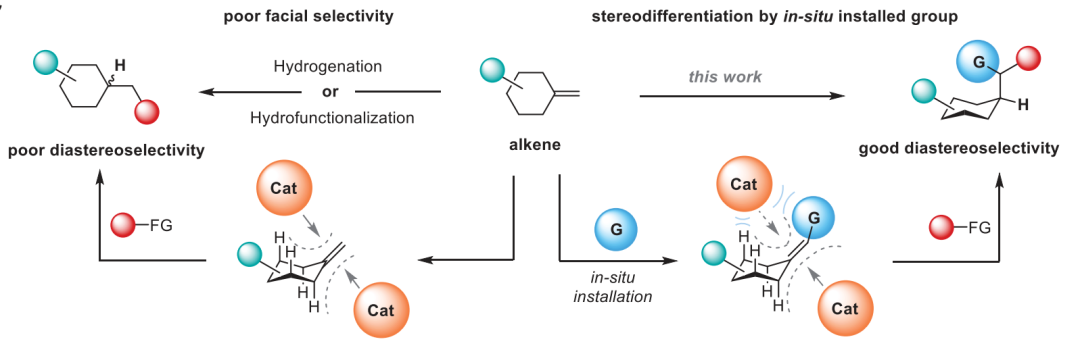
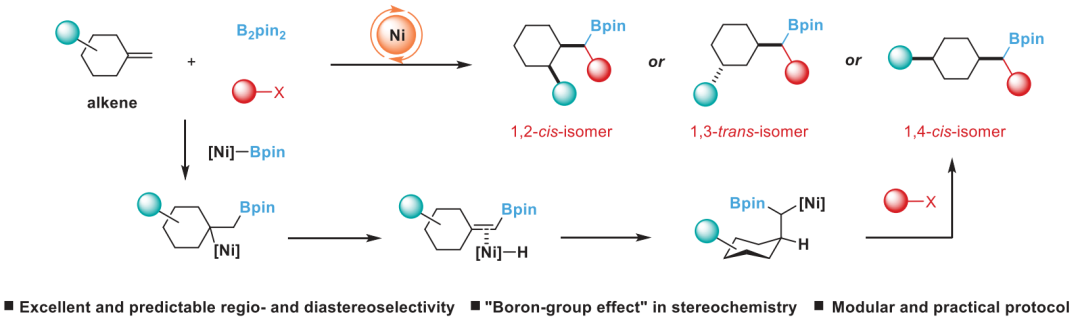
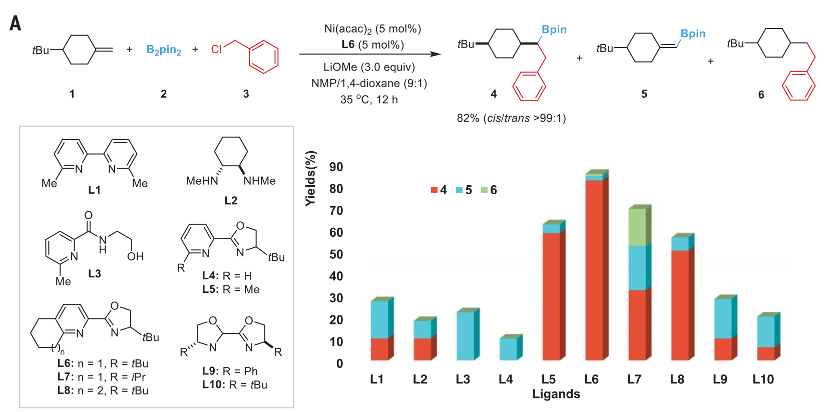
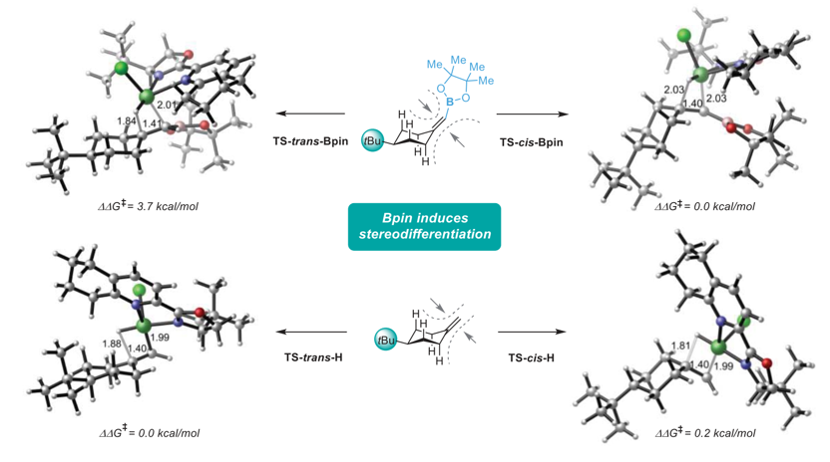
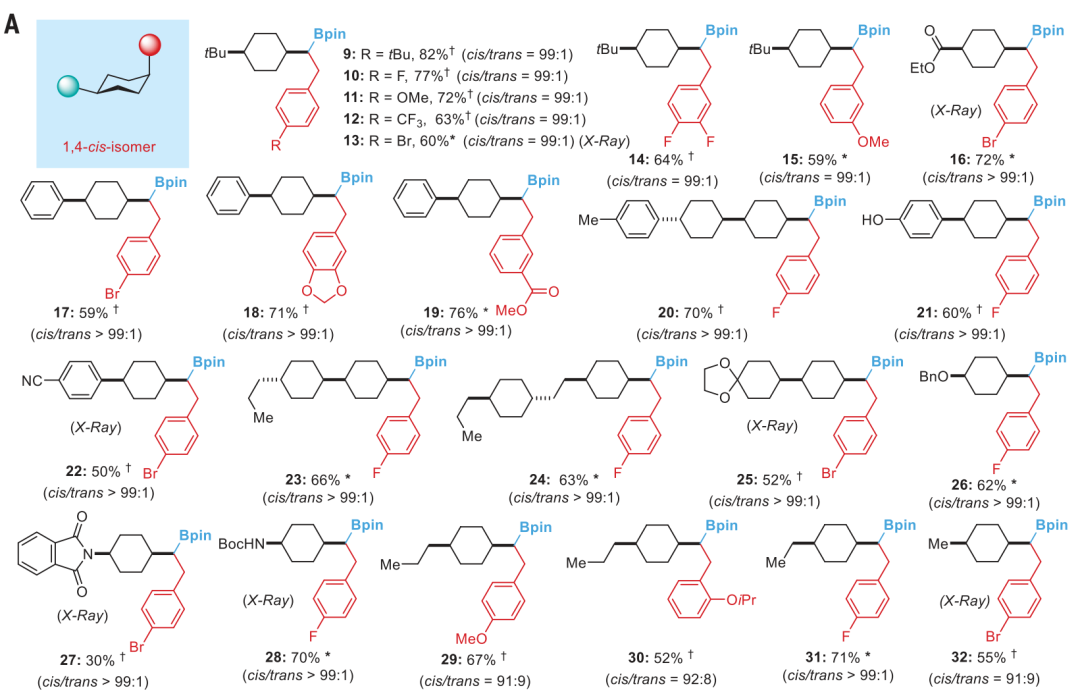
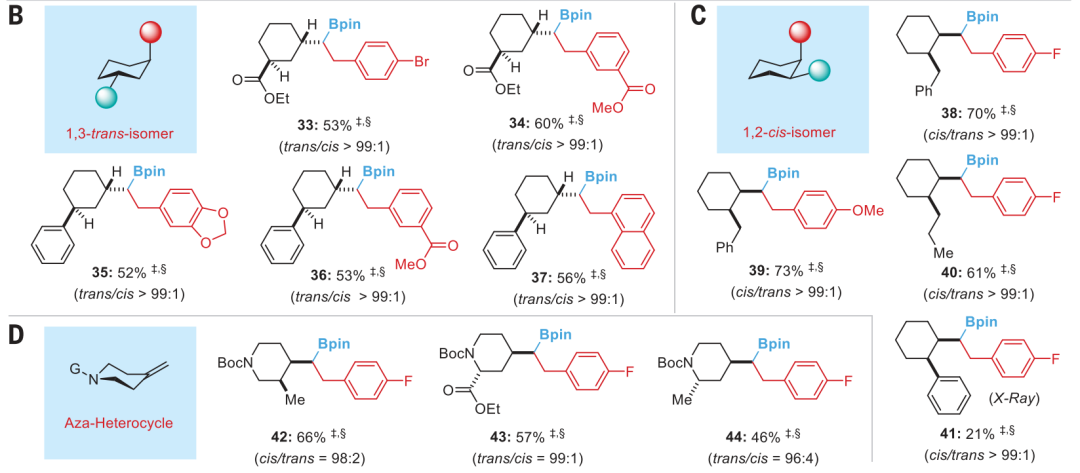
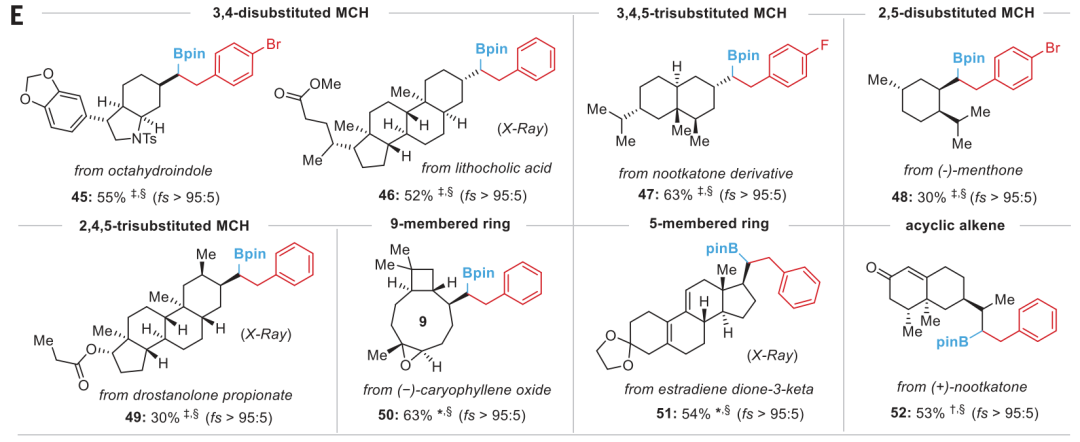
通讯作者:阴国印、Ignacio Funes-Ardoiz六元环己烷是重要的生物活性分子结构,目前人们发展了合成含取代基的环己烷,但是还没有特定对映体立体结构的含取代基环己烷的方法学。有鉴于此,武汉大学阴国印、西班牙里奥哈大学Ignacio Funes-Ardoiz等报道发展了一种普适性模块化方法学合成取代基修饰的立体结构环己烷,这种反应方法通过“链行走”催化机理在反应中对亚甲基环己烷中间体实现较好的动力学控制。通过反应机理研究,发现反应产物立体选择性是通过环己烷的邻位引入立体位阻硼酸酯官能团实现。该反应方法能够用于复杂结构生物活性分子进行后期官能团化修饰,反应产物与目前的交叉偶联反应方法学有显著区别。三维立体有机分子在生物活性分子中广泛应用,并且通过设计立体结构,显著改善分子的生物活性和性质,因此发展合成饱和环烷烃的方法学得到人们的广泛关注。其中邻位分别具有平面和垂直方向取代基的环己烷(1,2-顺式、1,3-反式、1,4-顺式)非常重要,是应用广泛的药物分子重要结构,比如三期抗癌药物linrodostat、氧化甾醇受体LXR-β、组胺H3R ADS10227。通常这种结构的环己烷能够呈现比热力学稳定结构更好的生物活性。传统方法对环己基取代的交叉偶联反应通常生成热力学稳定结构产物(1,2-反式、1,3-顺式、1,4-反式),无法根据动力学生成特定立体结构。通过三个取代基修饰的烯烃进行加氢、或者对1,1-双官能团取代烯烃进行氢官能团化,能够生成目标立体选择性产物。作者基于前期研究结果,发现金属氢化物试剂能够对含有取代基的环己烷进行立体选择性还原,同时根据烯烃的转移双官能团化官能团化方法,在此基础上设计发展将大体积官能团修饰在亚甲基环己烷的外环结构位点,从而生成三个官能团修饰的具有明确立体结构的环己烷。通过设计和反应条件优化、催化剂配体优化,通过Ni催化转移碳硼化反应,对亚甲基环己烷进行硼官能团原位转移,实现了立体选择性合成官能团修饰环己烷。该反应方法学中,硼酸酯官能团起到控制立体选择性、提供官能团位点,通过C-B官能团化进一步分子修饰的多种作用。反应以叔丁基亚甲基环己烷(1)、B2Pin2(2)、氯甲苯(3)作为反应物,Ni(acac)2作为镍金属盐,LiOMe添加剂,在NMP/二氧六环混合溶剂和35 ℃进行反应,对配体进行筛选,考察对立体选择性的影响。发现使用PyrOx (L6)与Ni(acac)2配合作为预催化剂实现了较好的立体选择性,反应产物中以>99:1的选择性生成1,4-顺式立体结构产物。作者发现,当反应物为HBPin替换B2Pin2,反应产率显著降低,维持对映选择性(83:1),但是立体选择性显著降低(顺式/反式=5:1)。因此,作者认为这个现象是因为催化剂与HBPin预活化过程中生成Ni-H中间体导致,这同时说明BPin结构在控制立体选择性过程的重要作用。进一步的,作者通过DFT计算模拟,验证了BPin对于这种非常有趣的立体选择性的控制能力。作者通过DFT计算对Ni-H转移插入步骤进行模拟,发现通过PyrOx配体与硼酸酯官能团,反应通过顺式转移插入的能垒比反式转移插入能垒低3.7 kcal/mol。4-取代亚甲基环己烷的兼容性。通过反应物兼容性拓展,结果显示反应对多种取代基(包括烷基、酯基、芳基;(9-25, 29-31)杂原子(26-28))兼容,而且反应对体积较小的甲基(32)同样能够实现立体选择性。反应生成的环己烷结构产物(20, 23-25)能够用于液晶材料。3-取代亚甲基环己烷、2-取代亚甲基环己烷都表现兼容性。此外,除了六元环环己烷,该反应对七元环哌啶(42-44)同样具有比较好的兼容性。由于该反应条件温和,因此对广泛的官能团兼容,芳基溴化物(13)、酯基(16-19)、酚基(21)、氰基(22)、缩酮(25)、苄酯(26)、亚胺(27)、酰胺(28)。为了确定产物结构,作者通过单晶X射线衍射方法对多种产物分子的立体选择性进行确认(13, 16, 22, 25, 27, 28, 32, 41)。复杂有机分子。作者发现,该反应对一系列复杂有机分子兼容,包括八氢吲哚(45)、石胆酸(46)、诺卡酮(47)、䓝酮(48)、丙酸屈烷酮(49)都能够以立体选择性方式得到目标产物立体结构。此外,含九元环的丁香烯氧化物(50)、含五元环的雌二烯二酮-3-酮(51)都以较好的立体选择性生成特定目标产物。此外,作者还对反应安装的硼酸酯进行C-B官能团化,验证了该反应对产物衍生化的优势。作者还将开发的反应方法学与现有交叉偶联反应方法学进行考察,验证了反应方法学的优势。Yangyang Li, Yuqiang Li, Hongjin Shi, Hong Wei, Haoyang Li, Ignacio Funes-Ardoiz*, Guoyin Yin*, Modular access to substituted cyclohexanes with kinetic stereocontrol, Science, 2022, 376 (6594), 749-753DOI: 10.1126/science.abn9124https://www.science.org/doi/10.1126/science.abn9124