先前研究

此外,今年早些,麻省理工学院K. Dane Wittrup和Darrell J. Irvine等研究人员使用美国FDA批准的疫苗佐剂氢氧化铝 (明矾) 递送工程细胞因子,实现将IL-12刺激分子直接输送到肿瘤中,从而避免免疫刺激药物在全身使用时可能产生的毒性作用。成果同样发表在Nature Biomedical Engineering上。(细胞因子,连发2篇Nature Biomedical Engineering!)

近日,来自芝加哥大学Jeffrey A. Hubbell院士和Jun Ishihara等人再次发力,报道了一种蛋白质工程方法,作为一种解决IL-12毒性和重构冷TME的策略。研究人员通过一个融合的受体结构域屏蔽IL-12的受体结合位点,该结构域通过一个肿瘤蛋白酶可切割的连接子连接,从而使其活性在TME蛋白水解裂解时选择性地恢复。在皮下腺癌和原位黑素瘤小鼠模型中,静脉注射修饰后的IL-12不会引起系统性IL-12信号转导并消除系统性免疫相关不良事件,通过重塑免疫抑制微环境导致了有效的治疗效果,并使冷肿瘤对免疫检查点抑制有反应。

背景介绍:
免疫检查点抑制(CPI)疗法,如使用抗程序性死亡1 (αPD-1)抗体的疗法,在某些癌症类型的治疗中取得了巨大成功;然而,越来越多的证据表明,由于缺乏充分激活的CD8+ T细胞,这些疗法在免疫“冷”肿瘤中基本上无效。免疫抑制肿瘤微环境的重构可以通过触发一系列炎症反应来克服CD8+ T细胞的排斥,促进抗肿瘤CD8+ T细胞的浸润和活化。
IL-12是一种有吸引力的细胞因子,可以刺激先天和适应性免疫系统,并能够激活抗原提呈细胞(APCs)。多年来,人们对IL-12的临床转化进行了无数的尝试,但还没有IL-12产品在临床中获得批准。因此,解决IL -12诱导的免疫相关的不良事件的挑战对于将这种强大的抗肿瘤细胞因子转化到临床是至关重要的。
研究思路:
1、体外激活掩蔽修饰的IL-12可完全恢复IL-12的生物活性:
小鼠IL-12受体β1的前两个纤维连接蛋白III型结构域与IL-12融合将使其失活。然后,研究人员表达了几种具有不同连接子底物的IL-12变体,这些底物可以被不同的肿瘤蛋白酶切割。再用重组基质金属蛋白酶-2(MMP2)、MMP9或尿激酶纤溶酶原激活剂处理修饰的IL-12分子。工程化IL-12的蛋白水解后体外激活完全恢复了活性。
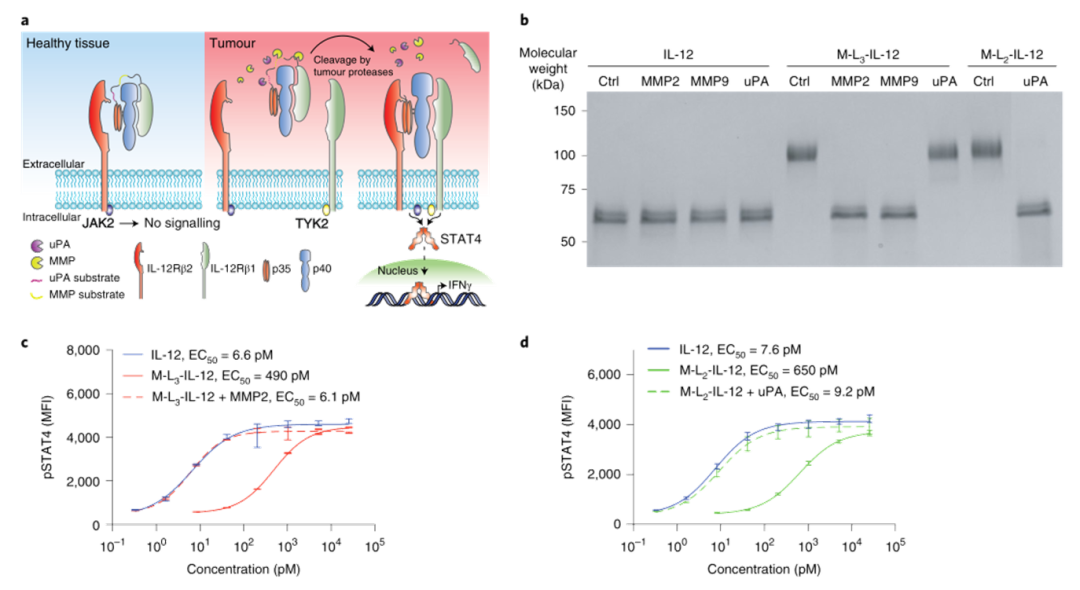
图|经重组蛋白酶处理后,掩蔽的IL-12完全恢复活性
2、修饰后的IL-12在同基因模型中保留抗肿瘤活性,并引起TME的免疫重塑:
然后,研究人员在B16F10小鼠黑色素瘤模型中检测三种IL-12变体诱导的抗肿瘤效果,以确定最佳连接物。结果表明,M-L6-IL-12的连接子的酶敏感性最好。且M-L6-IL-12与荷瘤小鼠的血清一起孵育至少6小时,在体外保持稳定。为了证明在体内发生了切割,研究人员用M-L6-IL-12或M-LNC-IL-12治疗B16F10荷黑色素瘤小鼠,这些数据表明,M-L6-IL-12在其他环境中保持完整,但在肿瘤中被选择性激活。然后,研究人员在B16F10模型中使用M-L6-IL-12进行剂量递增研究,M-L6-IL-12显示出剂量依赖性的抗肿瘤效果。为了评估M-L6-IL-12在CPI无反应模型中的抗肿瘤效果,研究人员对原位EMT6三阴性乳腺肿瘤的小鼠进行治疗,用M-L6-IL-12治疗可显著延长存活时间。并且与单用M-L6-IL-12治疗相比,在M-L6-IL-12中添加αPD-1可显著延长生存期。
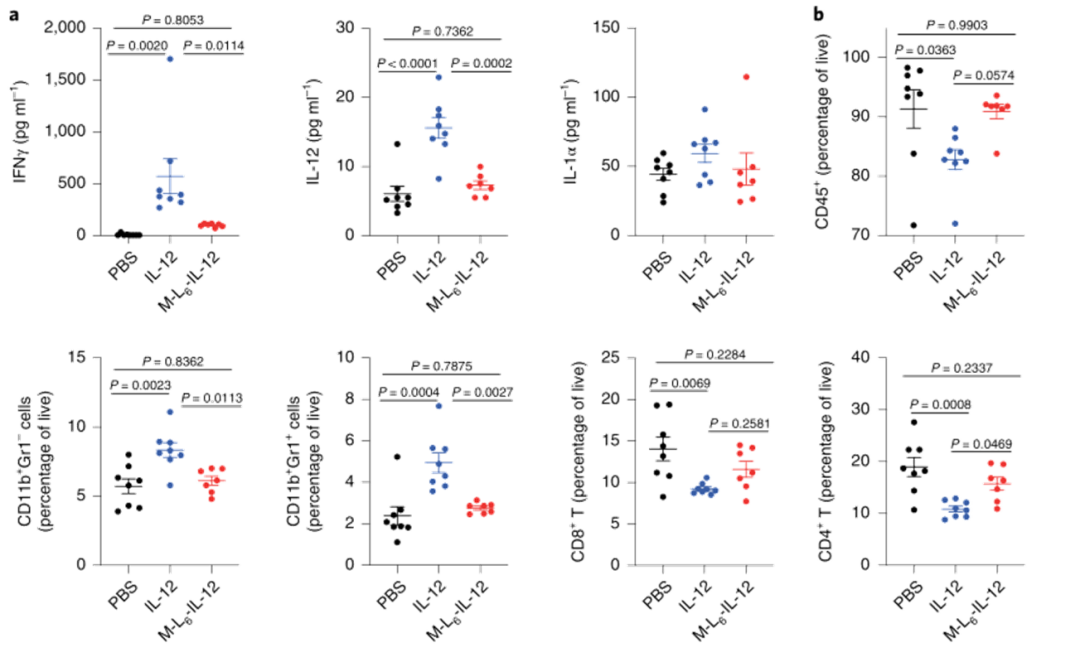
IFNɣ是IL-12抗肿瘤活性的直接下游分子和主要介质,在两个治疗组的TME中同样上调。TNFα、GM-CSF、CXCL9、CXCL10、CCL5和CCL4的表达升高,这些结果表明,修饰的IL-12可以有效激活II型IFN途径,从而导致多种炎症分子的分泌,导致显著的CD8+T浸润。
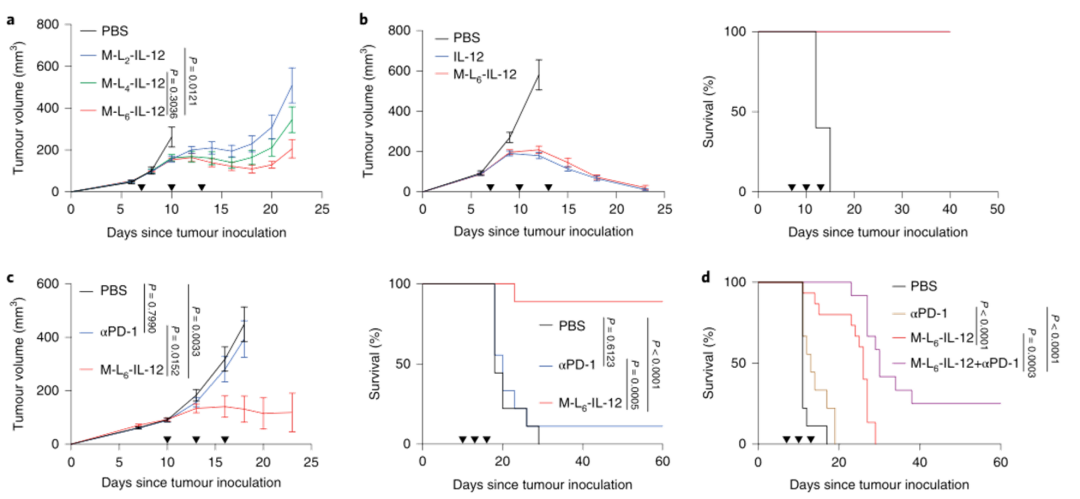
图|修饰的IL-12诱导强烈的抗肿瘤反应,并加强CPI治疗
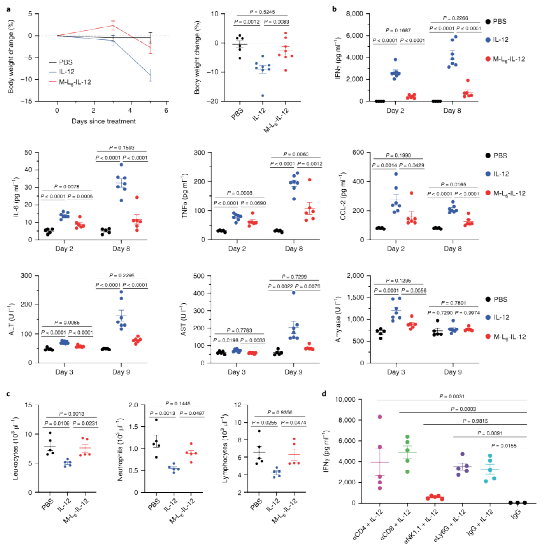
图|修饰的IL-12疗法可引起广泛的炎症反应,并导致黑色素瘤中的免疫细胞浸润
3、用蛋白酶敏感的IL-12治疗可最大限度地减少系统性IRAE:
研究人员接下来研究了掩蔽修饰后IL-12体外生物活性的降低是否会导致系统性IRAE的减少。与生理盐水处理的小鼠相比,未修饰的IL-12诱导显著的体重减轻,而修饰后IL-12处理的小鼠在研究过程中保持其体重。在临床试验中,修饰后IL-12可显著降低血浆IFNɣ、IL-6、TNFα和CCL-2浓度。与未经修饰的IL-12治疗的小鼠相比,经M-L6-IL-12治疗的MC38荷瘤小鼠的肝、肾和胰腺损伤标记物减少,总之,这些数据表明,这种修饰方法显著降低了健康和荷瘤小鼠中IL-12诱导的IRAE,降低至盐水注射水平。
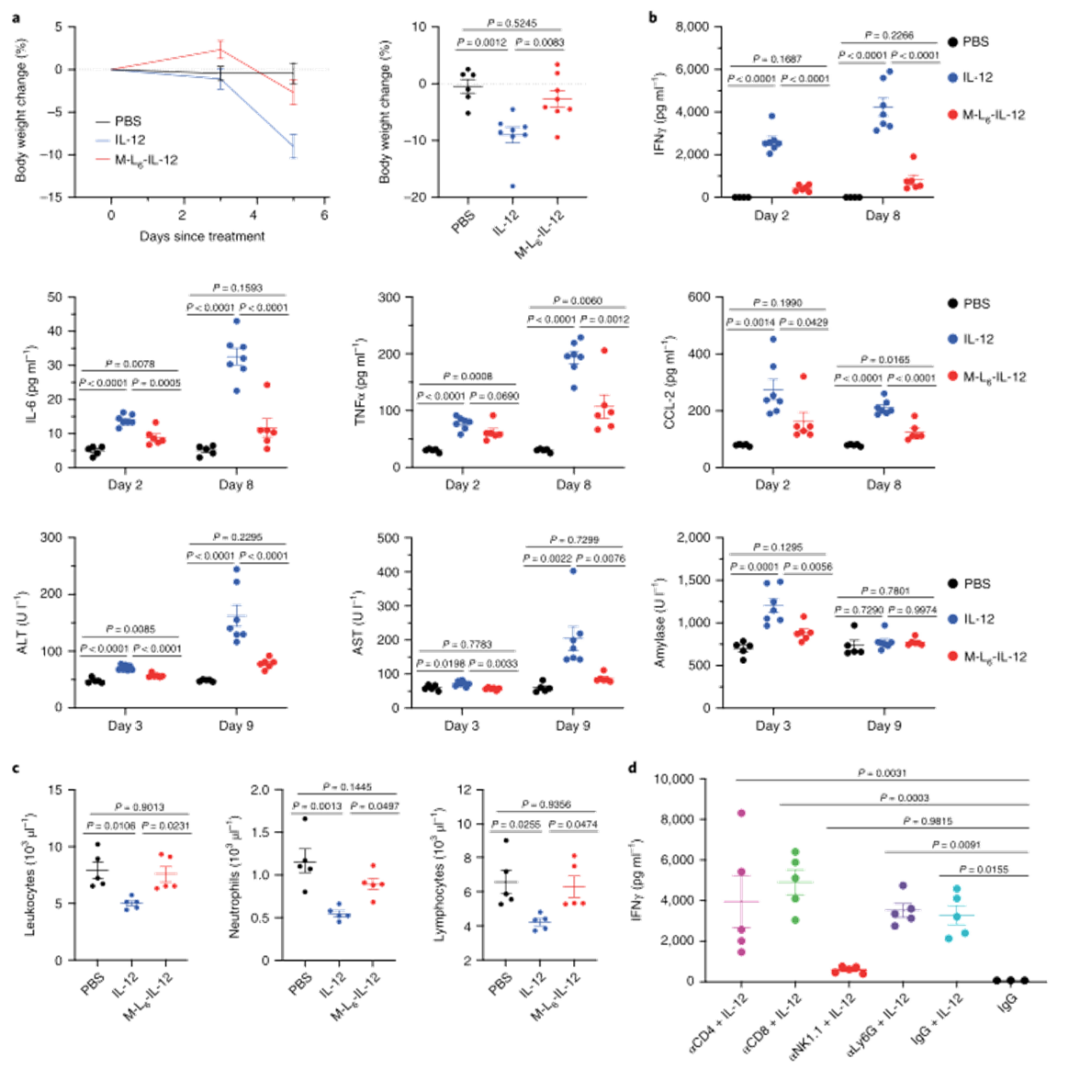
图|修饰的IL-12可消除健康动物中与IL-12治疗相关的副作用
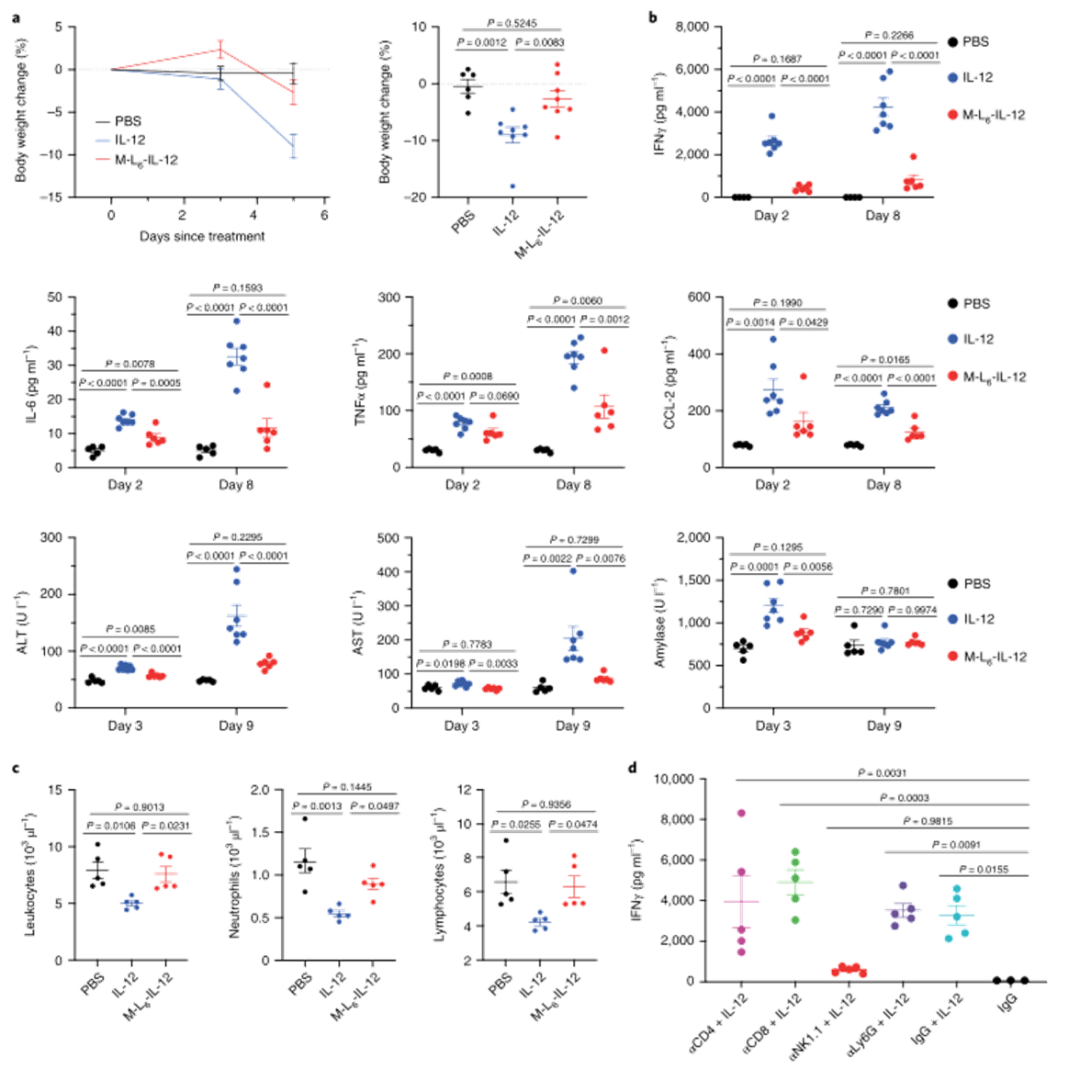
图|用修饰后的IL-12治疗黑色素瘤小鼠不会产生系统性IRAE
4、人类肿瘤的体外切割激活了修饰的IL-12:
研究人员试图研究人类肿瘤中修饰的IL-12相对于健康组织或血清的稳定性。数据表明,M-L6-IL-12在体外可被被人黑色素瘤和乳腺癌切割,同时在匹配的血清基本保持完整。为了证明该方法也可以应用于工程人类IL-12,研究人员生成了人类修饰性IL-12,与未修饰IL-12相比,修饰的的IL-12显示出约35倍的生物活性降低,证实了人类IL-12Rb1作为掩蔽结构域的适用性。
图|人类肿瘤对修饰物的切割和人类修饰性IL-12的产生
小结:
最近旨在降低IL-12治疗后IRAE发病率的工程策略依赖于将IL-12靶向肿瘤基质,尽管临床前和临床结果令人鼓舞,但给药途径、IL-12暴露于循环淋巴细胞和随后的毒性可能会限制这种细胞因子的广泛使用。
掩蔽修饰后的IL-12产生的全身副作用最小,可以选择性地在肿瘤内引发严重炎症。结果显示,即使在反复服用M-L6-IL-12后,掩蔽修饰的方法也能消除IRAE。与血液中极少的IFNɣ相反,掩蔽修饰的IL-12诱导肿瘤内IFNɣ的强烈表达。IFNɣ诱导趋化因子表达,这些趋化因子可能诱导效应CD8+T细胞浸润。本研究还检测了EMT6和B16F10黑色素瘤,这是一种免疫寒冷、CPI无反应的肿瘤。研究数据清楚地表明,掩蔽修饰的的IL-12重塑了免疫抑制性冷TME,并具有与CPI疗法协同作用的潜力。此外,由于IL-12Rβ1天然存在于体内,因此融合蛋白不太可能具有免疫原性,与其他可能的非内源性掩蔽结构域相比更具优势。
总的来说,该研究结果显示,全身性施用掩蔽修饰的IL-12可诱导有效的抗肿瘤作用,从而根除已建立的结肠肿瘤和免疫排斥的原位乳腺肿瘤;掩蔽结构域的融合消除了IL-12诱导的外周毒性。该研究还表明,离体患者肿瘤裂解物可有效激活掩蔽修饰的IL-12,强调了该方法对晚期肿瘤疾病患者的可操作性。
参考文献:
1. A. Mansurov, P. Hosseinchi, K. Chang, A.L. Lauterbach, L.T. Gray, A.T. Alpar, E. Budina, A.J. Slezak, S. Kang, S. Cao, A. Solanki, S. Gomes, J.M. Williford, M.A. Swartz, J.L. Mendoza, J. Ishihara, J.A. Hubbell, Masking the immunotoxicity of interleukin-12 by fusing it with a domain of its receptor via a tumour-protease-cleavable linker, Nat Biomed Eng, (2022).
https://www.nature.com/articles/s41551-022-00888-0
2. Mansurov, A., et al. Collagen-binding IL-12 enhances tumour inflammation and drives the complete remission of established immunologically cold mouse tumours. Nat Biomed Eng (2020)
https://doi.org/10.1038/s41551-020-0549-2
3. Agarwal,Y., Milling, L.E., Chang, J.Y.H. et al. Intratumourally injected alum-tetheredcytokines elicit potent and safer local and systemic anticancer immunity. NatBiomed Eng (2022).
https://doi.org/10.1038/s41551-021-00831-9











