荧光纳米技术彻底改变了我们可视化(活)细胞的能力,方法是将光学成像的极限扩展到个位数纳米分辨率,并通过对具有分子特异性的生物样品的内部纳米级结构和动力学进行微创观察。这些技术的核心是化学特异性荧光标记和荧光团的荧光(开)和非荧光(关)状态之间的内在控制。这种连续的开关转换是在分子级接近分离相邻荧光团的关键。可光活化或caged染料(其中的开关转换是不可逆的并且由光触发)使这些纳米技术非常强大,因为它们消除了对特定成像缓冲液和高强度紫外光的需求。这些要求在基于单分子的显微镜中普遍存在,例如光激活定位显微镜 (PALM) 或随机光学重建显微镜 (STORM),以驱动常用的荧光团(例如,花青)在非荧光和荧光状态之间,以及实现高密度单粒子跟踪。最近,光活化染料已被用于减少 DNA-PAINT 中的荧光背景,并增加可通过通道双工在受激发射损耗 (STED) 显微镜中同时成像的细胞结构的数量。
由于其光学和化学性质、细胞膜渗透性、光稳定性和亮度的显著可调性,罗丹明染料已成为荧光显微镜和纳米显微镜中应用最广泛的一些荧光团。特别是,硅罗丹明通常因其固有的红移发射、荧光行为和活细胞兼容性而受到青睐。然而,已报道的罗丹明封闭策略依赖于将染料“锁定”为非荧光形式,通过在氮原子上安装光不稳定保护基团(例如与硝基戊酰氧基羰基或亚硝基基团)或通过内酯环的合成转化成相应的环状α-重氮酮。前一种策略限制了可达到的取代模式,降低了水溶性,并在光活化时产生化学计量的潜在有毒副产物。同时,后一种策略受到不同的解封效率和伴随形成的非荧光副产物的影响,其丰度取决于介质和替代模式。
因此,在荧光显微镜和纳米显微镜应用中非常需要无caging基团、紧凑的可光活化和生物相容的荧光团,只要光活化快速、完全且不含副产物,就可以实现低分子量标记。
鉴于此,马克斯-普朗克研究所Stefan W. Hell、Alexey N. Butkevich等人描述了一种将 3,6-二氨基氧杂蒽酮(3,6-diaminoxanthones)转化为无caging基团的可光活化荧光团的通用方法。这些可光活化的氧杂蒽酮 (photoactivatable xanthones, PaX) 在光照射后迅速而干净地组装成高度荧光、光和化学稳定的派若宁染料。成果发表在Nature Chemistry上。

在寻找简约的可光活化荧光团时,研究人员推断采用光化学反应组装或“锁定”荧光团的概念,而不是“解锁”可光裂解的caging元件,将为caged罗丹明染料提供一种改进的替代品——一种类似于光致变色二芳基乙烯的策略。这些可光活化的PaX染料可以通过简单有效的三步合成路线从现成的起始材料制备,还与碳桥和硅桥接类似物兼容,从而产生一系列跨越大部分可见光谱的荧光团。
特别是,PaX 衍生的 Si-pyronine 染料显示出良好的活细胞相容性、对亲核试剂的弹性以及对橙色发射(TAMRA 样)荧光团前所未有的光稳定性。在一个或两个光子活化下,这些化合物迅速组装成高度光稳定的荧光吡喃染料。通过改变 PaX 染料的取代模式,可以调整光活化动力学以及光谱特性,从而实现多路复用伪彩色和传统的多色成像。
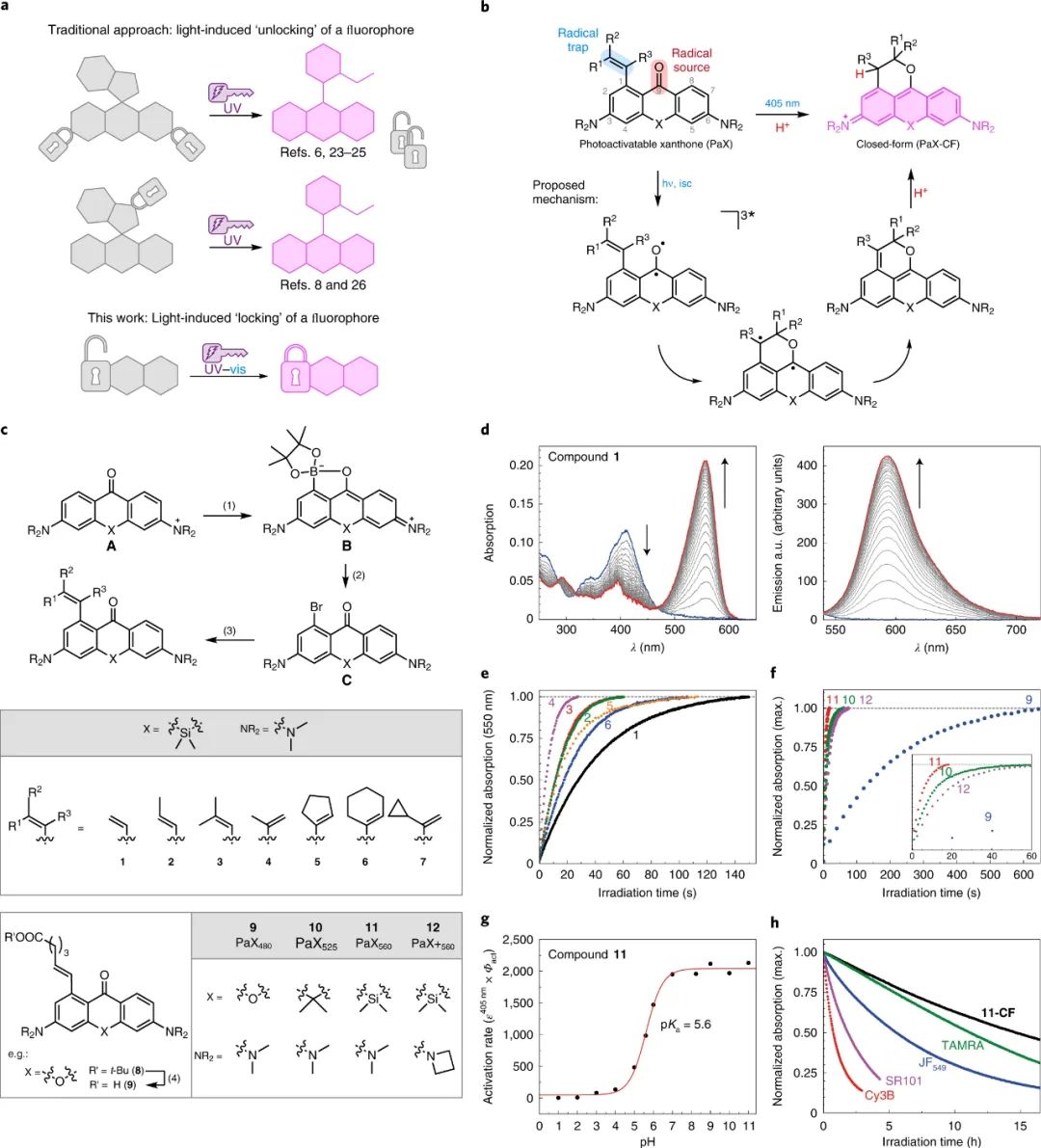
图|PaX 染料的设计、合成和表征
研究人员还强调 PaX 染料和标签在光学显微镜和纳米技术、固定细胞和活细胞中的实用性,包括 STED、光激活定位显微镜 (PALM) 和最小光子通量 (MINFLUX)。
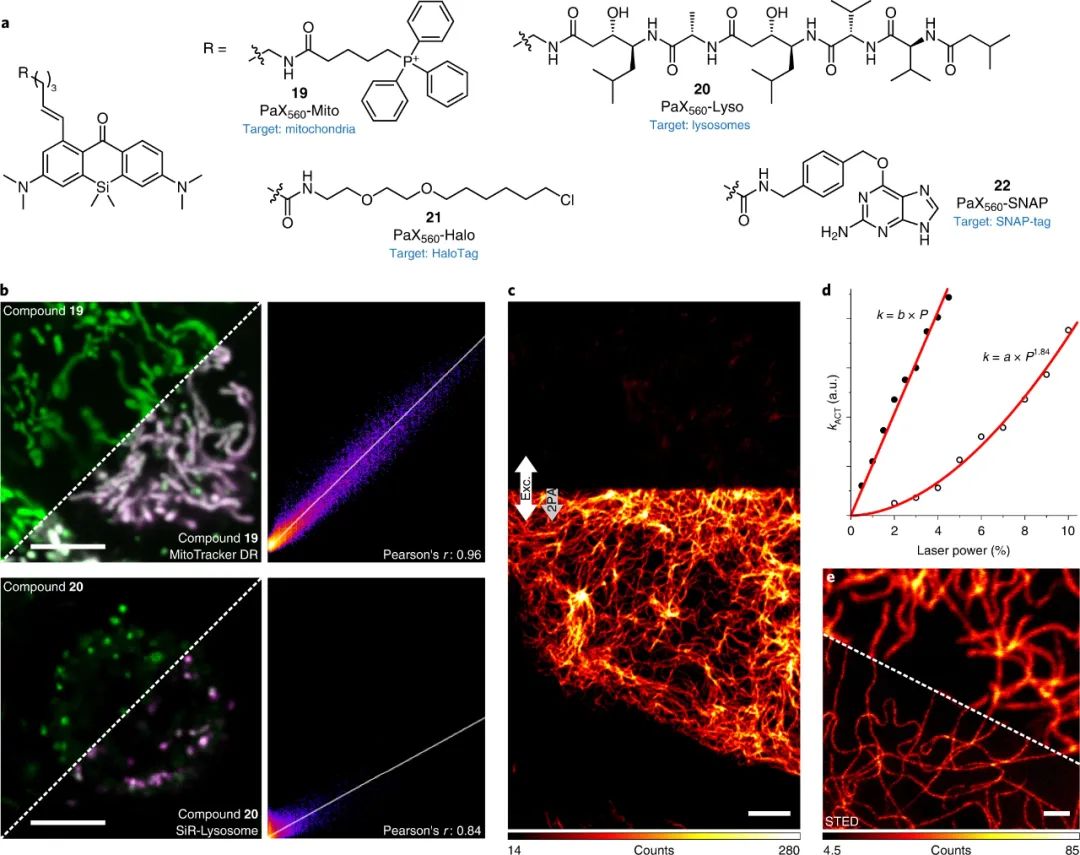
图|在活细胞中使用可光激活 PaX 标签进行成像
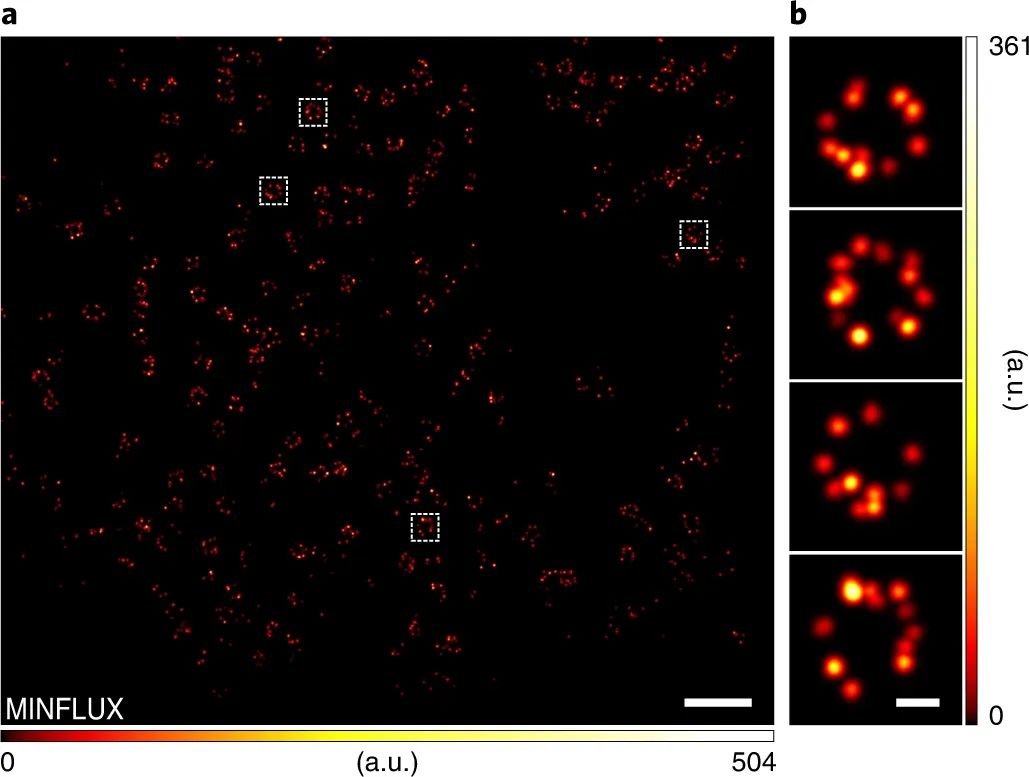
图|使用 PaX 560对 NPC 进行 MINFLUX 成像
综上所述,本文为无caging基团、明亮和活细胞兼容的光活化染料引入了通用设计策略,适用于广泛的光学显微镜和纳米技术,包括 PALM、STED 和 MINFLUX。预计该方法将进一步刺激用于生物成像和材料科学的光活化探针和传感器的发展。PaX 荧光团的进一步改进将有利于 MINFLUX 成像和最近提出的 MINSTED 纳米显微镜的应用。
参考文献:
Lincoln, R., Bossi, M.L., Remmel, M. et al. A general design of caging-group-free photoactivatable fluorophores for live-cell nanoscopy. Nat. Chem. (2022).
https://doi.org/10.1038/s41557-022-00995-0











