特别说明:本文由学研汇技术中心原创撰写,旨在分享相关科研知识。因学识有限,难免有所疏漏和错误,请读者批判性阅读,也恳请大方之家批评指正。
原创丨爱吃带鱼的小分子
编辑丨风云
氨作为肥料,潜在氢源等,被视为重要的化工材料,电化学锂介导的氮还原反应(Li-NRR)使NH3生产技术更简单、规模更灵活。本文研究了电解质在Li-NRR中的作用,提出了一种高效、稳定的氨生成工艺。实现150±20 nmol s-1 cm-2的稳定氨产率和~100%的电流-氨效率。
现实与挑战
目前,锂介导的高效电合成氨技术(下式)有望成为一种实现工业化的电化学合成氨技术,其利用锂金属在环境条件下自发还原N2的能力,产生氮化锂。Li3N与合适的质子载体(BH)反应生成氨并释放Li+以重新启动电催化循环。但现有技术在50 bar氮气压力下产率只有<10 nmol s-1 cm-2,法拉第效率(FE)也只有50-60%,在环境压力下性能更是降低5-6倍,有效时间范围限制为几个小时。Douglas R. MacFarlane课题组已经在2021的Science(Nitrogen reduction to ammonia at high efficiency and rates based on a phosphonium proton shuttle, 图一)上报道了使用磷盐作为质子载体提高了Li-NRR产率至53±1 nmol s-1 cm-2和FE至69±1%,显著改善了Li-NRR的性能。但目前仍缺乏对Li-NRR电极活性表面的组成和该表面附近的电解质结构(即固体电解质界面(SEI)层)研究,探索SEI层在控制Li介导的N2还原中的作用,特别是电解质浓度和阴离子的化学性质的影响。

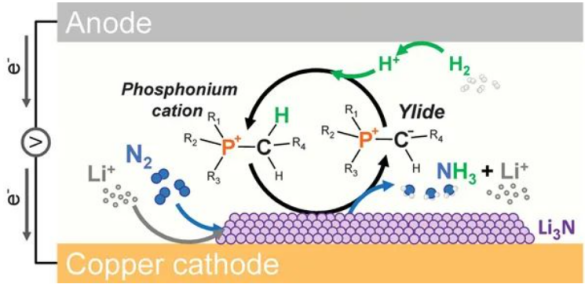
图一:磷盐作为质子载体的Li-NRR(DOI: 10.1126/science.abg2371)
解决方案
基于此,澳大利亚莫纳什大学Douglas R. MacFarlane教授和Alexandr N. Simonov教授联手使用四氢呋喃作为溶剂,乙醇作为质子载体,在15 bar N2压力下,研究镍线电极上的Li-NRR反应形成。其中相比于以前使用高氯酸盐四氟硼酸盐和三氟甲磺酸盐电解质(不利于电化学锂循环)研究Li-NRR,研究使用LiNTf2(双(三氟甲基磺酰基)亚胺锂)电解质(锂还原条件下是稳定的,并支持高速率的Li0电沉积。结果发现在电极-电解质界面区域中的致密离子分层实现了150±20 nmol s-1 cm-2的稳定氨产率和~100%的电流-氨效率的Li-NRR,且在电极表面形成的离子集合体抑制电解质分解并支持稳定的N2还原。论文以《Electroreduction of nitrogen at almost 100% current-to-ammonia efficiency》题发表在Nature上。

电解质浓度和阴离子特性影响
使用0.15 cm2电极进行的动电位(循环伏安)和恒电位(计时电流)测量,研究表明:LiNTf2浓度对电位低于0 V时的电还原速率有显着影响(图2a-b),且电流密度随盐浓度增大而增大,1.5 M LiNTf2为最大阴极电流,在更高浓度下则下降,这是三个因素相互作用的结果:(i)可用于还原的Li+的量,(ii)离子电导率(σ)和(iii)溶液的动态粘度,它们共同决定了Li+、乙醇和N2的传输速率。与还原电荷相比,N2和乙醇的存在导致了对锂循环化学可逆性的抑制(图1a正扫描部分中较低的氧化电荷)。此外,当电位固定在-0.55 V时,无论LiNTf2浓度如何,6 h内流过系统的电流是稳定的(图2b)。将LiNTf2浓度从0.1增加到0.5 M对10-20%范围内的FE没有显着影响,但随着电解质浓度的增加提高氨产率也随之增加。在1 M时,氨的生成量约为160 nmol s-1 cm-2,FE提高了约45%。这主要是由于可用于还原的Li+量的增加和σ的显着增加。而继续增加电解质浓度则会进一步增大产率,在1.5和2 M LiNTf2实现了240±20和230±20 nmol s-1 cm-2的NH3产率。在更粘稠的2.5和3 M LiNTf2电解质种,质量传输成为产率限制因素(图2c)。更显着的是电解质浓度对FE的影响,在大于2 M时,FE达到了90%。
为了证明NTf2-阴离子的独特作用,研究了LiOTf、LiClO4和LiBF4以及比NTf2-的更小酰亚胺类似物FSI-等电解质。在2 M溶液的电导率为:OTf- < ClO4- < BF4- < NTf2- < FSI-。尽管2 M LiNTf2的结果明显突出(图2d),但氨产率也遵循相同的趋势。此外,1 M LiBF4+1 M LiNTf2组合氨产率比2 M LiNTf2甚至1 M LiNTf2少得多(图 1d)。因此,尽管较高的σ有利于Li-NRR速率,但基于NTf2-的电解质明显从其他阴离子观察到的电导率趋势中脱颖而出。最重要的是:两个酰亚胺阴离子提供的Li-NRR率>200 nmol s-1 cm-2(图2d),且性能很大程度上取决于电极的化学性质,其中镍是最佳的。总之,这些发现确定了电解质-电极界面的化学性质在Li-NRR中的关键作用。
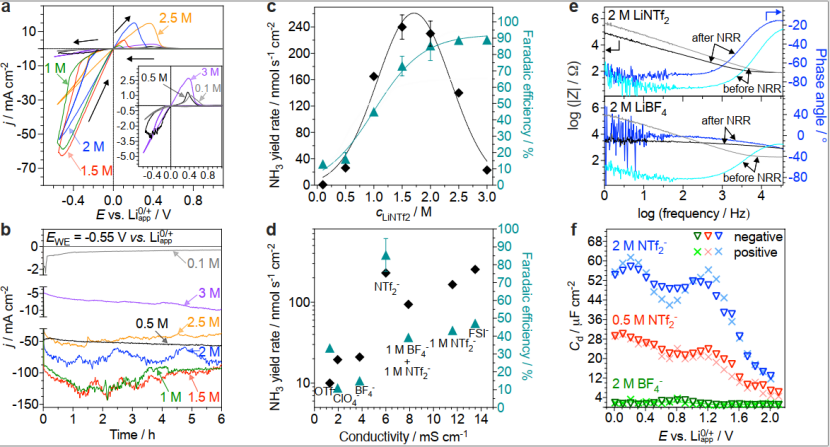
图二:Li介导的NRR中的电解质效应
电极-电解质界面
使用2 M LiNTf2逐渐降低至-0.80 V的负恒定电位增加了还原电流(图3a)和氨产率(图2b)。在-0.5 - -0.8 V范围内FE>80%,但在更多负电位时下降。在-0.7、-0.8和-1.0 V下运行数小时后,性能显着下降(图3a),使用的电位越负,这种退化发生得越早。在不同电位下测试后工作电极的外观也有显着差异(图3c-f)。与-0.55 V反应后视觉上干净的电极相比,-1 V下的实验在镍线周围产生了总沉积物。通过XRD分析揭示了一组可能与锂胺、氧化物、硫化物和氟化物相关的峰,后两个是NTf2分解的产物。这些化合物的不受控制的积累是Li-NRR逐渐减速的原因(图3a)。因此,系统的持续稳定运行需要保持比-0.8 V更正的电位。在-0.55 V测试后对电极进行SEM检查显示表面有轻微的修饰,带有微弱的涂层(图3d),更灵敏的XPS表明存在完整的LiNTf2用LiF和还原的S-O物种作为唯一的电化学产生的产物(图3e)。XPS还检测到明确定义的镍金属信号表明电化学生成的层非常薄(<10 nm)和/或不连续。
研究发现高浓度LiNTf2电解质可以用强配位的Li+和NTf2-离子层取代带负电荷的电极表面的溶剂分子,这种离子组件对于稳定的Li0/+和Na0/+循环至关重要,与BF4-相比,NTf2-电解质提供的电容高一个数量级(图2f),这表明Li+与基于酰亚胺的阴离子在界面附近形成了更紧凑的离子组装层,微分电容随着电荷层之间距离的倒数而增加。LiNTf2浓度从0.5增加到2 M还增加了电极-电解质界面的电容(图2f),高盐浓度将四氢呋喃溶剂排除在界面之外,Li+在最内层中占主导地位。因此,Li+的配位要通过与NTf2-的紧密螯合型结合从而支持紧密离子组装体的形成。另外,Li+迁移数(tLi+)随四氢呋喃中的LiNTf2浓度显着增加,高tLi+有利于稳定高效的Li0/+循环。因此,用于NRR的高浓度LiNTf2电解质的优势在于它们能够在电极-电解质界面形成致密的离子组装体并提供高的Li+迁移数。这些因素抑制了溶剂和电解质的还原降解,超出了最初形成的LiF和S-O物质薄层,同时促进了整个N2还原过程。
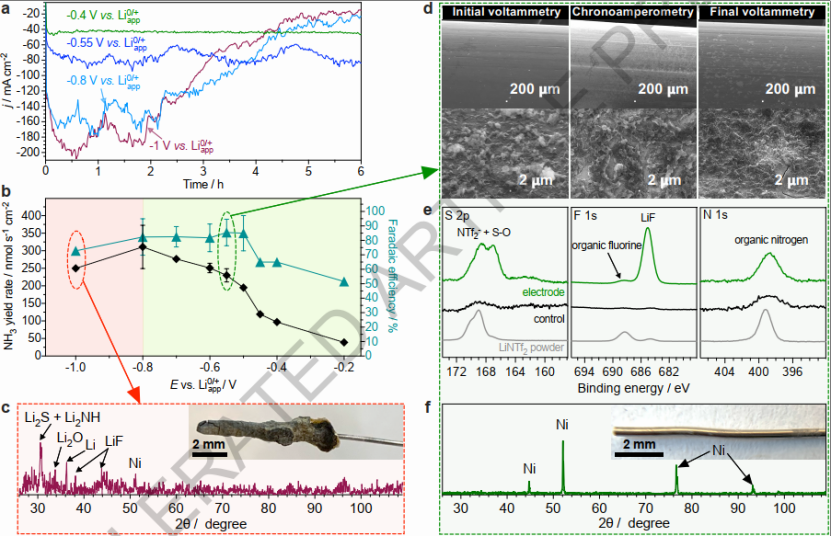
图三:2 M LiNTf2介导的N2电还原过程中电位对电极表面组成的影响。
提高法拉第的效率
为了进一步了解由2 M LiNTf2介导的Li-NRR的动力学,使用0.15 cm2电极在-0.55 V下研究了NH3生成的时间依赖性。电流(图4a)的行为可变但非常可重复,且氨在整个12 h测试中稳定积累(图4b)。3小时的法拉第效率为65±8%,6、9和12 h的实验产生的氨的FE逐渐增加,分别为85±9、89±9和91±7%。减去3 h测试的电荷和NH3产率数据后6-12 h实验的FE计算得出的值非常接近100%(图4b)。基本上所有在3 h后(非生产性区间)通过系统的电荷都与N2向NH3的转化有关,而前3 h内的过量电荷可能与电解质溶液分解有关。这种非生产性电量消耗的起源于电极底部形成的含有LiF、多硫化物和Li3N的沉积物,这种多组分沉积物的形成得到了N2和通过电极上的薄液相弯月面电化学产生的Li0之间反应的促进动力学支持(图4c)。该区域的乙醇质子载体被迅速消耗,导致高表面积Li3N的不可控积累,进一步促进电解质溶液的分解。
为了确定这些非生产性过程对低于100% FE的影响,对不存在弯液面的孤立镍线进行了实验(图5a-c)。该策略在24 h测试中实现了98±2%FE,平均氨产率为530±20 nmol s-1 cm-2。96 h连续(图5a)实验实现了在 99±2% FE下产生氨。这表明Li-NRR的阴极必须完全充满电解质溶液才能实现~100%的选择性NH3电合成。在使用隔离线电极运行的最初24 h期间,电流密度的行为是动态的,30 h后电流密度稳定在36±12 mA cm-2(图5b),对应的Li-NRR以150±20 nmol s-1 cm-2氨产率。96 h实验中产生的氨量(3.9±0.1 mmol)比存在的乙醇量(1 mmol)高4倍,表明它不是完全牺牲的反应物,但也可以用作质子载体。最后,使用具有1.2 cm2有效几何表面积的较大工作电极进行实验作为可扩展性演示(图5d-f)。不同尺寸的电极观察到的电化学行为在性质上是相似的(图4a-d)。使用1.2 cm2电极依旧可以获得170-190 nmol s-1 cm-2 NH3产率以90% FE(图5e)。稍低FE的原因是质量传输条件的差异和由于需要更正的阳极电位(图5c-a)来保持显着更高的电流。
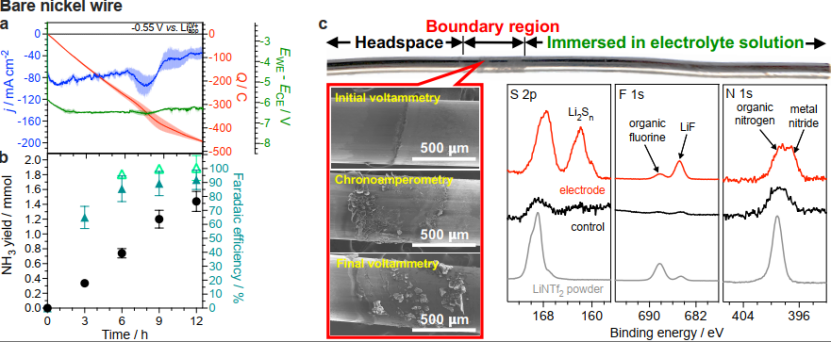
图四:裸镍线电极的NRR性能随时间变化
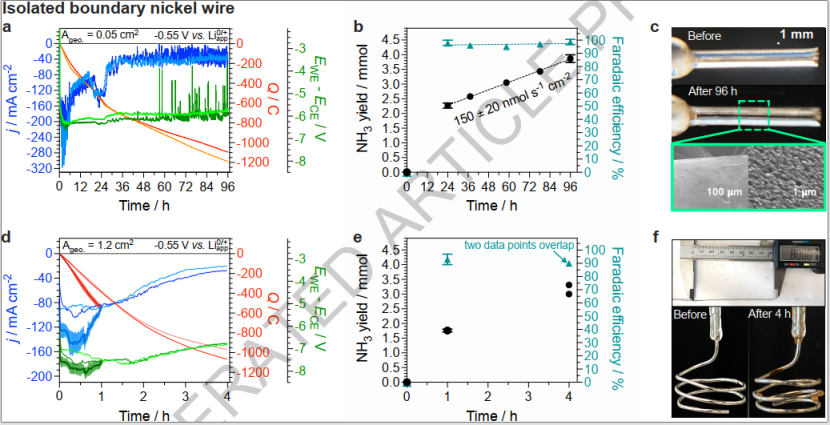
图五:使用隔离镍电极的长期NRR性能
展望
该研究目前仍集中在阴极的Li-NRR性能,证明由浓缩LiNTf2电解质介导的N2还原反应具有前所未有的氨产率和~100%的法拉第效率。但是朝着完整的氨电合成系统的进一步发展将需要研究适当的阳极反应,同时消除牺牲溶剂的氧化。一个可行的初始策略是将Li-NRR与H2氧化反应结合起来。更理想的阳极工艺是H2O氧化,但由于水对锂介导过程的潜在干扰,是一个更大的挑战。
编者的小絮叨
虽然Douglas R. MacFarlane院士在正文里仅展示了4张图,行文的思路也很简洁,但是附件材料提供了大量的数据和分析,特别是关于实验的细节,正如他在其2021年Nature catalyst(Challenges and prospects in the catalysis of electroreduction of nitrogen to ammonia)上综述所写需要一个更严格的评价流程和标准。对此小编深有体会,小编最近在整理关于电化学CO2转化的相关文献,但发现尚没有一个公认的评估标准建立(测试器件、工况条件等),电催化领域需要逐步发展如电池行业一样的标准测试手段才能推动行业的工业化和获得企业界的合作。小编一家之谈,敬请批评讨论!
——爱吃带鱼的小分子(A.M 00:33)
参考文献
Hoang-Long Du et al.Electroreduction of nitrogen at almost 100% current-to-ammonia efficiency. Nature, 2022.
DOI: 10.1038/s4158602205108y
https://www.nature.com/articles/s41586-022-05108-y











