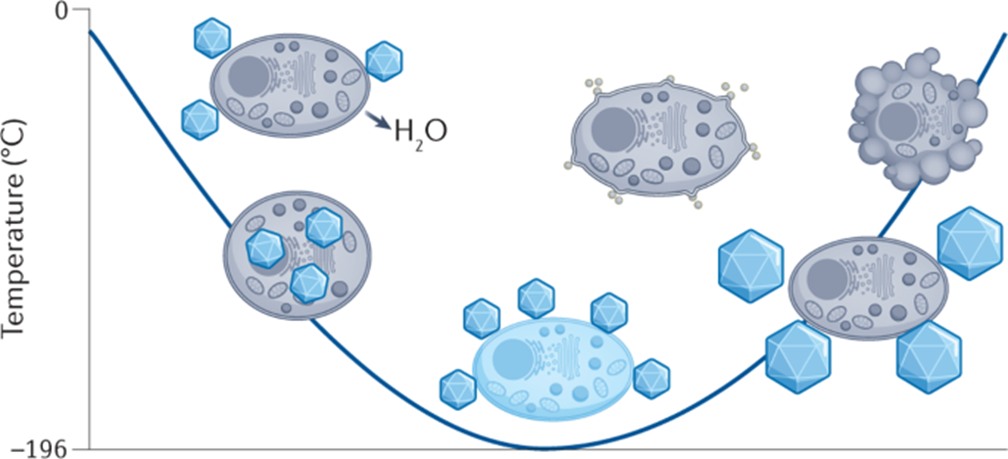
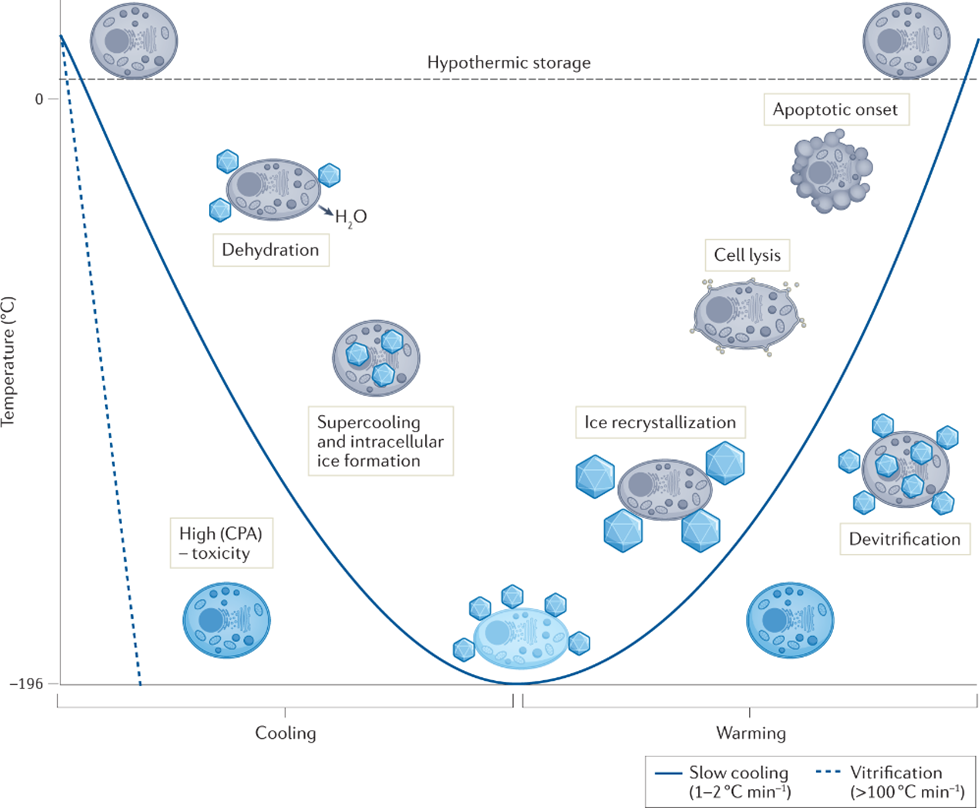
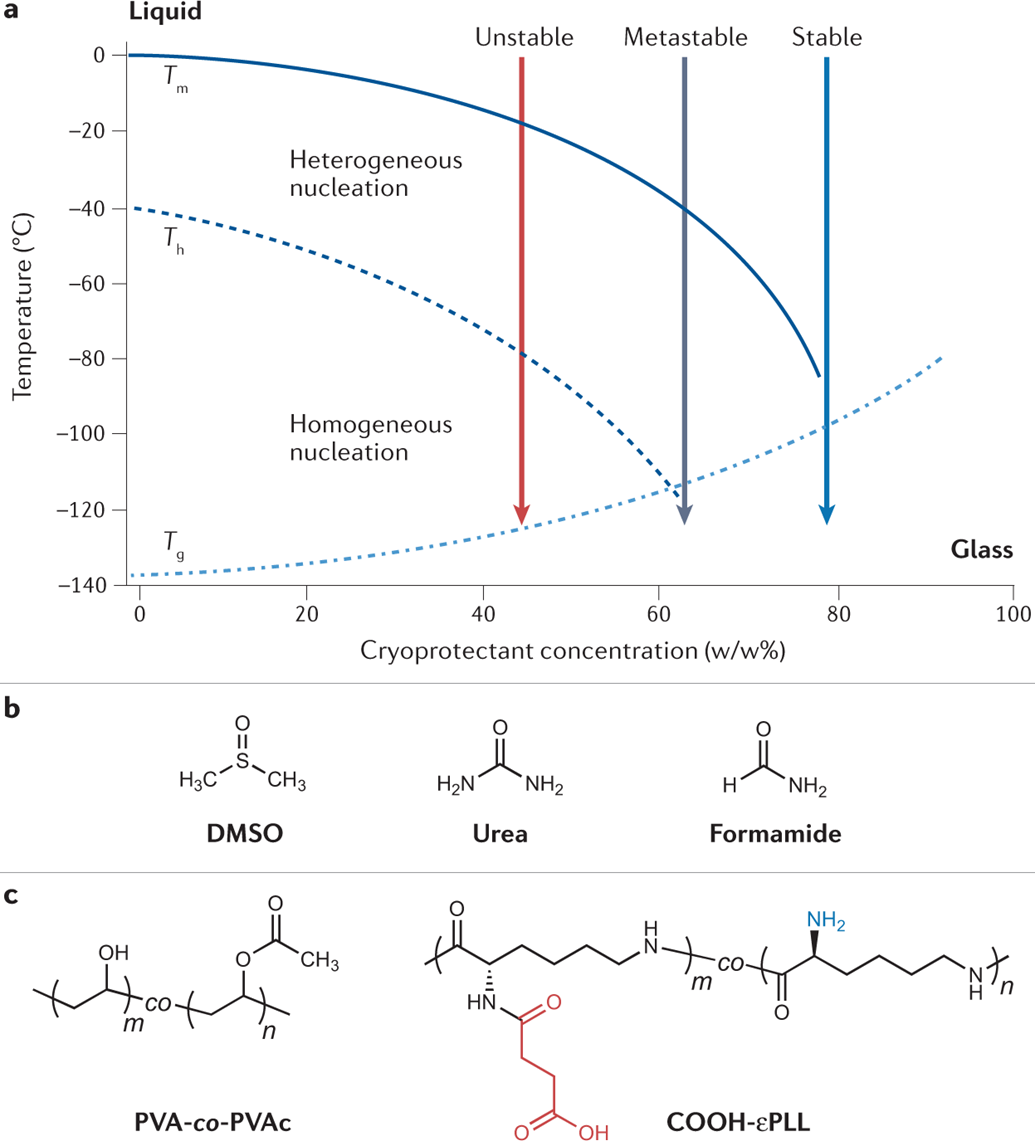
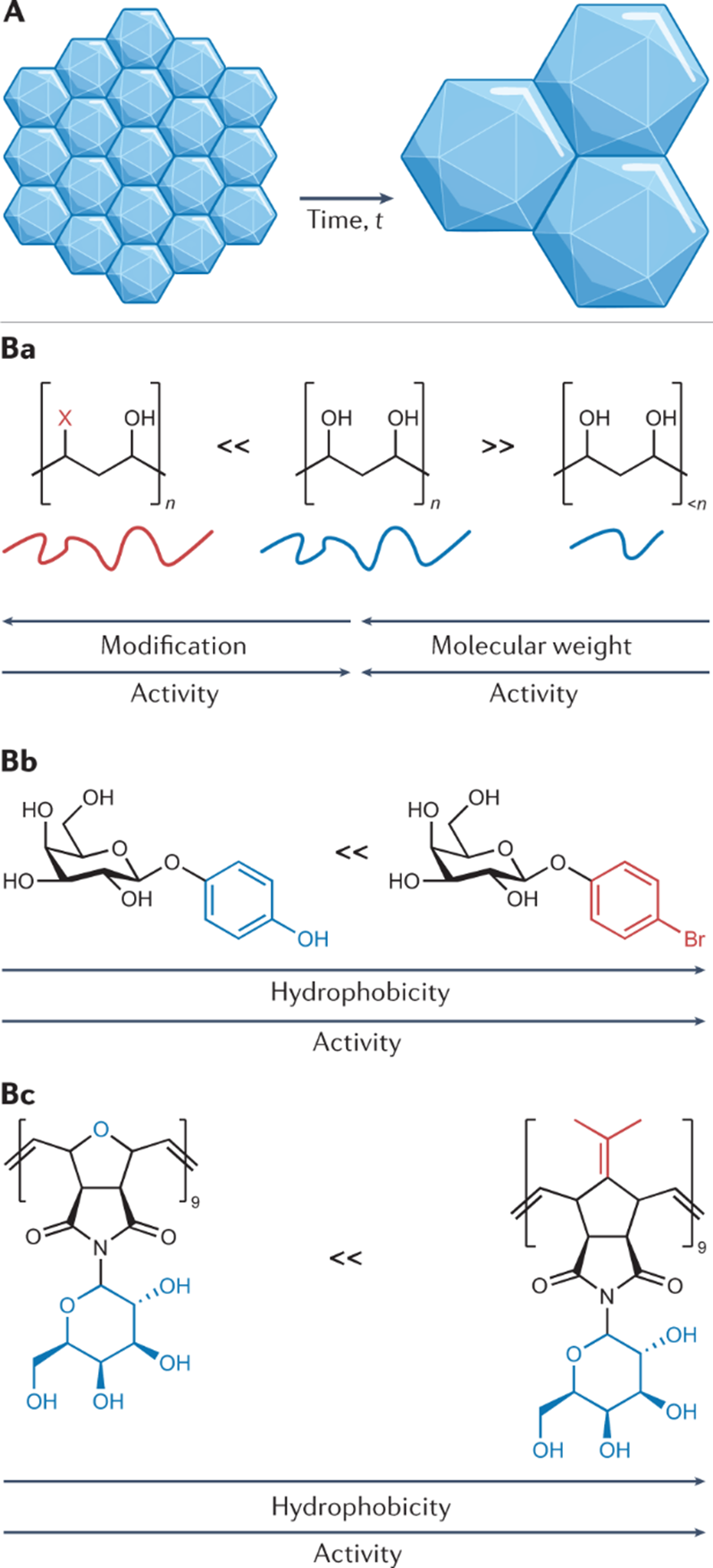
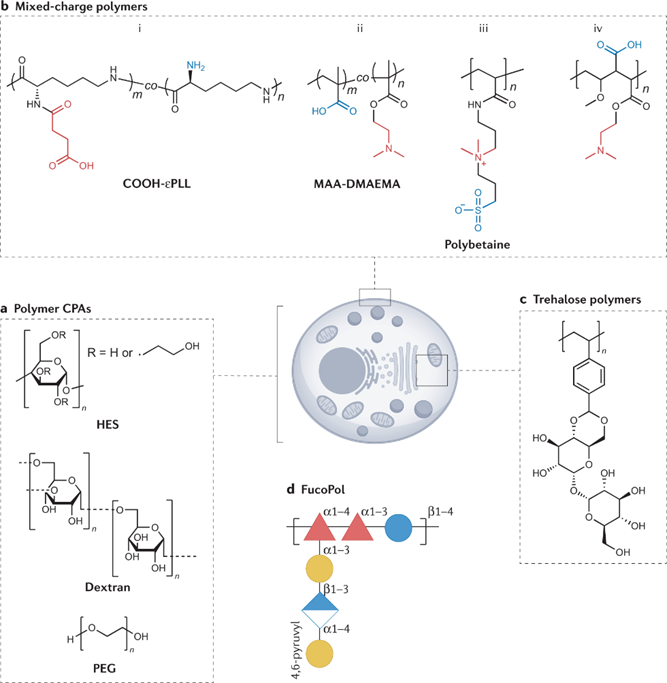
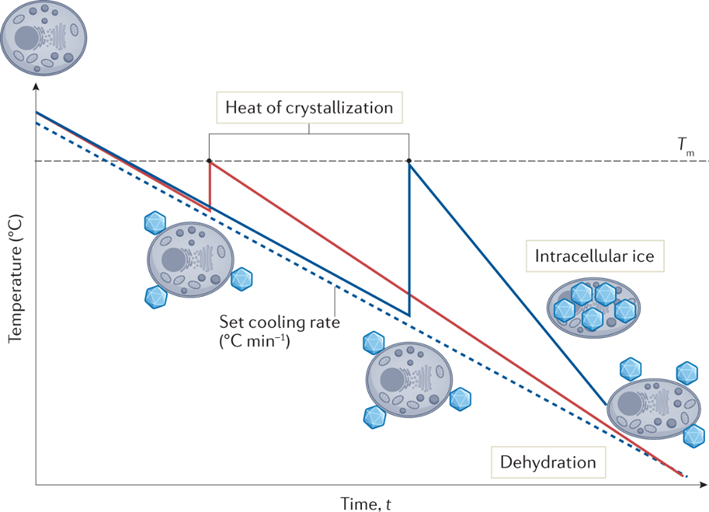
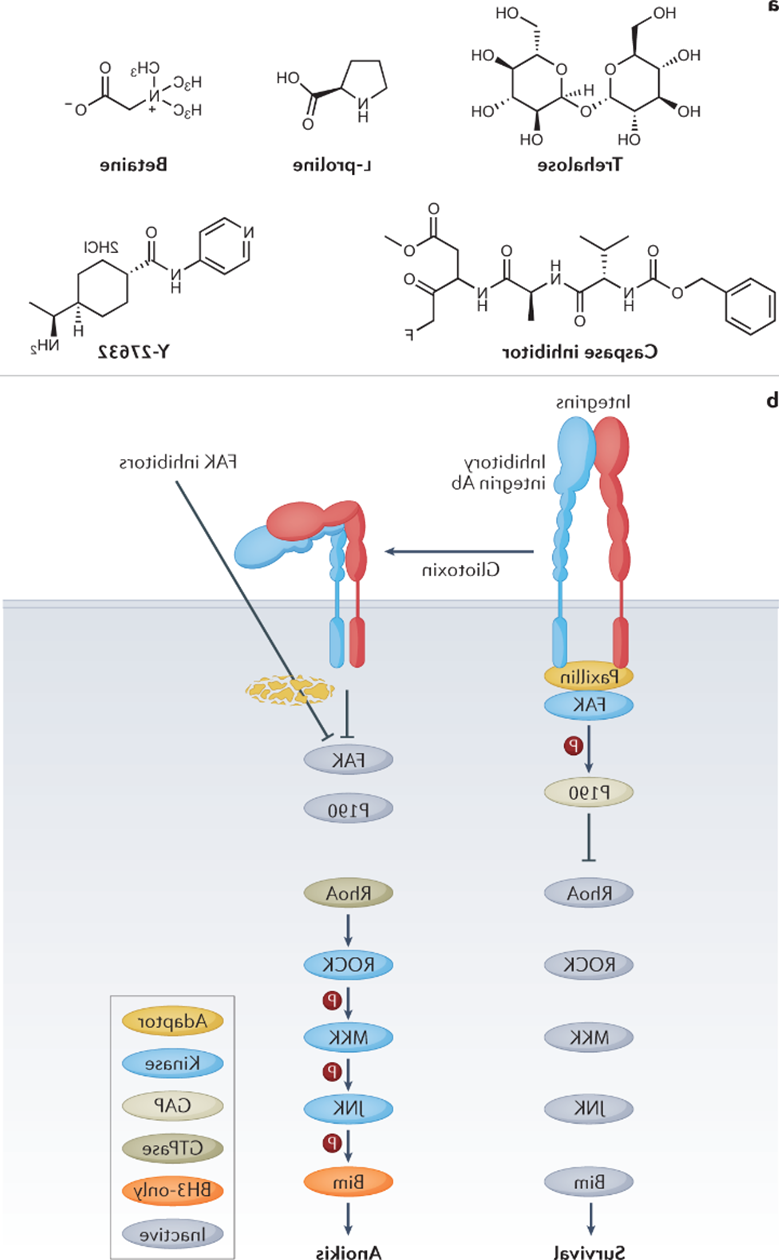
相信绝大多数生物相关的科研人都逃不过养细胞的宿命,这么多年来一边念着速溶慢冻慢冻速溶,一边加入10%的DMSO,细胞冻存复苏就完事了。但是,你有没有经历过冻存复苏起来的细胞活力很差或者它分化了?你有没有思考过,你心爱或恨得牙痒痒的细胞在冰箱里面到底经历了什么?这么多年,冻存细胞和组织真的冻对了吗?低温保存,即在零度以下温度下储存材料的过程,是基础研究以及临床、生物医学和食品科学的重要过程。但是低温不是冷冻保存引起的损伤的直接原因,而是冷冻和解冻过程出现多种现象对材料造成损害。为了缓和冷冻保存引起的损伤,采用冷冻保护剂(CPA),最常见的是二甲基亚砜(DMSO)和甘油。尽管它们具有实用性,但这些常见的冷冻保护剂给被冷冻的生物材料带来了许多问题,并且某些细胞类型仍然难以冷冻保存和恢复,抑或是引发了多潜力细胞分化。总体而言,目前设计和发现新型冷冻保护剂的需求显然尚未得到满足,这些冷冻保护剂可以取代或减少这些当前金标准所需的量,并解决具有挑战性的样品类型。近日,英国华威大学化学系的Kathryn A Murray教授与生物医学系的Matthew I Gibson 教授批判性地讨论了冷冻保存的方法,总结了细胞冷冻保存过程中复杂且关键的损伤途径以及解决方法。二人重点介绍和评估当前和新兴的化学工具,包括冰结合剂、冰成核剂,、冰成核抑制剂和生化调节相关的新兴材料,这些工具可以调节低温保存过程。此外,也讨论利用化学工具的具体方法,例如细胞封装和生化途径的调节。最后,介绍领域发展并提出将使该领域受益匪浅的新方法。在大多数情况下,将水溶液冷却到平衡冰点以下将不可避免地导致细胞外介质中冰晶的形成和样品中水溶剂量的降低,这将导致两个关键影响。首先,在细胞膜上形成渗透梯度,导致细胞脱水。一些细胞脱水有利于冷冻保存结果,因为它减少了细胞内冰晶(IIF)。然而,不成比例的脱水也会导致不可逆的损伤,并且是冷冻保存引起的生物材料损伤的关键原因。第二个,随着冰晶在细胞外介质中继续生长,先前分散在溶剂中的溶质集中在冰晶之间的残余水通道中。与没有冰的样品溶液相比,被困在这些通道中的细胞将经历更高浓度的溶质,最终导致渗透性休克或受到毒性损伤。冷冻保存的一个挑战是样品过冷,即在(非均质)细胞外冰成核发生之前,溶液的温度冷却到比平衡熔点低许多度。当成核时,放热过程导致潜热被释放,从而使溶液升温接近熔点,同时溶液温度继续降低。因此,由于先前的过冷溶液重新调整到平衡温度,因此与在较高温度下成核的溶液相比,它经历了更快的冷却过程,其细胞脱水时间也有所不足。另一个挑战是冷却速率,冷却速度慢让细胞有足够的时间脱水并防止IIF,然而,细胞也会长时间暴露于高溶质浓度以及毒性的冷冻保护剂中。相比之下,冷却速率快避免细胞在高溶质溶液中受损,但可能导致IIF。值得一提的是,不同的细胞类型将具有不同的最佳冷却速率。当将生物材料解冻时,还存在额外的冷冻保存挑战。在这个过程中,脱水细胞暴露于大量水或缓冲溶液会导致水流入细胞膜,并可能导致肿胀和细胞裂解。冰重结晶现象也可能发生,其中冰晶以牺牲较小的晶体为代价生长成较大的晶体,导致机械和渗透应力损伤。玻璃化冷冻是可以通过极高的冷冻速率以绕过结冰过程,进而防止冰成核与细胞内冰生长引发的细胞损伤。为了实现玻璃化冷冻,通常需要高浓度的渗透和非渗透CPA(例如,乙二醇、二甲基亚砜和高分子量试剂)。这种方法的一个主要挑战是冷冻保护剂的毒性,以及需要快速但逐步地去除CPA,以避免解冻后毒性和渗透损伤。学界基此提出了降低CPA毒性的解决方案,通过实验筛选出总体浓度较高但内在毒性低于标准玻璃化溶液的新型玻璃化溶液。有趣的是,玻璃化中使用的一些渗透性冷冻保护剂(例如甲酰胺)的毒性可以通过添加DMSO,尿素和乙酰胺等化合物来降低,这种方法被称为冷冻保护剂毒性中和。一些初步研究证实,小分子方法可以帮助解决冷冻保护剂毒性问题。除了减轻毒性之外,还探索了降低CPA总浓度的方法。在小体积体系中,热扩散距离较短,因此在低CPA浓度下可以实现较高的冷却速率,允许在玻璃化转变温度(Tg)以下快速冷却,从而不会发生成核。这种方法在科研应用方面显示出巨大的潜力,但对于需要大量细胞的细胞治疗应用可能没有用处。重结晶描述了已经冻结的材料中冰晶尺寸随时间推移的增加,这种现象是解冻阶段细胞死亡的一个因素。在讨论冰重结晶抑制用于冷冻保存时,重要的是要注意“什么程度的抑制才能带来好处?”是一个具有挑战性的问题,因为任何药物都可以具有多种作用模式,这些模式可能因不同的细胞系,冷冻保护剂类型,冷冻/解冻循环以及任何冷冻保存程序中的其他变量而异。更加增加复杂性的是,冰重结晶抑制是一个连续过程,而不是on/off属性,任何材料都可以在足够高的浓度下减缓冰的生长。目前已知多种抑制冰重结晶活性的冰结合蛋白,其中抗冻糖蛋白的抑制效果可以领先最活跃的合成冰重结晶抑制剂(IRIs)多个几个数量级。基于此,尝试简化抗冻糖蛋白,仅合成其发挥作用糖肽的IRI是一次富有潜力的尝试。除此之外,受到低温保存的这些正面结果的启发,越来越多的新分子和聚合物正在开发中,以用来抑制冰重结晶活性。这些包括纳米材料、有机金属自组装、自组装有机染料、肽和尼龙-3基聚合物。最后,冰重结晶抑制通过减少冻融过程中的不可逆聚集来帮助蛋白质冷冻保存,但到目前为止,只有PVA和自组装肽被证实有效。在冷冻保存溶液中广泛包含大分子,如聚合物、蛋白质和/或多糖。例如,羟乙基淀粉用作红细胞保护剂,并将血清蛋白、右旋糖酐或PEG等添加到冷冻保护剂溶液中。近年,人们对发现新的合成和天然聚合物的兴趣达到了顶峰,这些聚合物可以取代或减少有机溶剂的数量,并增加解冻后的产量,包括那些不具有特定冰结合或冰重结晶抑制活性的聚合物。研究表明,具有混合阳离子和阴离子侧链的聚合物才是功能的关键,而不是使用特定聚合物。聚两性离子体通过控制冰重结晶抑制发挥作用,但与有效的IRI相比,这种活性的幅度非常低。尽管活性较低,但其的表现仍优于冰重结晶抑制材料,可以在玻璃化和慢速冷冻中发挥作用。聚两性离子体的一个关键考虑因素是它们不是DMSO的替代品。当将聚两性离子体与DMSO一起冷冻保存会使细胞的解冻后活力更高,但在没有任何DMSO的情况下受到严重限制。这种观察到的效果意味着聚两性离子体和渗透性冷冻保护剂(如DMSO)之间存在协同作用模式。如前所述,样品过冷导致其中溶液在冰成核之前冷却远低于其平衡熔化温度,是冷冻保存中的常见问题。该过程对于小体积体系尤其明显。控制成核并在接近零的温度下诱导成核已被证明可以提高细胞冻存后恢复,通过让细胞有足够的时间脱水,从而避免IIF。在此提出两种方法概念:外部诱导和使用冰成核剂。虽然冰雾与液氮蒸气诱导成核已经被证明有着促进冷冻保存的作用。但在冷冻保存方案中,受控成核经常被忽视,这可能是因为包括成核控制在内的程序可能很麻烦且复杂。例如,物理方法,如冰播种、电冷冻和冲击冷却需要直接干预材料,需要在冷却曲线期间准确使用它们,并且也难以自动化和扩产。可以添加到培养基中的冰成核剂提供了一种更有前途的替代方案,因为它们不需要特定的施用时间,可以应用于自动化工作流程,并且与一系列冷冻保存容器兼容。结晶胆固醇已被证明可以使温度高达-4°C的冰成核。其他类固醇,包括睾酮和雄甾酮,也被证明可以在相对较高的温度(~-7°C)下使冰成核,尽管它们在冷冻保存应用中的使用受到限制。已知几种细菌物种会产生冰成核蛋白。研究最多的细菌蛋白提取物之一来自丁香假单胞菌,它的促进冷冻保存的作用已经在胚胎实验中被证实,然而,其生物相容性问题仍有待解决。从历史上看,生物制剂的冷冻保存被视为一个纯粹的物理问题,其解决方案侧重于控制和调节冰的生长/成核,解决渗透变化和细胞脱水或改变冷冻率以提供更好的结果。然而,冷冻保存越来越多地从生化的角度来看待,因此可以通过调节生化途径来减轻冷应激。在大自然中,已知许多微生物产生和积累小分子渗透液,如海藻糖和脯氨酸以对抗低温暴露。这些小分子渗透液具有物理保护作用,但也有证据表明其中一些也起着生化作用。使用脯氨酸喂养的果蝇幼虫更易冻存复苏。冷冻前24小时用海藻糖或L-脯氨酸的预孵育也被证实在多个细胞系中促进冷冻保存。小分子渗透性的实际效果似乎已经明确,但确切的作用方式仍然未知。了解渗透压解质生化作用背后的机制将是未来冷冻保护剂开发的关键。细胞凋亡是程序性细胞死亡的过程,而解冻后延迟发作的细胞凋亡也是影响细胞复苏后活力的主要因素之一。半胱天冬酶蛋白是已知的细胞凋亡效应因子,因此假设在冷冻保存培养基中加入半胱天冬酶抑制剂以改善结局。将半胱天冬酶-1抑制剂V添加到HeLa,Jurkat和293个肾癌细胞的冷冻和解冻溶液中,导致存活率显着提高。这些发现后来在牛胚胎、猪肝细胞,原代人肝细胞和卵巢组织中得到了复刻。半胱天冬酶抑制剂似乎通过内在(线粒体)和外在(死亡受体)途径影响了细胞解冻后的凋亡过程,这可能解释了为什么在广谱抑制剂存在下细胞活力得到改善,而不是特定的半胱天冬酶抑制剂。Rho相关卷曲激酶(ROCK)活性位点抑制剂Y-27632能够减少hESC中解离诱导的细胞凋亡。鉴于悬浮液中冷冻保存的贴壁细胞类型需要在解冻后重新附着在底物上才能存活,这一发现为靶向可改善解冻后细胞功能的“可药物化”途径提供了机会。当Y-27632补充到hESC的冷冻培养基中时,解冻后细胞回收率比未处理的对照提高了50%175并且还导致细胞粘附增加。当Y-27632单独添加到解冻培养基中时,hESC集落形成显着增加,这表明主要影响不是在冷冻保存过程中,而是在解冻过程中。虽然ROCK抑制剂不是传统定义中的冷冻保护剂,但它们可以通过调节生化途径而不是冷冻保存过程本身来改善生物材料解冻后结局。值得注意的是,不同的细胞类型会有不同的生化途径。因此,冷冻保存的生化方法可能是细胞依赖性和组织依赖性的,而不是通用性的解决方案。冷冻保存技术现在并且将来都是生物医学发现和转化科学的重要工具。不再满足与二甲基亚砜和甘油基础性方案,更新换代的细胞/组织模型和疗法将需要同样先进的冻存工具:保护珍贵的生物样本;最大化恢复/功能;并确保低温保存方法符合冷链需求。2019冠状病毒疾病大流行更是特别强调了后一点,mRNA疫苗有严格的冷链储存要求。在这篇综述中,两位作者介绍了如何开发新的化学工具来应对低温保存的挑战。还描述了这个多变量问题的复杂性质,其中需要解决多种损伤机制,并且细胞类型和冷冻方法(慢速和快速)之间存在细微差异。极端低温环境的微生物给予了学界启发,让学者们从天然化合物中发现对抗低温损伤的秘密。为了应对这些挑战,需要一种真正的跨学科方法,兼容结构和进化生物学、合成和分析化学、材料发现和细胞生物学在内的诸多学科。还需要为感兴趣的问题找到合适的材料。在这个不断发展的领域中,很明显,仅靠偶然发现是不可能的。因此,必须采取合理科学的发现方法,解决具体机制。Kathryn A Murray, Matthew I Gibson. Chemical approaches to cryopreservation. Nat Rev Chem. 2022 Jul 18;1-15.https://www.nature.com/articles/s41570-022-00407-4