活细胞是多任务处理的专家。它们通过创建专门的隔间,使用有限的工具却可以集中执行无数重要功能。在某些情况下,隔室被脂膜包围,但分子也可以分为无定形团块,称为液体凝聚物,其内容随着分子扩散进出它们而波动。这些凝聚物的完整性是由热力学来维持的,就像油滴不溶于水一样。但它们的动态行为带来了一个挑战:是什么阻止了细胞的成分形成一个巨大的团块?
于此,德国马克斯普朗克研究所Stephan W. Grill、Frank Jülicher、Arjun Narayanan等人报告了细胞使用的一种生化计时机制,以避免在肌动蛋白细胞骨架(赋予细胞结构的蛋白质网络)形成过程中发生灾难性的聚集。

关键问题
细胞骨架由一组生物聚合物形成,这些生物聚合物可以快速组装成各种网络结构:从推动细胞前进的树状网络,到分裂时收缩细胞的环状结构,以及施加闭合开放性伤口所需力的线性阵列。这些网格的刚度通常被认为是维持细胞机械完整性的核心。然而,通过观察网络形成的最早阶段,研究人员表明,新生肌动蛋白网络形成稀疏凝聚物,有助于构建细胞骨架。因此,细胞骨架不受控制的生长或合并成单个凝聚体将给细胞带来巨大的问题,因为细胞骨架在细胞表面的均匀分布对于健康的胚胎发育和细胞资源的正确分配至关重要。
异步地出现和消失
研究人员研究了秀丽隐杆线虫胚胎单细胞阶段的细胞骨架。他们发现数以千计的肌动蛋白丝小簇在几分钟内以异步动力学在细胞表面出现和消失。作者的分析表明,这些簇通过一种涉及两种成分相互作用的机制被阻止合并成一个团块:一种启动肌动蛋白细丝组装的蛋白质,称为 WSP-1,以及细丝本身。
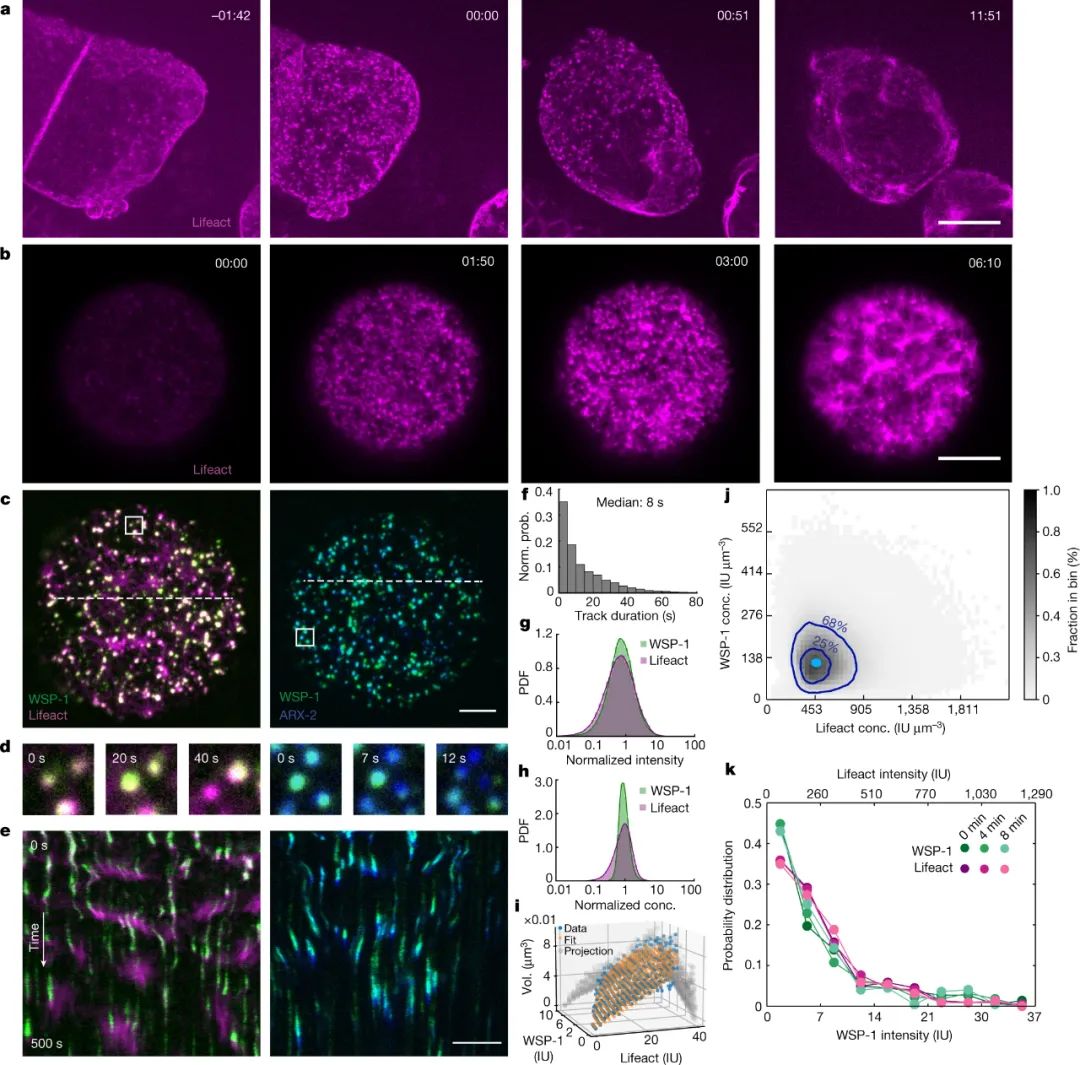
图|在卵母细胞到胚胎的转变过程中,肌动球蛋白皮质的形成是通过动态的 F-肌动蛋白/WSP-1 皮质凝聚物进行的。
生物化学计时器
研究小组表明,当WSP-1通过优先结合自身而开始在细胞表面积累时,首先会形成凝聚物。这种聚集在WSP-1簇的位置触发肌动蛋白网络的组装,并且该网络被细胞质中存在的其他特殊蛋白质不断分解。在簇形成开始时,与WSP-1诱导的组装中的爆发相比,细丝被分解的速率可以忽略不计。
随着越来越多的肌动蛋白丝积累,WSP-1从凝聚物中移出,留下富含肌动蛋白的凝聚物,蛋白质缺乏。此时,分解开始超过组装,导致凝聚液最终溶解。通过这种机制,细胞产生具有正确功能的凝聚物,同时也及时主动破坏它们。作者将这一循环映射为肌动蛋白和WSP-1浓度的函数。该循环有效地创建了一个生物化学定时器,通过该定时器,细胞可以防止其有限的资源被一个功能囤积。
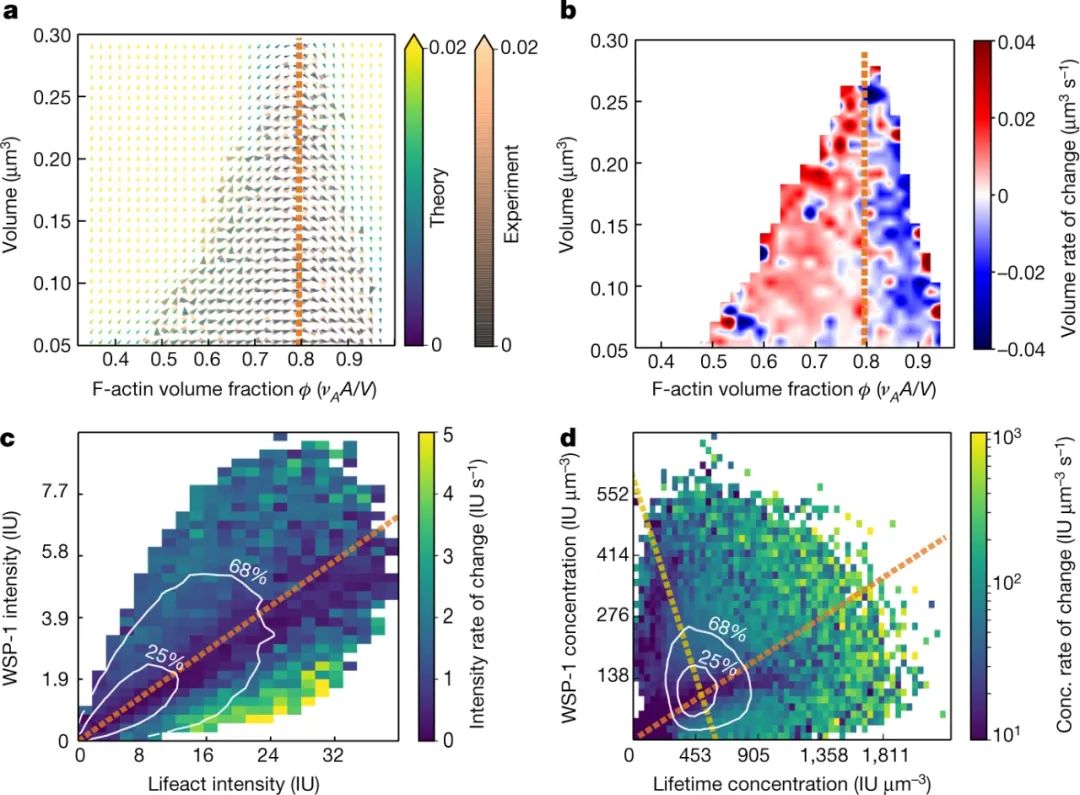
图|集合平均浓度由具有最慢动力学的化学计量确定
整个简要过程如下图所示,在第一阶段,WSP-1首先在细胞表面积累形成凝聚物,触发肌动蛋白网络的局部组装;然后进入第二阶段,这些细丝不断地被分解,尽管速度低于它们的组装速度。在第三阶段,WSP-1通过一种未知的机制被移出液体凝聚物。最后的第四阶段,分解速度超过了组装速度,导致凝聚液溶解。
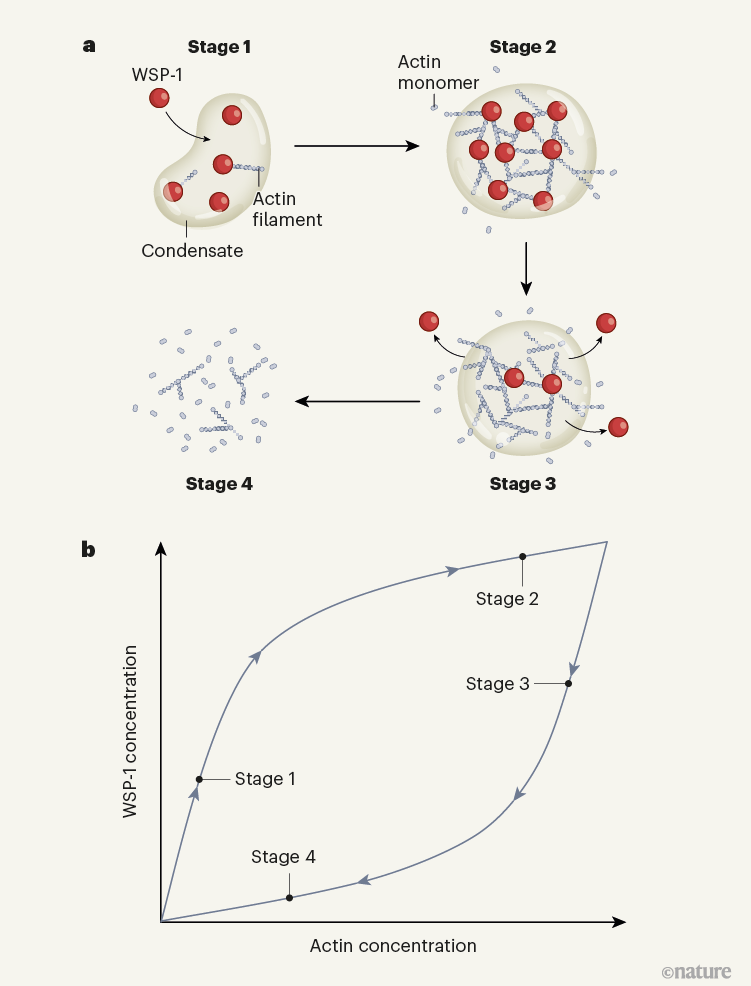
图|肌动蛋白细胞骨架凝聚物的生化计时器
这项技术性研究的结果提出了许多问题。
1)事实上,控制细胞骨架凝聚物的密度不仅需要设计一种在正确的时间摧毁它们的方法,而且还需要精确调节它们首先出现的频率。控制成核过程的方法是一个有待进一步研究的课题。
2)WSP-1 从凝聚物中排除的确切机制同样未知。一种可能性是生长的肌动蛋白丝通过直接的机械相互作用将 WSP-1 从凝聚物中移出。事实上,在爬行细胞的前部,与 WSP-1 相关的复合物已被证明被触发形成的肌动蛋白丝物理置换。类似的力会导致 WSP-1 排斥吗?
3)尽管作者的模型是基于两种成分之间的相互作用,但很明显,许多隐藏的蛋白质隐藏在其参数背后。根据我们对肌动蛋白网络生物化学的现有知识,可以猜测其中一些的身份。例如,与与去除肌动蛋白丝相关的参数可能会受到参与网络分解的蛋白质的丰度或活性变化的影响,例如 coronin 和 cofilin。其他参数则更为神秘:当作者耗尽参与细丝组装的蛋白质复合物的细胞时,变化最大的模型参数反而与肌动蛋白分解有关。
回答这些问题需要结合成像和建模。作者使用的早期秀丽隐杆线虫胚胎在这方面提供了一个理想的系统,它的透明性使其能够进行高质量的成像,并且可以使用多种遗传工具进行探测。对这种模式生物中凝聚物形成的进一步研究无疑将加深我们对细胞骨架组织的理解。
小结
该研究工作扩展了我们对细胞内凝聚物的理解。尽管许多观察到的凝聚物是本质上无序蛋白质的液体状聚集体,但研究人员观察到的细胞骨架聚集体可能采取凝胶状结构的形式,涉及坚硬的蛋白质丝。这些凝胶状聚集体是否能像两个液滴一样在接触时顺利融合仍有待确定,这一特性迄今为止一直被认为是凝聚物的标志。
该研究还丰富了我们对如何控制凝聚物大小的理解。先前提出的尺寸调节机制表明,例如,凝聚物受到弹性支架的物理限制,或者它们的尺寸由其组分的扩散和降解之间的不平衡决定。与这些静态机制不同,该生化计时器表明,细胞内凝聚物通过高度动态的方式进行调节,并再次揭示了整合物理和生物化学在我们从分子相互作用中了解细胞过程的努力中的力量。
参考文献:
1. Yan, V. T., Narayanan, A., Wiegand, T. et al. A condensate dynamic instability orchestrates actomyosin cortex activation. Nature (2022).
https://doi.org/10.1038/s41586-022-05084-3
2. A biochemical timer phases condensates in and out in cells. Nature 2022.
https://www.nature.com/articles/d41586-022-01794-w











