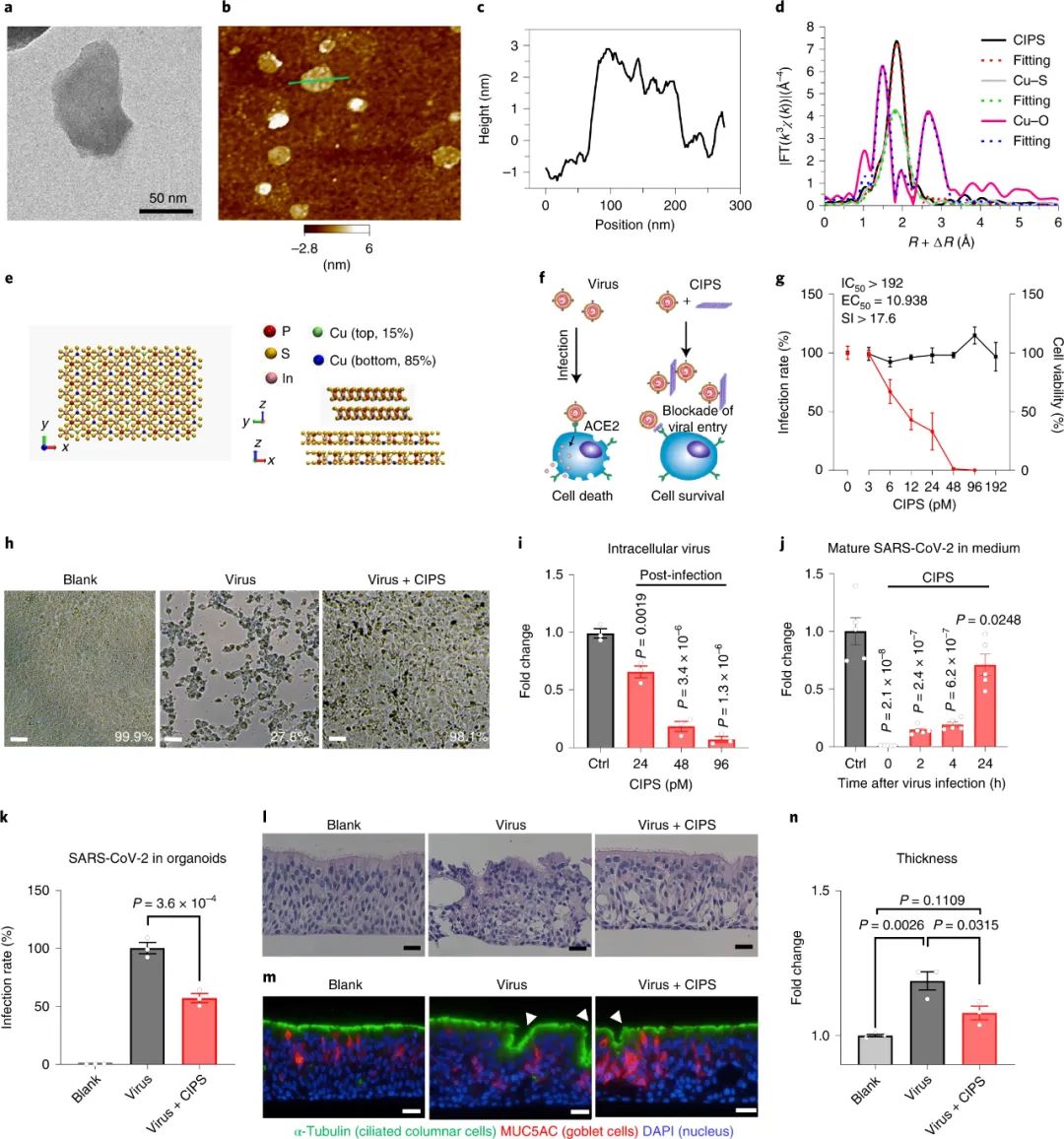
新冠病毒变异毒株 (variants of concern, VOC) 的快速传播表明,目前批准的抗SARS-CoV-2药物、中和抗体和疫苗的有效性存在很大局限性。尽管为重新利用药物做出了相当大的努力,但仍需要具有有效抗病毒活性的新型化合物来治疗和遏制 SARS-CoV-2 感染。SARS-CoV-2感染需要 SARS-CoV-2 的 S 蛋白的受体结合域 (RBD) 与宿主的细胞血管紧张素转换酶 2 (ACE2) 受体结合。抗 SARS-CoV-2 中和单克隆抗体 (mAb) 已被设计用于与 S 蛋白的 RBD 或RBD-ACE2 结合位点的表位进行靶向相互作用,或被选择用于有效的中和活性。除了后勤障碍(用于有效治疗的每公斤体重 4-100 毫克的高剂量、复杂的储存和运输条件)之外,使用mAb的一个重要缺点是它们对 SARS-CoV-2 变体的功效很低,尤其是对Omicron变异毒株。寻找特异性较低且因此具有更广泛治疗能力的替代工具,纳米材料 (NM) 的抗菌和抗病毒能力引起了人们的特别兴趣。VivaGel 是一种著名的抗病毒树枝状聚合物凝胶,已通过阻断病毒与细胞的相互作用来预防HIV病毒和单纯疱疹病毒。金属纳米材料通过金属原子与病毒成分的相互作用显示出抗病毒能力,例如银和金纳米材料。金纳米材料具有可调节的表面化学设计,可模拟病毒粘附的硫酸乙酰肝素,已成功应用于抑制各种病毒的感染。由于其 β-折叠平面结构和正表面电荷,RBD 优先吸附在具有大量负电荷的二维 (2D)纳米材料表面上。为此,中国科学院深圳先进技术研究院李洋、李红昌联合国家纳米科学中心/高能物理研究所陈春英、王黎明和昆明动物研究所郑永唐等人开发了一种广谱的抗新冠纳米材料-硫代磷酸铜铟(CuInP2S6,CIPS)纳米片(NSs),一种超薄二维纳米材料,它像胶水一样粘住新冠病毒,其具有强大的抗病毒能力。

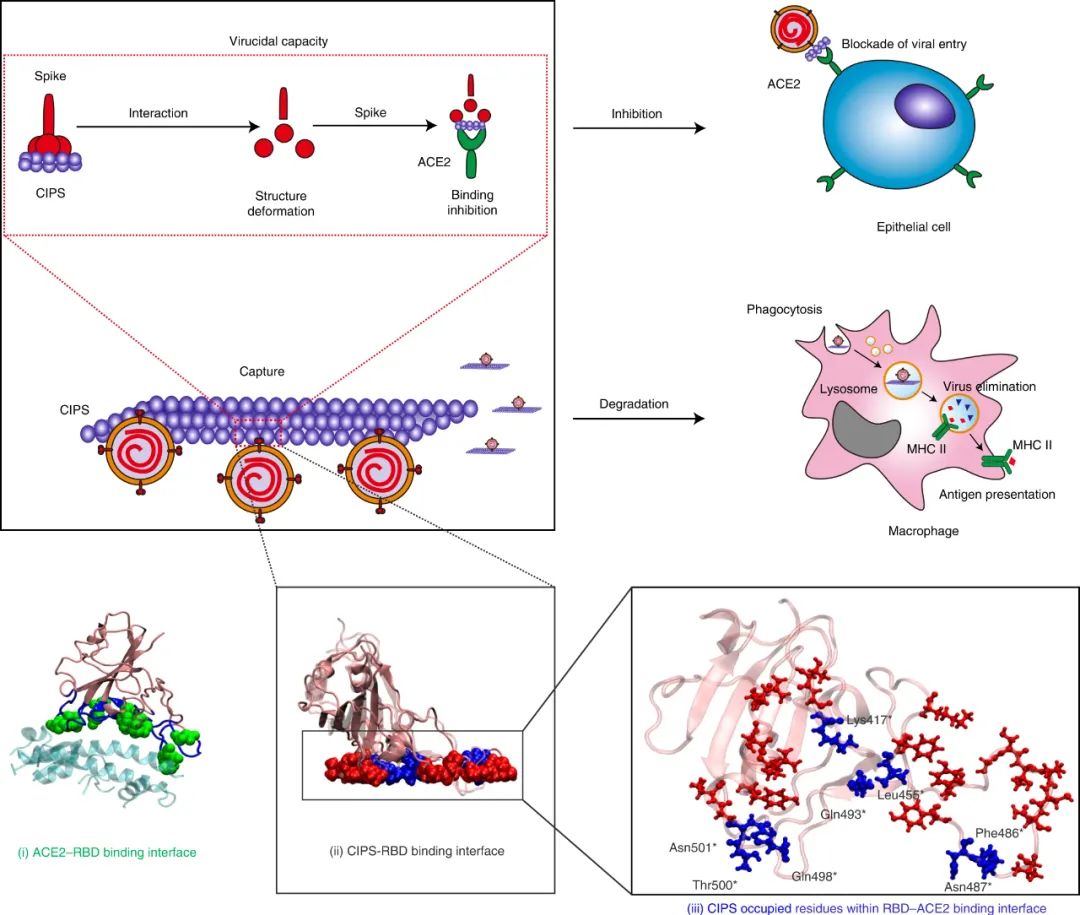
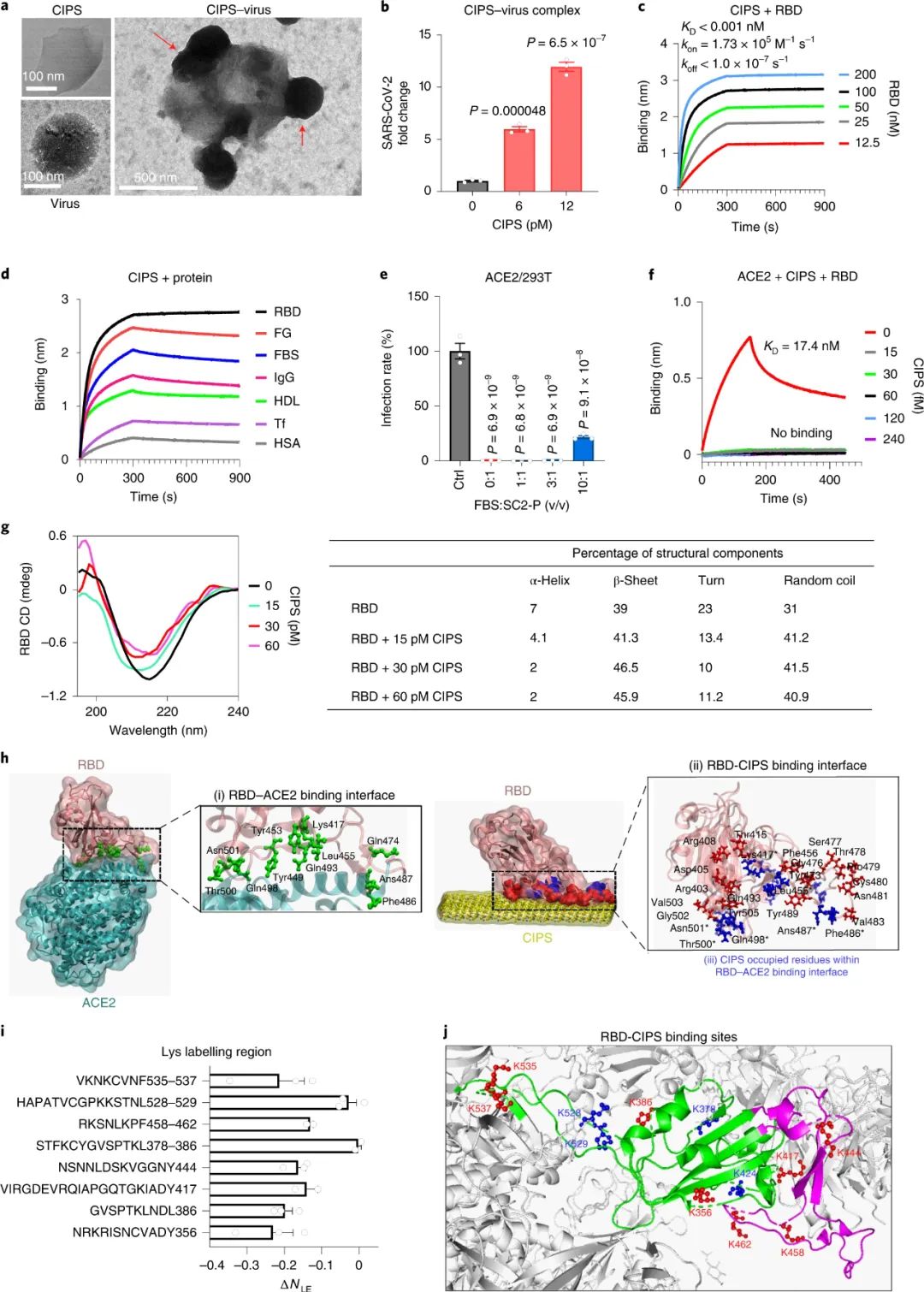
图|CIPS“纳米胶水”的抗 SARS-CoV-2 能力通过体外的细胞实验表明,利用CIPS 处理后,细胞无法被新冠病毒入侵感染。此外,还使用空气/液体界面培养的人气道上皮类器官评估了 CIPS 的抗 SARS-CoV-2 作用。这些类器官呈现出多层气道上皮结构,在面向空气的一侧有纤毛细胞,与人类呼吸道的结构非常相似,这使其成为人类呼吸道感染的现实模型。CIPS 处理导致 SARS-CoV-2 复制减少 40%,同时有效保护组织完整性,而且减少了上皮的厚度(增厚为病毒持续感染的迹象)图|CIPS的表征及其体外抗SARS-CoV-2能力研究人员进一步评估了 CIPS 在人 ACE2 (hACE2) 转基因小鼠体内的抗 SARS-CoV-2 能力。在用 SARS-CoV-2 鼻内感染之前或之后用 CIPS对小鼠进行治疗,并在感染后 3 天评估肺部 SARS-CoV-2 的存在情况。用两种剂量的 CIPS 治疗都显著减少了感染,CIPS 在治疗性和预防性治疗中都非常有效。图|CIPS 在体内抑制 hACE2 小鼠的 SARS-CoV-2 感染既然有效抗病毒,那这个纳米材料又是如何发挥抑制病毒的作用的呢?在排除可能的金属离子效应后,我们通过 TEM、CIPS 的物理化学性质的变化和蛋白质印迹证实了 CIPS 与 SARS-CoV-2假病毒(SC2-P)的相互作用。CIPS可以有效吸附和捕获真正的 SARS-CoV-2 病毒以及分离的 S 蛋白。研究人员确定 CIPS 以非常高的结合亲和力与 S 蛋白 RBD 结合,而对其他血清蛋白和因子的亲和力至少低 100 倍,表明对 RBD 的选择性结合能力通过MD模拟研究发现,在与ACE2相互作用的RBD的 11 个氨基酸残基中,有8个残基与 CIPS 表面结合。研究人员还通过基于质谱 (MS) 的两步同位素标记赖氨酸反应谱 (TILLRP) 确定了 CIPS 的RBD 的潜在结合位点和区域。观察到RBD-CIPS复合物中的赖氨酸标记水平在RBD中的六个赖氨酸位点或其邻近区域显著降低(Lys356、Lys386、Lys417、Lys444、Lys458-Lys462和Lys535-Lys537),表明他们的周围环境可以被 CIPS 阻挡。根据RBD的构象结构,不同的肽片段,包括Val401-Tyr421(Lys417)、Asn437-Tyr449(Lys444)、Arg457-Phe464-Tyr508(Lys458、Lys462),可能参与了与CIPS的结合。总的来说,MS 和 MD 模拟结果在识别CIPS-RBD 结合位点时一致,并表明与 CIPS 的结合涉及与 ACE2 结合有关的相同 RBD 残基,从而证实了 CIPS 的抗 SARS-CoV-2 能力。而且,CIPS 对 RBD 的更高结合亲和力也可归因于其更强的静电吸引力,针对 SARS-CoV-2 RBD开发的大多数治疗性 mAb 对 Omicron VOC无效,从而增加了对具有广谱活性的新型抗病毒药物的需求。CIPS 与 VOCs RBDs 之间相互作用的 MD 模拟表明, CIPS 可以与 17 个 RBD 残基中的 10 个结合,这些残基参与与ACE2 的结合。重要的是,CIPS 对所有 SARS-CoV-2 VOC 都表现出非常高的结合亲和力。CIPS对 SARS-CoV-2 VOCs 的抗病毒作用对所有VOCs 都很显著,与对野生型 SARS-CoV-2 观察到的效果相当。图|CIPS 对 SARS-CoV-2 VOCs 的抗病毒作用研究人员研究了巨噬细胞在与 CIPS 结合时是否能更好地吞噬和消除病毒。事实上,CIPS 相关的 SC2-P 在孵育 24 小时后可以被人类巨噬细胞有效吞噬,并且在随后的降解过程中病毒被有效消除。其消除途径依赖于溶酶体途径。研究人员还监测了 CIPS 在体内的生物分布和消除,显示 CIPS 在 6 h 时肺中的最大积累和 7 天后几乎完全消除。此外,研究还发现,与 CIPS 结合的SARS-CoV-2 可以促进巨噬细胞中 MHC II 分子的抗原呈递,从而可能触发适应性抗病毒免疫反应。因此,CIPS 将病毒引导至巨噬细胞的能力具有促进病毒破坏和触发抗病毒适应性免疫的双重优势。
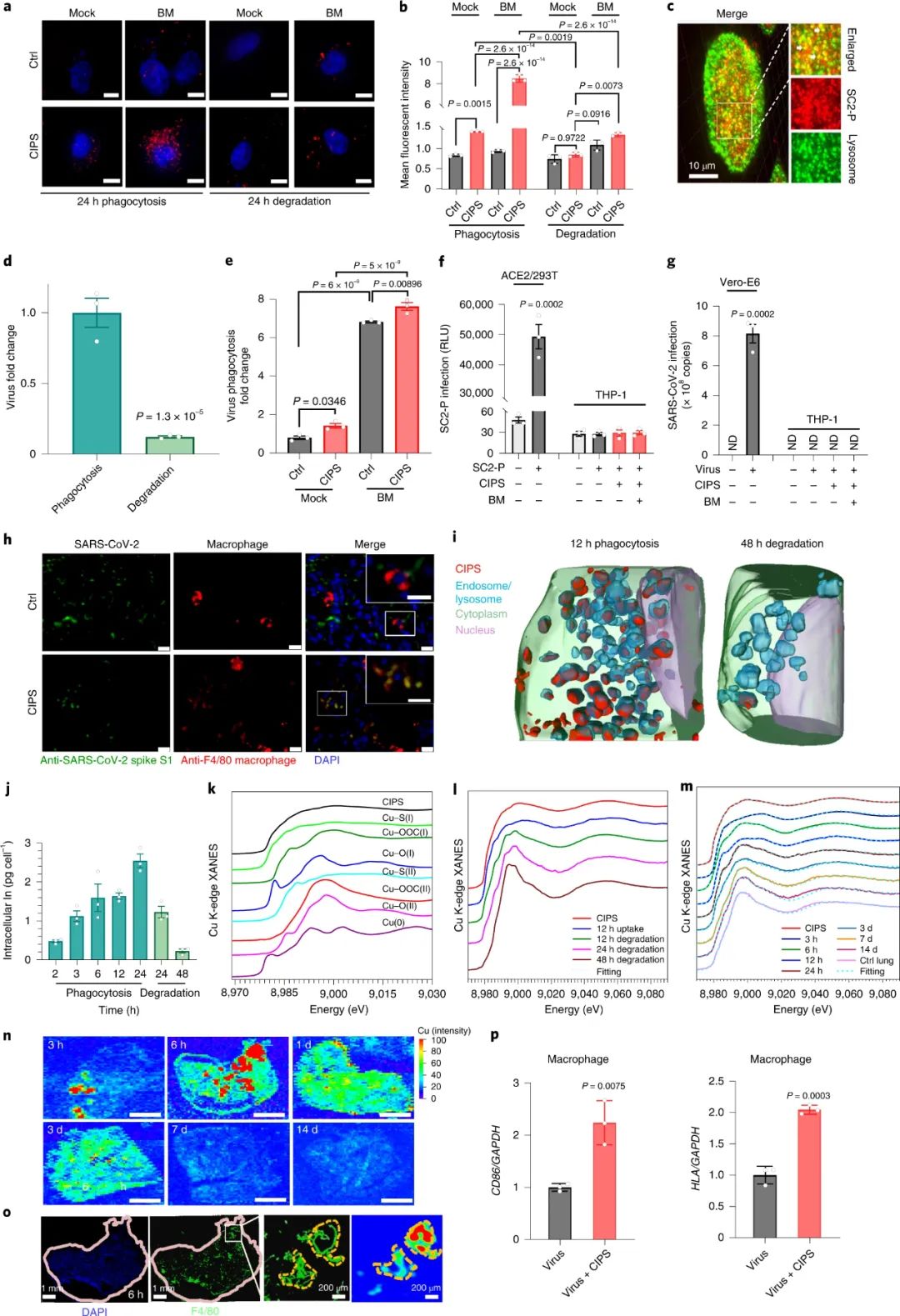
图|CIPS 促进巨噬细胞吞噬和消除 SARS-CoV-2综上所述,研究人员将 2D CIPS NS描述为一种有效的纳米胶水,能够通过结合其 S 蛋白选择性地捕获 SARS-CoV-2 病毒,从而抑制宿主细胞的感染。CIPS 是一种安全、生物相容和可生物降解的二维纳米材料,能够抑制感染并促进SARS-CoV-2 的消除。CIPS 与SARS-CoV-2 S 蛋白 RBD 之间的结合比病毒对ACE2 的亲和力强约 10,000 倍,这表明 CIPS 捕获的病毒不会被释放,也不会感染细胞。值得注意的是,CIPS 结合比最好的 mAb 强 23 到 100 倍,其广泛的 RBD 结合能力使其对所有测试的 VOC 以及其他冠状病毒同样有效。其广谱功效、储存稳定性和良好的生物相容性使 CIPS 成为一种很有前途的抗 SARS-CoV-2 候选药物。CIPS 对 SARS-CoV-2 S 蛋白的捕蝇纸状和选择性结合能力也使其特别有希望作为表面涂层材料和去污剂,在实验室和临床环境中控制病毒传播并提高安全性。Zhang, G., Cong, Y., Liu, FL. et al. A nanomaterial targeting the spike protein captures SARS-CoV-2 variants and promotes viral elimination. Nat. Nanotechnol. (2022). https://doi.org/10.1038/s41565-022-01177-2