传统的癌症治疗方法,例如化学疗法和放射疗法结合手术切除,不足以治疗侵袭性脑肿瘤(例如,多形性胶质母细胞瘤 (GBM))。尽管进行了标准护理手术、放疗和化疗,胶质母细胞瘤患者的中位总生存期为16-21个月,五年生存率为 5.6%。这主要是因为GBM细胞的耐药性和抗辐射性,导致治疗后肿瘤复发或转移。肿瘤的受控加热已被用作治疗各种肿瘤的有效方法,并且可能有助于根除这些耐药细胞。
因此,开发侵入性较小且针对肿瘤的加热程序,例如基于纳米粒子的光热疗法,可以为改善 GBM 治疗和延长生存期提供机会。
鉴于此,斯坦福大学Ada S. Y. Poon、Hamed Arami等人重新审视了光热疗法的概念,并开发了一种新的远程控制方法,用于对自由行为小鼠的脑肿瘤进行连续和长期的光热疗法,无需重复开颅手术,可实现对脑肿瘤的远程治疗。此外,这也是首次在清醒动物中进行按需连续光热治疗的报告,有望减少临床转化障碍,并可针对不同肿瘤进行可行的修改。

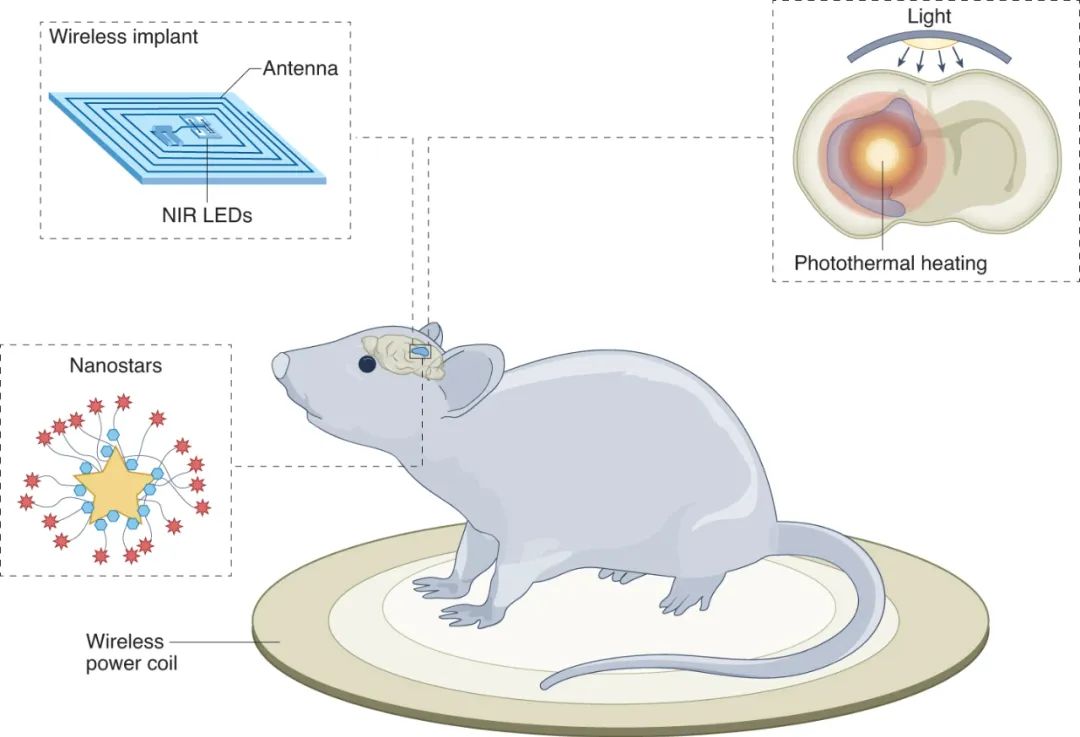
图|无线光热治疗脑肿瘤
该研究团队开发的策略基于两个关键组件:金纳米星和无线发光设备。
金纳米星
研究人员使用星形金纳米粒子作为光热剂,因为它们在 NIR 范围内具有有效的表面等离子体特性、生物相容性和易于合成以及表面功能化。该光热剂由活性单层拉曼报告分子(trans-1,2-bis(4-pyridyl)-ethylene (BPE))组成,并涂有 Cy5 标记的PEG分子。纳米颗粒被标记有 Cy5 和 BPE 分子,以便使用近红外荧光 (NIRF) 和拉曼(表面增强拉曼光谱)成像在肿瘤及其周围的正常脑组织内进行追踪。此外,PEG 分子增强了它们在肿瘤微环境中的稳定性,使其能够在肿瘤中选择性扩散,因为它们增强了渗透和滞留。
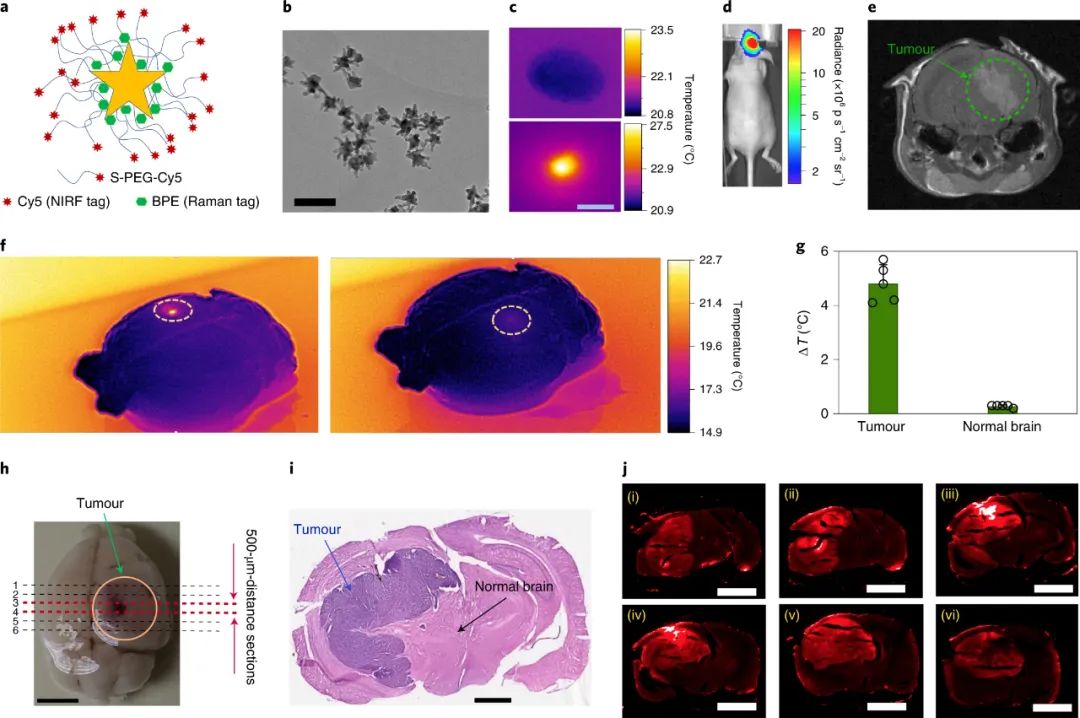
图|用于脑肿瘤光热加热的纳米粒子设计
无线发光装置
研究人员选择了 13.56 MHz(NFC 频段)进行无线电力传输,因为不同商业产品的可用性以及与更高频段相比组织吸收显著降低,允许在辐射安全范围内安全地将如此高的功率水平传输到纳米粒子指导方针。最终器件在植入前涂有 2 µm 厚的聚对二甲苯 C 层,以防止水分扩散并延长其植入后寿命。无线发光装置被植入头皮下方和光学窗口上方,颅骨通过手术减薄。通过激活放置在动物下方的射频发射器,该装置用近红外光照射大脑,近红外光穿透组织(约1厘米),并将能量传递给纳米星。

图|设计用于在长期(15 天)治疗周期内远程控制触发纳米粒子在大脑中的光热效应的占空比 NIR 发射装置
显著延长小鼠生存期
作者将这两个组件结合在一个治疗系统中,该系统满足从发射器到无线设备再到纳米星的能量传输效率的严格要求。使用该系统,他们每天为患有胶质母细胞瘤的小鼠的大脑远程提供 15 分钟的光热疗法。与仅接受一种治疗成分或未接受治疗的对照组相比,该治疗方案显着延长了患有人胶质母细胞瘤衍生肿瘤的无胸腺小鼠的生存期。在另一项研究中,该方案还延长了具有同基因肿瘤的免疫功能小鼠的生存期,当与每日给药替莫唑胺(一种广泛用于胶质母细胞瘤化疗的药物)结合使用时,效果甚至更强。

图|自由行为小鼠脑肿瘤的无线光热疗法
这些惊人的结果为一系列临床可能性打开了大门。几乎所有胶质母细胞瘤患者的第一次手术切除后,肿瘤都会复发,最常见于原始病变边界的 2 cm 内。在手术切除期间,可以将无线发光装置植入肿瘤腔内,用于治疗后期的复发。由于光热疗法的机制独特,它可以与其他疗法(如化学疗法和免疫疗法)相结合,以增强抗肿瘤作用。传感器也可以集成到设备中,以测量肿瘤对治疗的反应,并将数据传输给临床医生,临床医生可以使用它来确定最安全和最有效的治疗计划。
然而,为了使这些诱人的可能性成为临床现实,仍然需要克服重大挑战。
1)首先,需要在人类中确定纳米星的最佳给药途径和频率。特别是在肿瘤中维持治疗量的纳米星可能需要向系统增加药物输送能力。
2)其次,光传输系统需要适应更大的人类大脑。通过增加光剂量或优化光分布,可能需要将有效照射深度扩展到至少 2 厘米——大多数肿瘤复发的深度。
3)第三,需要对无线系统进行改善以供患者使用。理想情况下,患者只需在头顶佩戴一个可编程发射器,即可在家中方便地自行进行治疗。
小结:
综上所诉,研究人员设计了一个可植入且灵活的生物电子平台,以触发纳米粒子在脑肿瘤中的光热治疗反应,以实现按需和护理点治疗周期。该纳米颗粒被设计为在使用无线供电发光设备激活时在脑肿瘤微环境中产生统一的治疗作用。纳米粒子能够精确治疗肿瘤,而对周围正常脑组织没有任何明显的加热效应。日常治疗以无线方式进行,无需任何额外的手术或中断小鼠的正常活动。这些结果表明该治疗方法在临床 GBM 治疗应用中的有效性,特别是当它与标准治疗方式(如化学疗法和放射疗法)以及研究疗法(如免疫疗法)相结合时。
此外,该研究论文也是缅怀已故的国际著名医学影像、分子影像巨匠Sanjiv Sam Gambhir教授,他在准备手稿期间因癌症去世。而且他年轻的儿子也曾因脑胶质瘤去世。他曾全身心地投入到拯救儿子的努力中,尽管他非常了解胶质母细胞瘤患者的治疗结果,但他仍然坚信:不止于此,还可以试试。
这一精神仍然鼓励着他的团队,他们将不同领域的尖端工具结合起来,以新的方式应对这一致命疾病。

Sanjiv Sam Gambhir教授,美国医学科学院院士、斯坦福大学医学院放射学系主任、分子影像中心主任。在Science、Nat Biotechnol、Nat Med、Nat Nanotechnol、Nat Method、Ca-Cancer J Clin等国际顶级期刊发表论文600余篇,是分子影像学领域 的国际领军专家。其团队主要研究方向是分子影像探针的研发,在肿瘤的早期检测、早期成像及治疗方面处于国际顶尖水平,特别是在药物的临床转化和应用领域有着卓著的成绩。
参考文献:
Arami, H., Kananian, S., Khalifehzadeh, L. et al. Remotely controlled near-infrared-triggered photothermal treatment of brain tumours in freely behaving mice using gold nanostars. Nat. Nanotechnol. (2022).
https://doi.org/10.1038/s41565-022-01189-y











