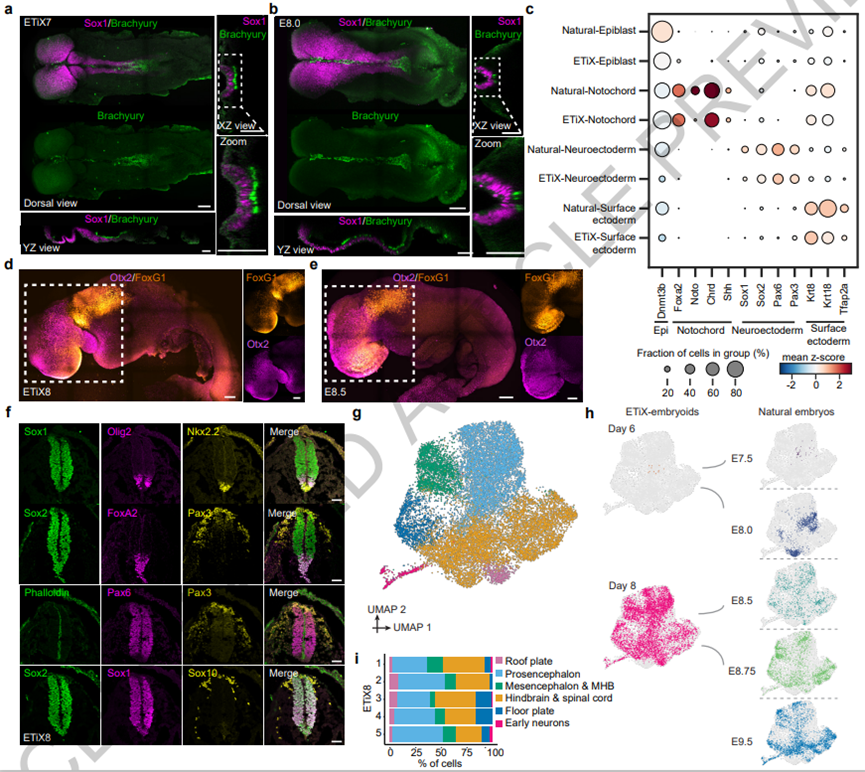
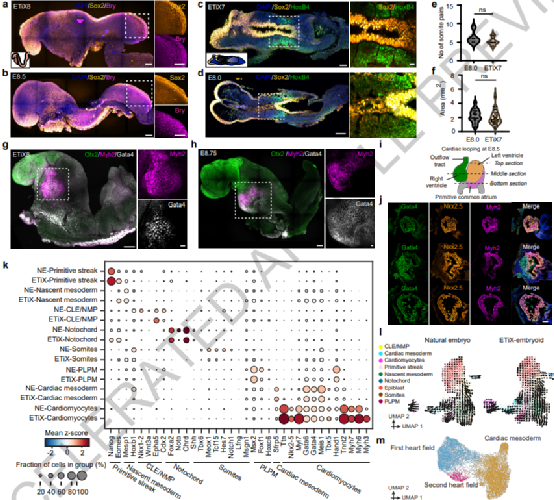
胚胎干细胞(ESC)可以在体外经历哺乳动物胚胎发生的许多方面,但它们的发育潜力通过与胚胎外干细胞(包括滋养层干细胞 TSC、胚胎外内胚层干细胞和诱导型 XEN细胞)的相互作用而大大扩展。在自然发育过程中,合子发育成外胚层,形成生物体;胚胎外内脏内胚层(VE),对卵黄囊起作用;以及胚胎外胚层(ExE),其有助于形成胎盘。与这三个谱系相对应的干细胞提供了多种成分,这使人工胚胎发育程度有可能向前迈出一步。来自英国剑桥大学与美国加州理工学院的Magdalena Zernicka-Goetz带领其团队利用小鼠ESCs、TSCs和iXEN三种细胞体外组装了干细胞衍生胚胎,并表明它们再现了8.5天子宫内的整个自然小鼠胚胎发育。该胚胎模型显示了定义上的前脑和中脑区域头褶,并形成了跳动的心形结构,包括神经管和体节的躯干,含有神经中胚层祖细胞、肠道和原始生殖细胞的尾芽。这个完整的胚胎模型在胚胎外卵黄囊内发育并形成血岛。重要的是,作者团队证明了由Pax6敲除胚胎干细胞与野生型TSC和iXENs聚集而成的神经发育胚胎模型再现了天然存在的Pax6基因敲除胚胎中发生的神经管腹侧结构域扩张。因此,这些完整的胚状体是剖析不同谱系和基因在发育中的作用的强有力的体外模型。该结果证明了胚胎和两种类型的胚胎外干细胞的自组织能力,通过原肠胚形成、神经形成和早期器官发生来重建哺乳动物的发育过程。作者团队接种了ESCs、TSCs和iXEN细胞,使其自组装,并在第4天将具有正确植入后形态的ETiX胚胎状体转移到悬浮培养中(图1a)。在第5天,ETiX胚状体具有前羊膜腔(由ESC和TSC隔室中的腔合并而成)、完全迁移的AVE(在ESC和TSC隔室的边界处)和原肠胚(如上皮到间充质的过渡以及ESC和VE样层之间细胞层的形成所示)ETiX胚状体原肠胚与天然原肠胚极为相似(图1b,c),尽管ETiX胚胎状体在大小上表现出更大的变异性。引人注目的是,在第7天,在静止条件下培养的神经发育ETiX胚状体显示出前后轴,分叉的神经褶皱延伸到神经管中并最终形成尾芽,其形态类似于E8.0自然胚胎的早期头褶阶段。在此之后,尾芽与尿囊组织连接,尿囊组织与发育中的绒毛膜连接(图1c)。这些条件允许ETiX胚状体在原肠胚形成和神经形成之后发育。正如预期的那样,随着时间的推移,ETiX胚胎表现出细胞类型复杂性的增加,相应于分化组织和器官的形成。重要的是,所有已鉴定群体的细胞类型复杂性和时空成熟度的增加在自然和ETiX胚胎中具有可比性,表明神经发育胚胎遵循类似的发育时间线。例如,两个系统都显示了三个胚层及其衍生物(神经外胚层、表面外胚层和肠道祖细胞)的发育,器官发生(心肌细胞)的开始,以及羊膜和尿囊等胚胎外组织的形成。神经发育胚状体概括了神经发育胚的多个组织产生,这不仅通过其形态,而且还通过其细胞类型特异性基因表达表现出来。为了检测胚状体中的神经发育,通过免疫荧光分析了成熟的神经外胚层标记物的表达。Sox1和Sox2在第7天沿神经发育胚状体的整个前后轴以类似于自然E8.0胚胎的模式在神经上皮细胞群中表达(图2a,b)。有助于中脑和前脑形成的转录因子Otx2在神经发育第8天ETiX胚胎的头褶的最前三分之一中显示出限制性表达(图2d,e)。该区域对应于E8.5处的天然小鼠胚胎的前脑和中脑。神经发育第8天胚胎体也在与天然E8.5胚胎相同的区域表达转录因子FoxG1,该转录因子在大脑发育中发挥重要作用(图2d、e)。由Otx2表达划分的大脑区域在自然胚胎和ETiX胚状体中相似。第8天神经发育胚状体的神经管闭合,并在神经管内显示出不同的神经祖细胞结构域。Foxa2在神经管腹侧中线的细胞中表达,标志着底板细胞群(图2f),而Pax3在背侧神经管、体细胞中胚层和神经嵴细胞中表达(图2f)。Sox10表达证实了神经嵴细胞的身份,这些细胞从神经管中移位,好像经历了自然大脑发育过程中发生的分层和迁移(图2f)。为了测试神经发育胚状体的神经管是否以与自然胚胎的神经管相同的方式响应发育,用不表达Pax6的转基因ESC系中生成了胚状体。与Pax6敲除天然胚胎的发育一致,Pax6基因敲除胚状体在神经外胚层中Sox1阳性细胞的总数没有变化,但显示Nkx2.2阳性细胞的比例增加,表明神经管的腹侧结构域扩大(图3a,b)。为了确定Pax6缺失的其他发育后果,检查了在没有Pax6的情况下转录水平的整体变化,发现与神经元形成、轴突发育和形成相关的转录物富集(图3c),与已发表的结果一致。在自然胚胎发生过程中,神经中胚层祖细胞(NMPs)与神经管和近轴中胚层的衍生物相关。NMP标记物Sox2和Brachyury在跨越神经发育第8天ETiX胚胎的尾芽后部区域的结构域中表达(图4a)。轴旁中胚层产生体细胞,体细胞是沿着胚胎的前后轴形成的成对细胞块,是骨骼肌、血管和皮肤的节段形成所必需的。在第7天ETiX胚状体和自然E8.0胚胎中,在Sox1/Sox2阳性神经管群的两侧观察到表达同源盒蛋白HoxB4的体细胞对(图4c、d)。ETiX胚状体和自然胚胎中体细胞的数量和面积的定量显示两者之间没有显著差异(图4e,f)。原肠胚形成的原始条纹中也出现了一组独特的细胞,这些细胞将要形成心脏。在自然胚胎中,这一发育事件发生在E8.0左右,当心脏中胚层分化为心肌细胞时,心跳继以出现。成功观察到第8天神经发育胚状体中脑区下方形成搏动结构。神经发育胚状体的该搏动区域以与自然胚胎相似的时空分布表达心脏发育所需的肌球蛋白重链II(Myh2)和转录因子Gata4(图4g,h)。第8天神经发育胚胎中所示切片的免疫染色显示Nkx2.5、Gata4和Myh2三重阳性(图4i,j)。但是与自然胚胎相比,ETiX类胚胎的心脏结构域面积减少。在观察到外胚层和中胚层的广泛发育和形态发生后,神经发育胚状体显示出内胚层的发育,从而形成肠道和相关器官。E8.5自然胚胎和第8天ETiX胚状体的矢状截面显示存在前肠和后肠袋(图5a,b)。除了在大脑和神经管中表达外,转录因子Sox2也在自然胚胎的前肠中表达,这种表达模式在神经发育胚状体中是保守的(图5a,b)。同样,Sox17在自然胚胎和神经发育胚状体的后肠中表达(图5a,b)。然而,在观察的时间范围内,ETiX类胚胎的肠道发育不如自然胚胎广泛。虽然Gata4在自然胚胎和ETiX胚状体的心脏中同样显著地表达,但它在自然胚胎的后肠中表达,但在ETiX胚胎状体中不表达(图5a,b)。scRNA分析、RNA速度分析与潜伏期分析综合表明,ETiX胚状体的肠道形成可能与其自然对应体的时间相似,但在发育轨迹上存在一些差异。原始生殖细胞(PGC)出现在外胚层的近端-后部区域,大约与E6.5小鼠胚胎中开始表达的时间相同。以Stella表达为特征,在第6天ETiX胚状体的ESC-TSC边界检测到该表达,类似于E7.5自然胚胎(图5e)。在ETiX胚状体发育的后期时间点也可检测到PGC。在第7天和第8天,在ETiX胚状体的尿囊附近发现PGC,类似于E8.0时的自然胚胎。无法在单细胞数据集中检测到PGC,这可能反映了它们的数量非常低。ETiX胚状体在类似羊膜和卵黄囊的膜内发育,为胚胎提供营养,直到胎儿-母体循环建立。在发育过程中,卵黄囊分别来源于壁内胚层和内脏内胚层(VE)。在ETiX胚状体中发育的卵黄囊的胚外部分附着在类似绒毛膜和尿囊的结构上(图6e)。卵黄囊支持胚胎中的原始造血,引人注目的是,在第8天,在神经发育胚状体的卵黄囊中胚层和尿囊底部观察到Runx1阳性血岛(图6f)。最后,作者团队探究确定ETiX胚状体是否也能发育形成功能性胎盘所需的细胞群。在ETiX胚状体中,可以观察到滋养层前体的持续存在,就像在自然胚胎中一样,分裂成ECP和绒毛膜谱系;然而,后者没有与自然胚胎的绒毛膜谱系完美地聚集(图6g,h)。此外,由于ECP基因的表达改变或缺失,ETiX胚状体中的ECP谱系未完全发育,催乳素基因表达的缺失表明滋养层巨细胞和海绵滋养层细胞缺失(图6i,j)。该分析表明,虽然绒毛膜谱系的发育已基本完成,但源自ECP的胚外谱系在ETiX胚状体中基本缺失。在这里,作者团队展示了组装小鼠胚胎和胚胎外干细胞以形成胚胎模型,允许人工胚胎发育大脑、神经管、心脏、前肠、体节、尿囊、原始生殖细胞和卵黄囊结构。这种胚胎模型能够完全通过这三种类型干细胞的自组织实现这一点,而不需要提供任何额外的外部信号诱导。与其他干细胞衍生的胚胎模型不同,神经发育胚状体以与自然胚胎非常相似的方式进行头褶结构的形态发生。这些事件一起使原始条纹之前的区域能够正确地引导前脑和中脑的形成。ETiX胚状体的自然原肠胚化运动使其能够进行神经形成,形成神经管,开始体细胞发生,并产生包括心形结构在内的中胚层结构。虽然ETiX胚状体的胚胎谱系非常接近自然发育,但胚外谱系显示出一些偏差。这可能与缺乏与母体环境的接触相关。将胚胎干细胞重新编程为滋养层/滋养层谱系是生成完整胚胎模型的一种有价值的解决方法,但目前研究进展被限制,仍然需要进一步优化。重要的是,作者团队能够在神经发育胚状体中复制Pax6敲除的结果,这说明了这种完整胚胎模型在不需要实验动物的情况下剖析调节发育的遗传因素的潜力。预计该系统将广泛应用于解剖学分子途径研究和筛选影响胚胎发生的化学物质。由于ETiX胚状体模型囊括了发育的诸多生理过程,因此它们为揭示发育和疾病机制提供了重要平台。
Gianluca Amadei, Charlotte E Handford, Chengxiang Qiu, et al. Synthetic embryos complete gastrulation to neurulation and organogenesis. Nature. 2022 Aug 25.
https://www.nature.com/articles/s41586-022-05246-3