分子捕捉键在生物学中无处不在,对于白细胞外渗和细胞机械传感等过程至关重要。与普通(滑动)键不同,捕捉键在张力下会加强。当前的范式是该功能提供“按需强度”,从而使细胞能够在压力下增加刚性。然而,捕获键通常比滑动键弱,因为它们具有通常被掩埋的神秘结合位点。
鉴于此,荷兰原子与分子物理研究所Gijsje H. Koenderink、Sander J. Tans和普渡大学Taeyoon Kim等研究人员表明捕获键使重组的细胞骨架肌动蛋白网络比滑动键更强,即使单个键时候是较弱的。
模拟表明,滑动键仍然被困在无应力区域,而弱结合允许捕捉键通过移动到高张力区域来减轻裂纹萌生。这种“按需解离”解释了细胞如何将机械强度与形状变化所需的适应性相结合,并且与捕获结合受损的疾病相关。研究人员推测,捕获键是创造类似生命的材料的关键。

弱捕获键和强滑动键
研究人员利用与遗传性疾病肾局灶节段性肾小球硬化 1 型相关的肌动蛋白结合蛋白 α-actinin-4及其 K225E 点突变体来确定捕捉键在肌动蛋白网络机械特性中的作用。肌动蛋白与其他细胞骨架蛋白一起是细胞力学的关键决定因素。为了分离捕捉键在肌动蛋白力学中的作用,研究人员从纯化的成分中重构了肌动蛋白网络。
基于晶体结构,先前推测力会激活 α-actinin-4 的一个神秘的肌动蛋白结合位点,因此表现得像一个捕捉键。此外,有人提出隐秘的肌动蛋白结合位点被 K255E 点突变暴露,增加了 α-actinin-4 的结合亲和力,但也消除了它的捕获键行为。为了直接测试这个想法,研究人员通过 DNA 手柄将单个 α-actinin-4 分子连接到聚苯乙烯珠子上,并探测它们与荧光标记的肌动蛋白丝的结合。使用光镊和荧光成像验证了早期推测,即 α-actinin-4 形成弱捕获键,而 K255E 点突变体形成强滑动键。

图|肌动蛋白丝结合的单分子测量揭示了 WT α-actinin-4 的捕获结合,而不是 K255E 突变体。
捕获键单键虽弱,但网络更强
捕获键比滑动键弱的观察提出了一个问题,它们是否也形成了较弱的网络。为了测试交联肌动蛋白网络的强度,研究人员在流变仪的锥体和板之间将肌动蛋白与任一交联剂共聚,并通过旋转锥体及时线性增加机械载荷(剪切应力),直到网络因网络变形而破裂(应变)被记录下来。研究发现,在 10 °C 下,由 α-actinin-4 捕获键交联的网络不仅比任何一种滑移键网络更易变形(断裂应变为 221 ± 16%),而且更强(断裂应力24.5 ± 2.7 Pa)。
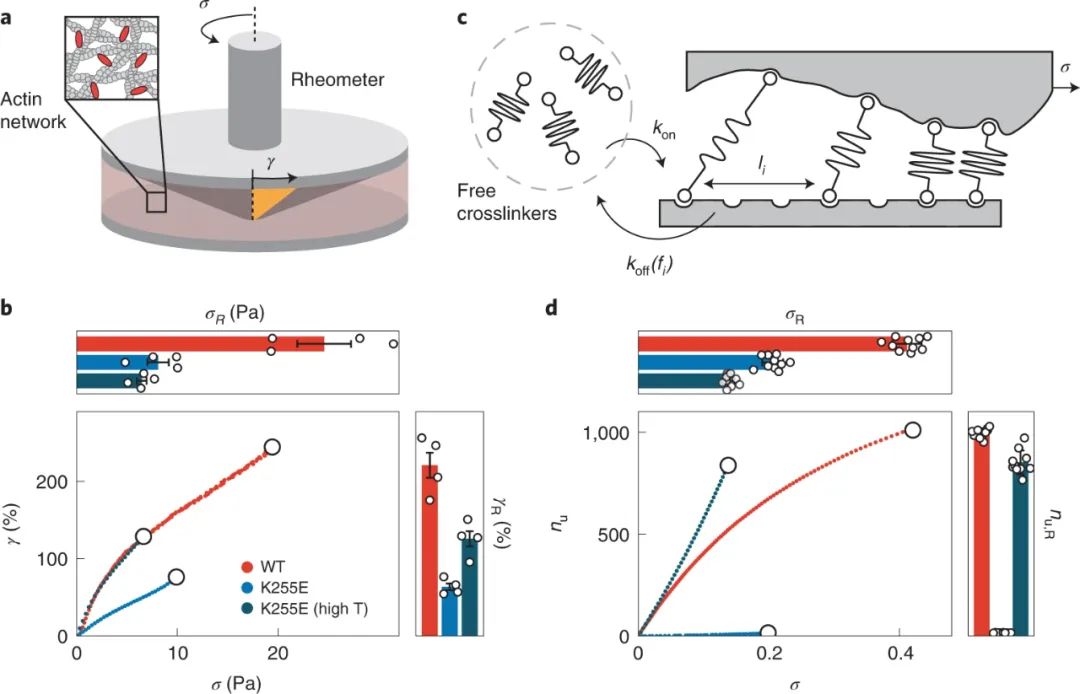
图|捕捉键同时增强细胞骨架肌动蛋白网络的机械强度和可变形性
模型模拟验证
捕捉键如何摆脱正常(滑动)键固有的强度和可变形性之间的权衡?为了回答这个问题,研究人员开发了一个最小模型。模拟表明,较弱的捕捉键共同使网络比滑动键网络更强(在几乎两倍的压力下破裂),但更易变形(在破裂前有十倍的键周转)。该模型还证实了实验观察结果,即在保持滑动键响应的同时简单地降低键寿命会导致较弱的网络。
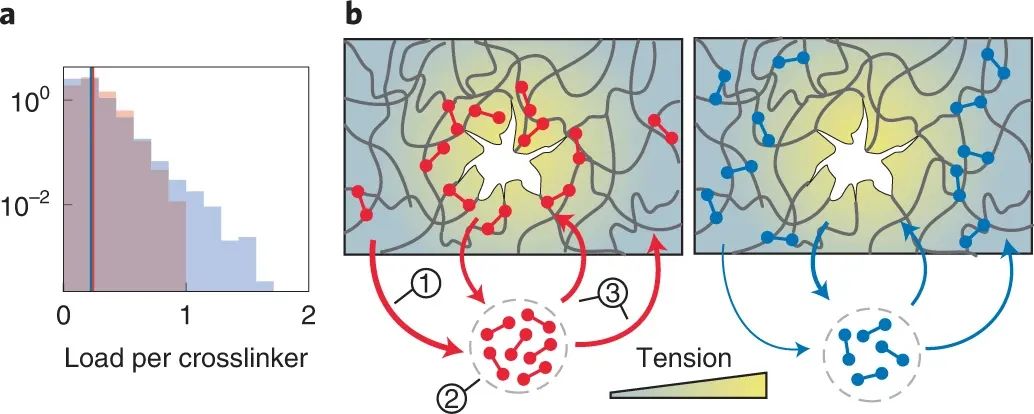
最小模型表明,捕获键通过重新分配到紧张区域来加强网络
机制分析
为了确定捕捉键显著机械优势背后的机制,研究人员量化了每个单独交联剂的负载的稳态分布。在给定的宏观载荷下,与滑动键相比,捕捉键的每个键的平均力仅略高。然而,捕捉键的力分布比滑动键的分布要窄得多,这意味着滑动键网络包含更多的承受高载荷的键,因此更容易断裂。值得注意的是,与滑动键相比,断裂捕获键网络需要两倍大的间隙。这些发现表明,由于在较低负载下的寿命较短,捕获键会从低应力区域“按需解离”,从而释放可以在高应力区域重新结合的交联剂,从而防止裂纹的产生。模拟还表明,当捕获键不动时,捕获键相对于滑动键的机械优势确实会丧失。
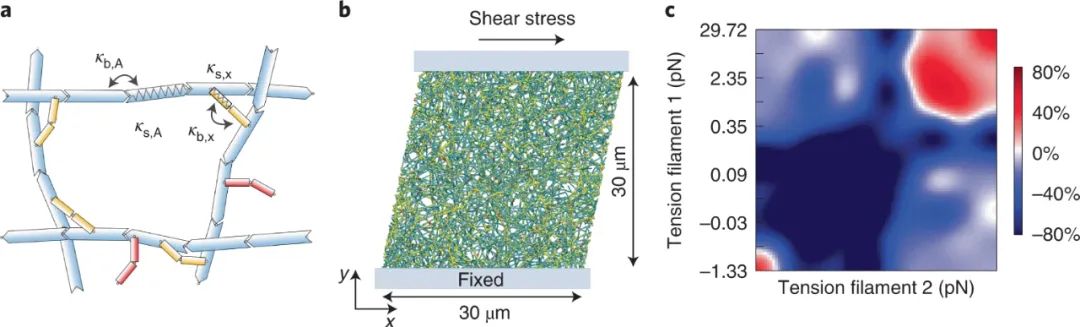
图|详细的肌动蛋白网络模拟证实了通过按需解离来加强捕获键网络
小结:
该工作揭示了细胞骨架中捕获键的新作用,即同时提高其机械强度和变形能力。与通常的直觉相反,捕捉键按需提供强度,该模型表明,它们形成强大的网络,因为按需解离使它们能够重新分布到紧张区域,从而推迟裂纹萌生。这一机制可能也适用于活细胞,因为α-肌动蛋白-4在肌动蛋白皮质内是可移动的。α-肌动蛋白-4的力传感器类似于其他蛋白的力传感器,可以开发并以单分子分辨率进行解析,以直接可视化重组肌动蛋白网络和活细胞中捕获和滑动键的负荷依赖性重分布。
该研究结果还表明,捕捉键在细胞骨架和细胞界面中广泛存在,以打破这种可变形性/强度折衷,研究更多交联剂和粘附素的力依赖性结合将很有趣,例如细丝蛋白和免疫球蛋白样细胞粘附分子。最后,本文的研究结果提供了一种受细胞启发的途径来制造水凝胶材料,这些材料既坚固又足够可变形,可用于再生医学。近年来,聚合物界的理论和实验工作激增,以创造更坚韧的水凝胶,例如,通过在水凝胶中加入刚性元素。然而,这些方法主要集中在防止裂纹扩展而不是裂纹萌生。防止裂纹扩展可以很好地吸收有限量的机械能,但在恒定应力的情况下提供的优势有限。对于未来的工作,将裂纹萌生和扩展的缓解策略结合起来会很有趣。最近发现了捕捉键的合成类似物,并为开发高动态但强大的仿生材料提供了一个极好的起点
参考文献:
Mulla, Y., Avellaneda, M.J., Roland, A. et al. Weak catch bonds make strong networks. Nat. Mater. (2022).
https://doi.org/10.1038/s41563-022-01288-0











