
第一作者:穆晓宇,王骏滢,何化
通讯作者:张晓东
通讯单位:天津大学
背景介绍
人工酶具有稳定性高、合成简单、成本低廉等优点,在疾病诊断和生物技术领域引起了人们的广泛关注。遗憾的是,人工酶的催化速率在很大程度上受限于其材料表面的电子转移,这极大地制约了人工酶的催化活性和生物活性。天津大学张晓东教授团队发现了一种具有超快电子转移和超高催化活性的低聚纳米酶(O-NZ)。研究结果显示,O-NZ表现出1.8 ns的超快核心电子转移,实现了较高的类超氧化物歧化酶(SOD)活性和可与天然酶媲美的类谷胱甘肽过氧化物酶(GPx)活性。同时,O-NZ在核心和表面基团之间也达到了1.2 ps的超快电子转移,从而可在几毫秒内清除O2•-、•NO 和 ONOO-自由基。动物实验发现O-NZ能使重度急性脑损伤(TBI)小鼠的存活率从50%提高到90%,并促进长期神经认知功能的恢复。生化实验表明O-NZ可通过核因子红血球-2相关因子(Nrf2)介导的血红素加氧酶-1(HO-1)表达上调来减轻急性神经炎症。这项工作清楚地表明,具有催化活性和选择性的超快纳米酶是治疗神经系统疾病的重要候选药物。
研究结果

图1:O-NZ的设计和表征:A/B/C 结构示意图;D 透射电子显微镜图;E 飞行时间质谱;F模型计算的同位素谱;G 紫外吸收和发射谱;H 拉曼光谱;I 傅立叶转换红外光谱;J/K/L X射线光电子能谱。
图1表明O-NZ具有超小尺寸和半导体特性,主要以多氮掺杂的石墨结构作为核心,以酰胺、羟基、吡咯N基团作为表面活性官能团。

图2:O-NZ的超快电子转移动力学测试:A 时间分辨光致发光光谱;B/C 瞬时吸收光谱;D/E 超快电子转移过程示意图。
图2表明O-NZ具有超快的电子转移特性。考虑到石墨碳核的本质,O-NZ的π-共轭域可以促进电荷转移和电子存储。此外,O-NZ的结构缺陷可以促进界面电子转移,O-NZ的表面官能团也可以作为电子给体。因此,O-NZ表现出1.8 ns的超快核电子转移,这可能决定了其类酶特性。同时,在核和表面配体之间发生了1.2 ps的超快电子转移,这可能决定了其自由基清除活性。

图3:O-NZ的RONS清除特性:A 不同纳米酶对ROS的总抗氧化能力的比较;B 不同浓度的O-NZ对ABTS•+的清除曲线;C/D O-NZ的类SOD/GPx活性;E/F/G/H O-NZ对不同自由基的清除实验;I O-NZ清除RONS和类酶的路径示意图。
基于上述电子转移研究,另一方面我们发现O-NZ其对RONS具有很强的供电子能力,其总抗氧化活性优于其他碳纳米酶类似物(L-NZ、C-NZ和G-NZ)大约一个数量级(图 3A)。O-NZ表现出优异的类SOD和类GPx活性(图 3C/D),同时对RONS具有较高的清除活性,特别是对活性更高的O2•−和•NO和ONOO−(图 3E/F/G/H)。

图4:O-NZ减少小鼠TBI后继发性损伤的扩散:A O-NZ治疗后TBI小鼠脑T2加权MRI;B 量化不同治疗组继发性损伤的体积;C O-NZ治疗后TBI小鼠在30天内的存活率;D/E 脑EB染色和血脑屏障通透性分析;F/G TUNEL检测损伤后脑组织中的凋亡细胞。
该研究进一步构建了TBI动物模型并考察了经O-NZ治疗后TBI小鼠存活率和继发性损伤扩散水平。结果表明O-NZ 治疗能够有效减少继发性损伤的扩散(图4A和B),显著提升TBI小鼠的存活率(图4C),加速血脑屏障的修复(图4D和E)。
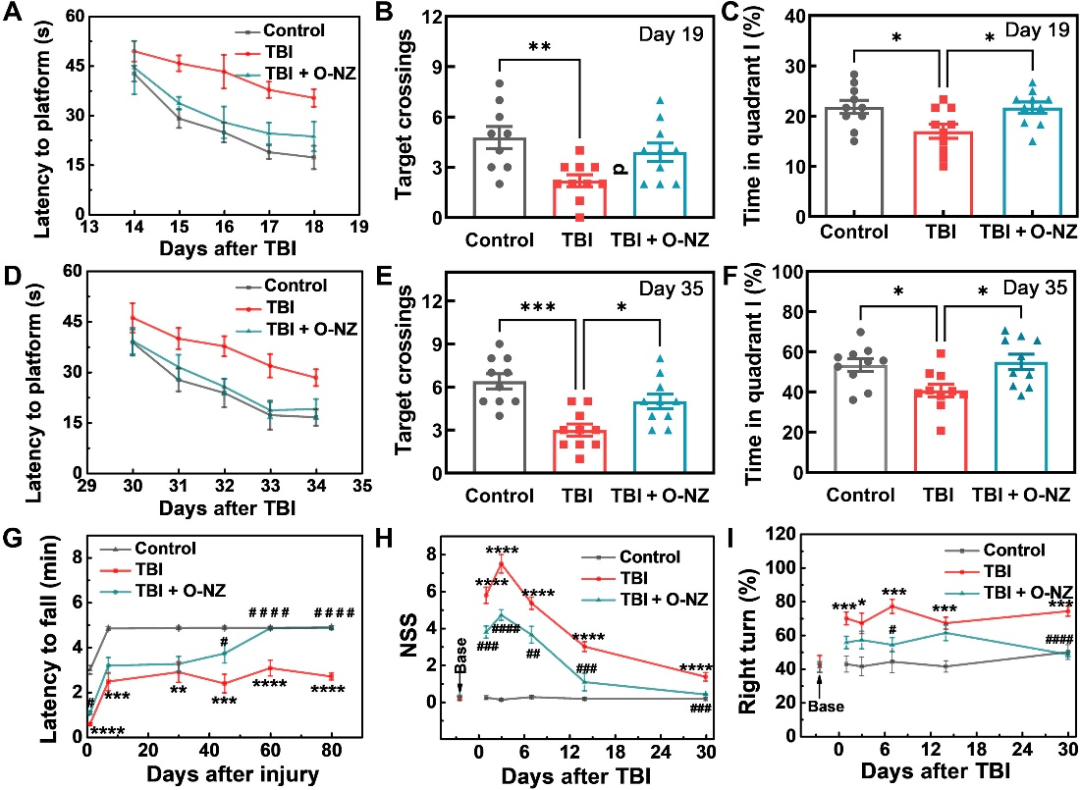
图5:O-NZ治疗后的小鼠行为学:A/D小鼠不同时间段训练期间的变化;B/C/E/F小鼠不同时间段测试期间的变化;G 跑步训练测试;H神经损伤严重缺损评分;I 转角实验。
为了进一步评估O-NZ治疗对TBI后神经系统恢复的促进作用,该研究对小鼠进行了一系列行为测试。结果表明O-NZ治疗有助于神经功能缺损评分(NSS)、运动功能、空间学习和记忆方面的明显恢复。
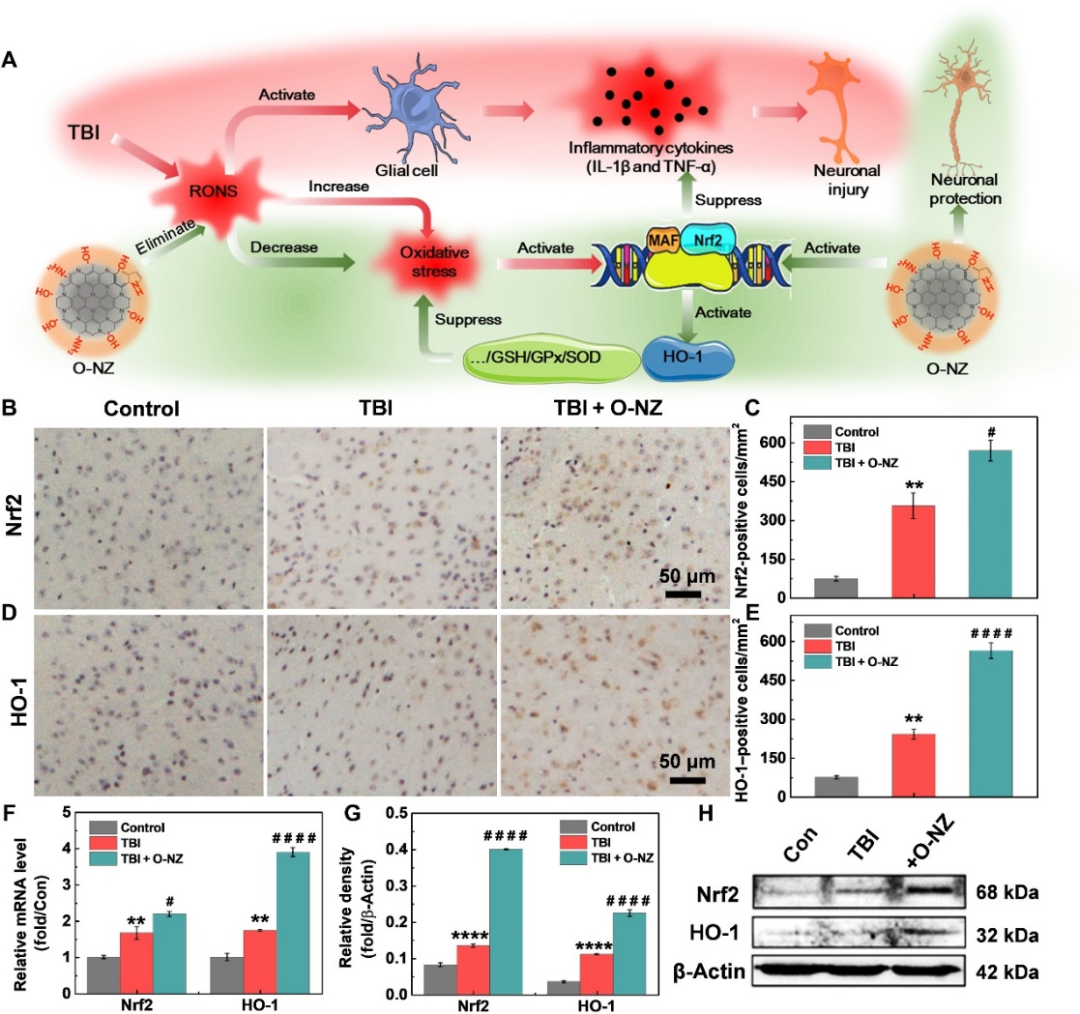
图6:O-NZ治疗脑损伤的分子机制:A 通过Nrf2介导上调HO-1表达的O-NZ治疗TBI的分子机制示意图;B/C/D/E Nrf2和HO-1的免疫组化分析;F Nrf2和HO-1的mRNA水平;G/H Nrf2和HO-1的WB水平。
最后进行了系统的定量聚合酶链反应(RT-qPCR)、Western blot实验和免疫组化(IHC)染色(图6)分析,结果表明O-NZ通过上调Nrf2和HO-1的表达改善氧化应激和神经炎症。
研究总结
1. O-NZ通过超快电子转移表现出高的总抗氧化活性和类SOD/GPx的催化选择性。
2. O-NZ对高活性O2•-、ONOO-以及•NO表现出优异的清除能力。
3. O-NZ可将急性TBI小鼠的存活率从50%提高到90%,并且有效改善TBI小鼠的长期行为,包括空间记忆、认知和功能性肢体控制等。
4. O-NZ通过激活Nrf2/HO-1信号通路缓解神经炎症。
参考文献:
Xiaoyu Mu, et al. An oligomeric semiconducting nanozyme with ultrafast electron transfers alleviates acute brain injury, 2022, Sci. adv.
DOI: 10.1126/sciadv.abk1210











