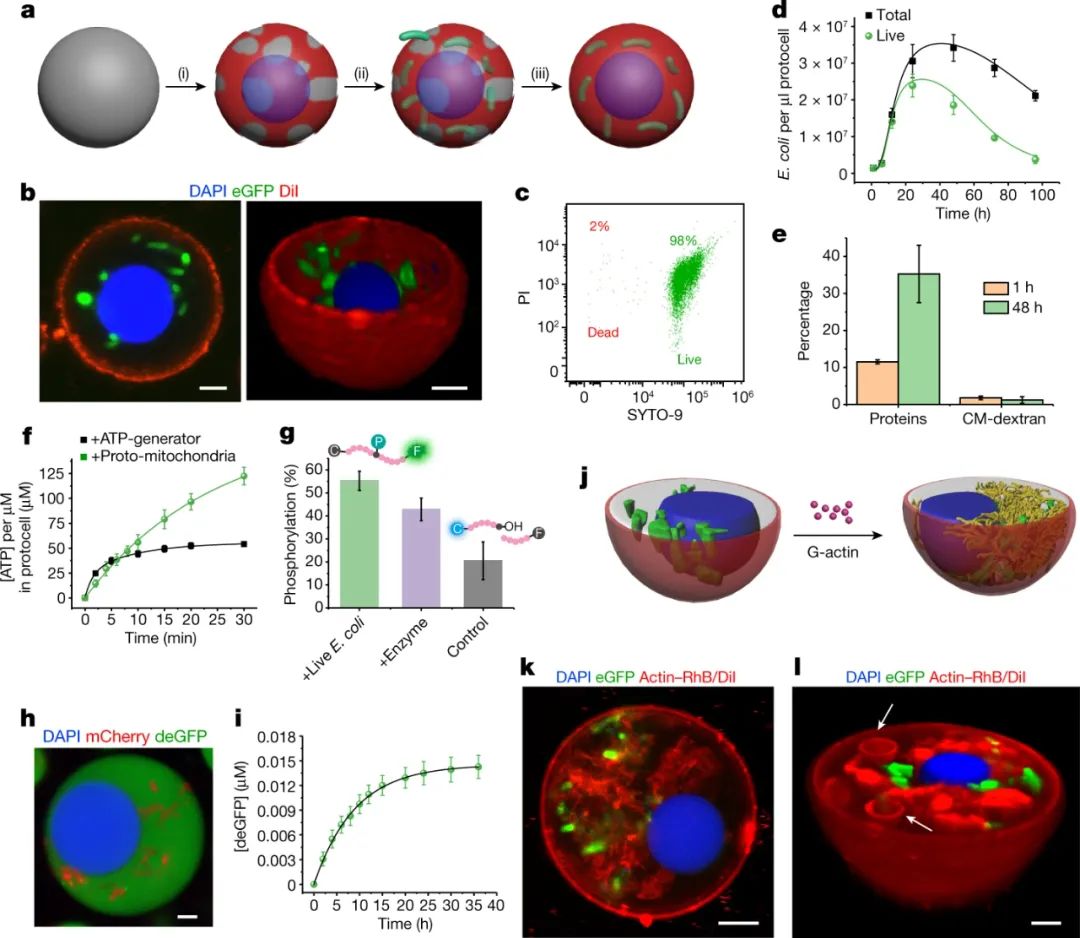
在合成细胞中建立逼真的功能是一项跨越多个领域的全球性重大挑战,包括合成生物学、生物工程和生命起源研究。到目前为止,合成细胞系统(原始细胞)的工程主要使用自组装囊泡、半渗透微胶囊和无膜或涂层凝聚层微滴。这些隔室为生物和非生物成分的封装和交换提供了一种可控的介质,这些成分经过实验选择,以证明合成细胞模型中的基因表达、酶催化和核酶活性等单一功能。由于在接近平衡的条件下通过传统的微区室化方法难以建立足够的组成多样性和化学互补性,因此在这些构建体中实现高度的组织和功能复杂性在方法上是有难度的。目前的困难在于在纳米尺度上组织功能特征,例如酶,并确保所有组件之间的网络连接。鉴于此,英国布里斯托大学Stephen Mann、Mei Li等人开发了一种基于原核生物作为结构和功能构建块的第一代赋能原细胞的工程方法。他们通过在合成支架上组装分解的细胞片段,从而生产出功能和组成复杂的人造细胞,这让人联想到活细胞。这些发现使我们离可用于工业应用的类生命系统更近了一步,并朝着更好地理解生命本身的方向迈进了一步。

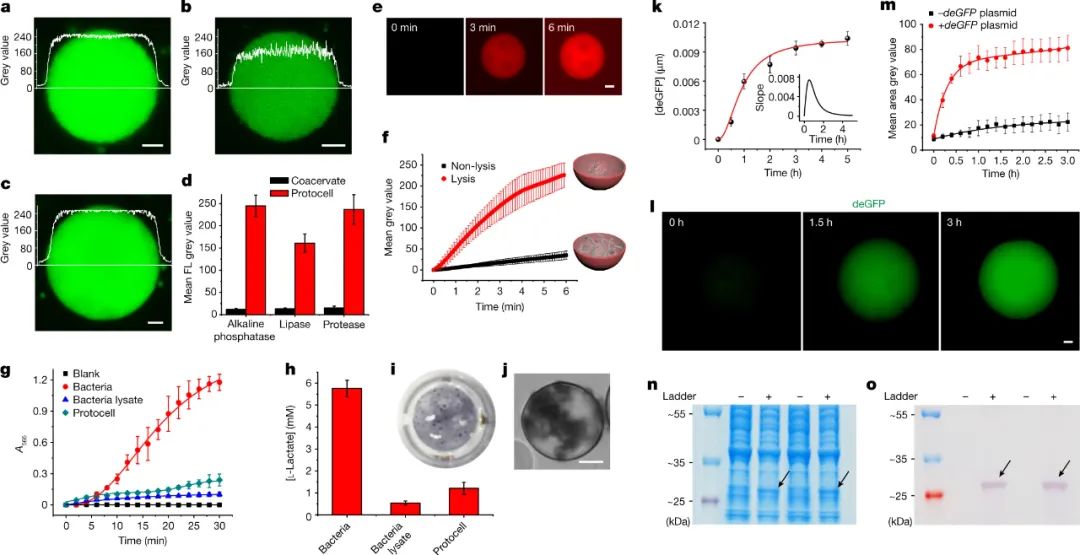
研究人员使用称为凝聚层的隔室来制造人造细胞的合成支架。凝聚层是由稠密液相制成的无膜液滴,可自发形成并从水溶液中分离出来——这一过程称为液-液相分离。其中,该凝聚层是通过合成聚合物(聚二烯丙基二甲基氯化铵(PDDA))和核苷酸分子 ATP 之间的缔合相互作用形成的。作者使用该平台捕获并破裂两种细菌的混合物,从而生成由具有外膜和内部子隔室的凝聚层组成的人造细胞。破裂的细菌细胞释放出它们所含的蛋白质和代谢物分子,其中大部分保留在致密的凝聚层核心中。这种创造性的方法导致活性酶定位在人造细胞的“细胞质”内。作者还证明,凝聚层核心能够利用细菌释放的蛋白质合成机器制造少量蛋白质——也就是说,它可以进行体外转录和翻译(IVTT)。
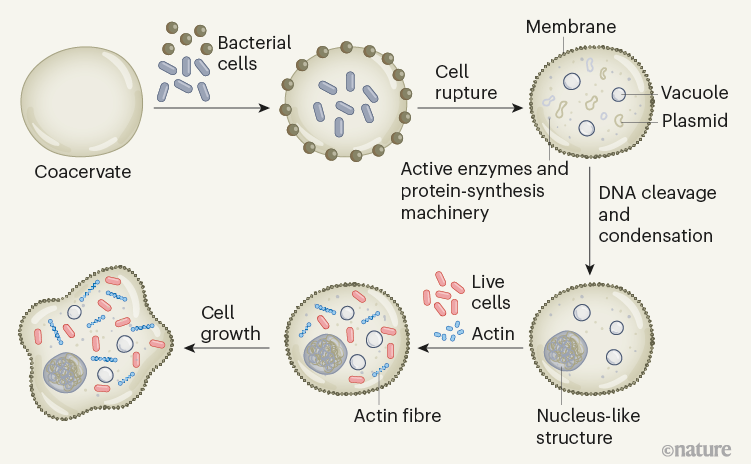
在目前的工作中,基本上整个人造细胞是一个凝聚体,而液-液相分离仅负责在天然细胞中的亚细胞区室(称为生物分子凝聚体)的形成。尽管如此,研究人员表明,亚细胞级别的组织活动也可以在他们的系统中实现。作者使用一种酶在人工细胞的“细胞质”中将细菌DNA切割成短链,然后添加带负电荷的聚合物和组蛋白(DNA 在细胞核中与之相关的蛋白质),从而使 DNA 凝聚成核状结构。这种类型的分层组织,其中一个凝聚相在另一个凝聚相中形成,以前在多相凝聚体中观察到过,并暗示了DNA在活细胞中可能是如何划分的。该人造细胞中的DNA核目前只是一个结构特征,因此下一个挑战将是将其用于特定功能。可能性是无限的。例如,通过一些优化,人们可以想象隔离的DNA作为基因回路或IVTT反应的有用起点。
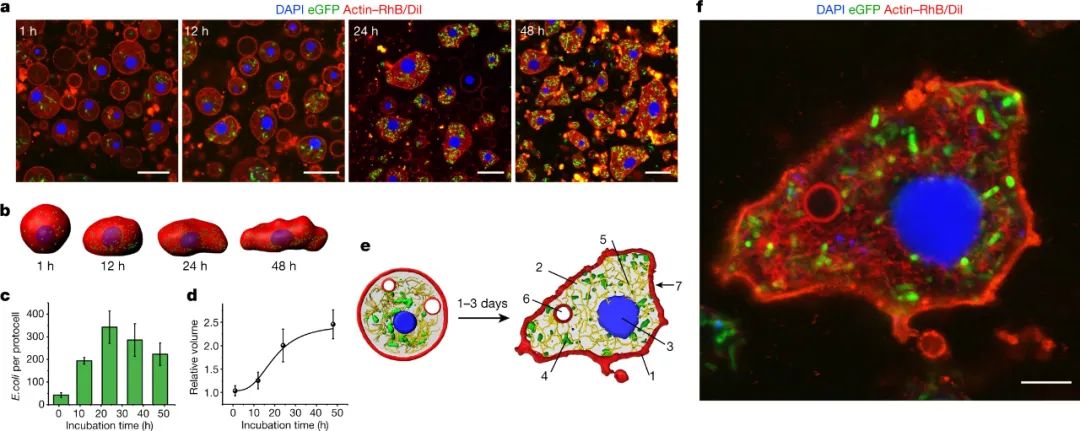
活细胞分裂繁殖,这需要每个细胞在分裂成两个之前改变形状。为了实现由膜结合囊泡组成的人工细胞的分裂,正在进行大量工作,许多研究小组正在研究细胞骨架(例如,赋予细胞形状的结构丝网络)中蛋白质的使用。然而,事实证明改变凝聚体的形状更加困难。研究人员表明,肌动蛋白是一种细胞骨架蛋白,可以在其人工细胞的“细胞质”中进行酶促聚合,从而产生丝状网络。然而,人造细胞的整体形态在此过程中保持球形。有趣的是,作者随后将活细菌封装在凝聚层内,并观察到人造细胞随着时间的推移变成不对称的形状,让人联想到变形虫等天然细胞的形状。虽然视觉上令人兴奋,但目前很难看出这种形状变化如何导致人工细胞分裂。研究人员使用生命系统作为人造细胞基础的看似简单的方法的一个主要缺点是所有生命形式都包含许多未知数。即使是2016 年Science上报道的“最小细胞”的基因组——它被设计成只包含被认为对生命至关重要的基因——也有很大一部分(约30%)的功能未知,而且细菌细胞比这更复杂,为了构建一个完全可控的人造细胞,有必要识别所需的组成部分并了解它们如何相互作用。目前,这项工作有趣地证明了生物化学可以在与天然细胞不同的条件下发挥作用。本文报道的活细胞和人造细胞的组合应该让我们都思考:什么是生命?科学家们通常使用还原论的方法,将生物定义为具有特定特征的生物——例如细胞和亚细胞区室化、新陈代谢、信息存储和处理以及再生能力。几种类型的人造细胞模拟了其中一些特征。然而,如果生命是由复杂的网络系统产生的一种新兴属性,那么人工细胞必须能够整合和连接上述的更多特征。该研究提供了一个可以实现这一目标的平台。他们目前的系统整合了活细胞的七个属性:外膜;拥挤的室内;进行级联酶反应的能力;蛋白质合成能力;具有不同子隔间的令人印象深刻的结构组织;原始细胞骨架;以及采用不对称蜂窝形状的能力。但是一个真正的生命系统还没有从试管中出现——该人造细胞相当于类细胞机器人。然而,新发现是该领域向前迈出的重要一步,证明了凝聚层在定位和整合包括活细胞在内的多种生物材料以制造人造细胞方面的能力。下一个挑战是建立逐步互联的网络,缩小人工细胞和活细胞之间的差距。1. Xu, C., Martin, N., Li, M. et al. Living material assembly of bacteriogenic protocells. Nature (2022).https://doi.org/10.1038/s41586-022-05223-w2. Life brought to artificial cells. Nature 2022.https://doi.org/10.1038/d41586-022-02231-8