造血人源化(Hematopoietic humanized, hu)小鼠(也称为移植了人类造血干细胞的免疫功能低下的小鼠)是研究人类免疫反应和疾病(如癌症和 COVID-19)的强大临床前模型。然而,在hu小鼠中模拟人类T细胞免疫一直具有挑战性,主要是因为 hu 小鼠缺乏人类胸腺(负责 T 细胞产生和选择的主要淋巴器官)。尽管内源性小鼠胸腺可以为人类 T 细胞发育提供有限的支持,但在小鼠胸腺中产生的人类 T 细胞不能正确地与其他人类免疫细胞结合,因此无法产生有效的免疫反应。现有的唯一解决方案是将人类胎儿胸腺片移植到hu小鼠体内,但这种方法受到伦理问题和组织稀缺的阻碍。使用可再生细胞来源(例如可诱导多能干细胞 (iPSC))生成人工人类胸腺,将能够在 hu 小鼠中构建功能性人类T细胞区室,并扩大该模型在生物医学研究和药物发现中的用途。胸腺包含两个主要的细胞区室:来自造血祖细胞(HPCs)的发育中T细胞的瞬时群体和包括胸腺上皮细胞 (TEC) 的驻留基质细胞。TECs在调节T细胞谱系分化和教育方面是必不可少的。鉴于此,匹兹堡Allegheny Health Network (AHN)的Yong Fan等人使用 3D 支架的组织工程方法,使得能够通过用分离的胸腺上皮细胞重新填充脱细胞胸腺支架来构建功能性小鼠人工胸腺。

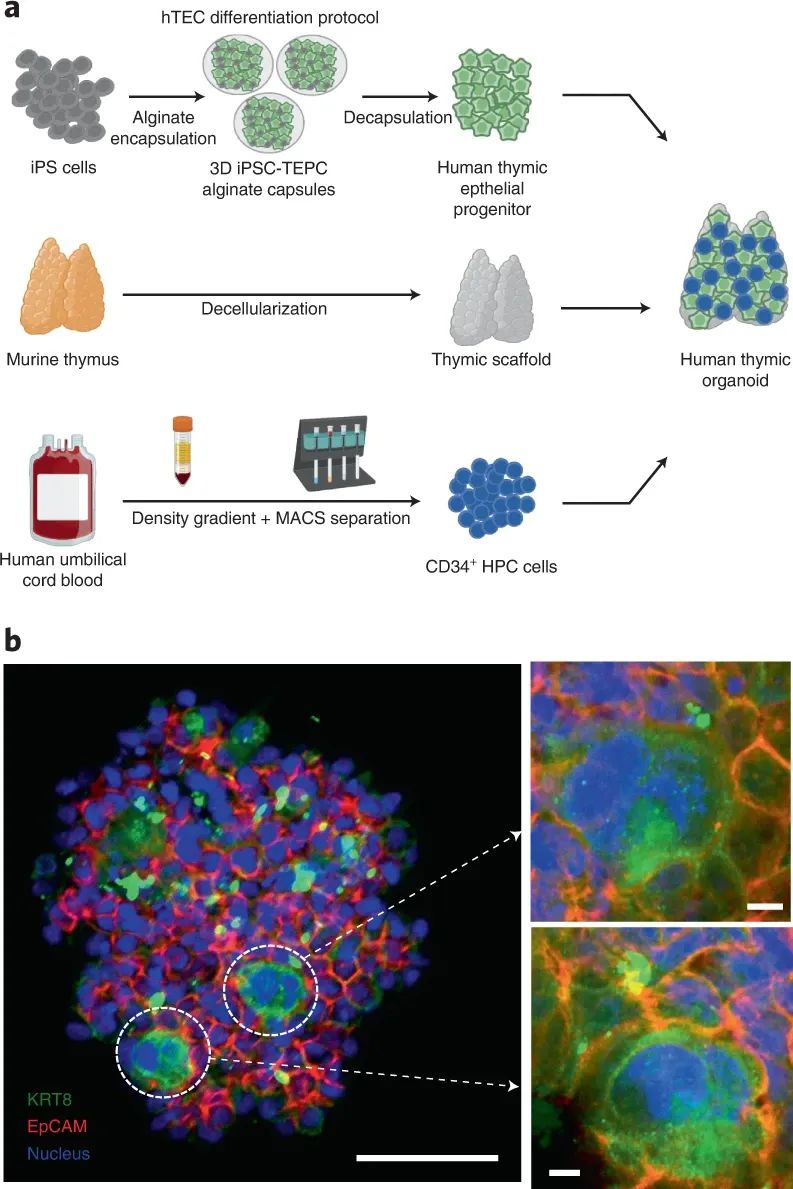
研究人员采用这种方法来生成人造人胸腺,为了克服人类TECs的可及性,研究人员使用多步诱导方案将 iPSCs 分化为胸腺上皮祖细胞 (iPSC-TEPCs)。使用 3D 藻酸盐封装技术来促进更有效的 TEPC 分化和成熟。用 iPSC-TEPC和HPC构建人造人胸腺,并测试其支持人类 T 细胞在 hu 小鼠中发育的能力。
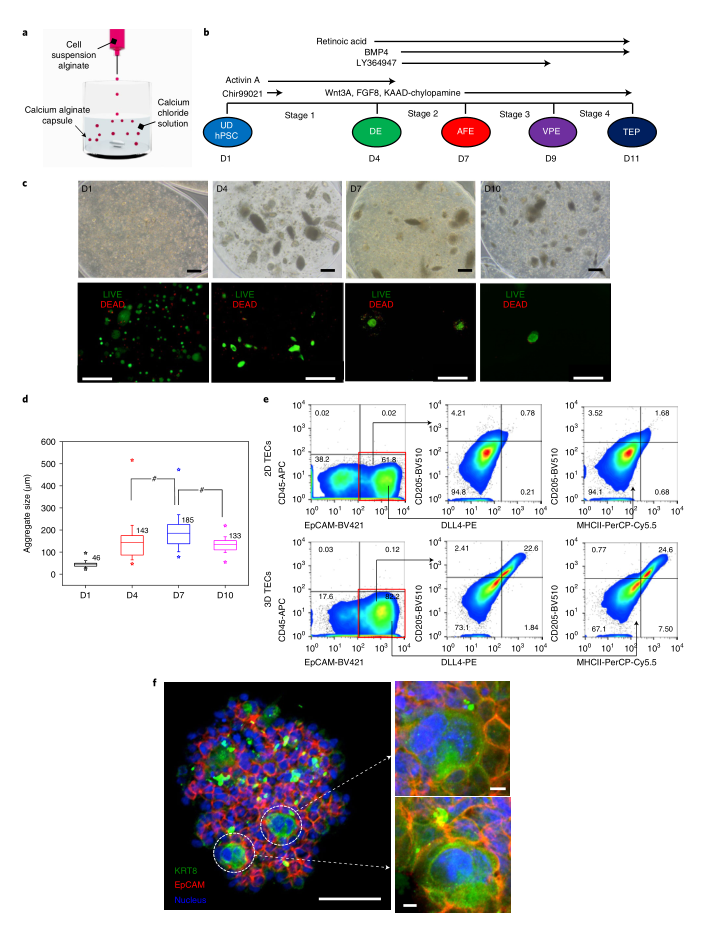
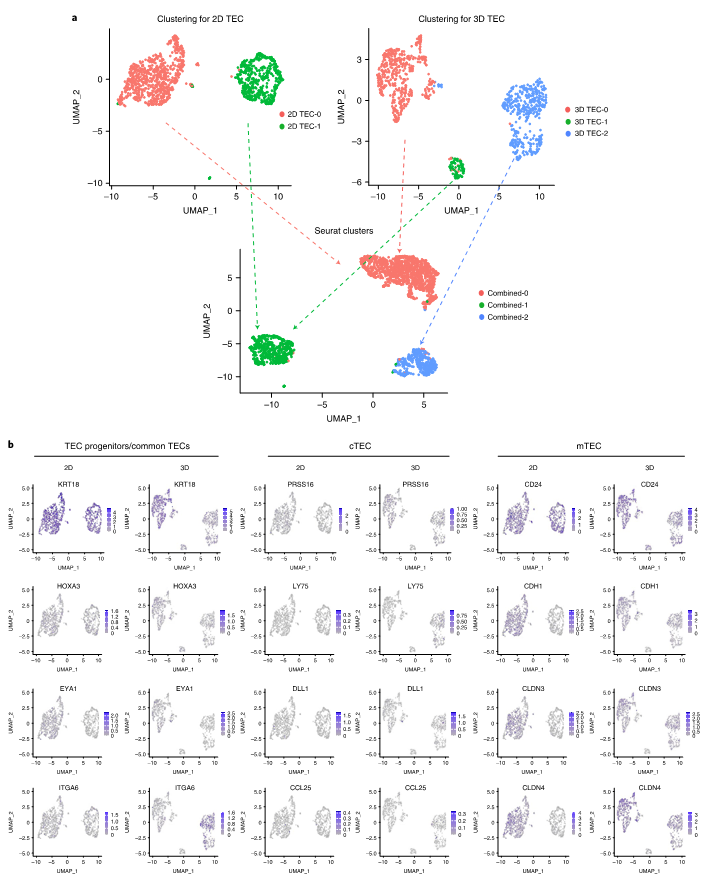
图|在 3D 藻酸盐水凝胶胶囊中将人类 iPSCs 分化为 TEPCs关键TEC标记(如 FOXN1 和 KRT8)的表达在 3D iPSC-TEPC 中显著高于源自 2D 分化的那些,证明了使用 3D 技术的优势。这些发现与iPSC-TEPC的单细胞转录组分析结果一致。对 T 细胞发育关键标志物的流式细胞术分析证明了人造人胸腺在体外支持 T 细胞谱系编程进展的能力。
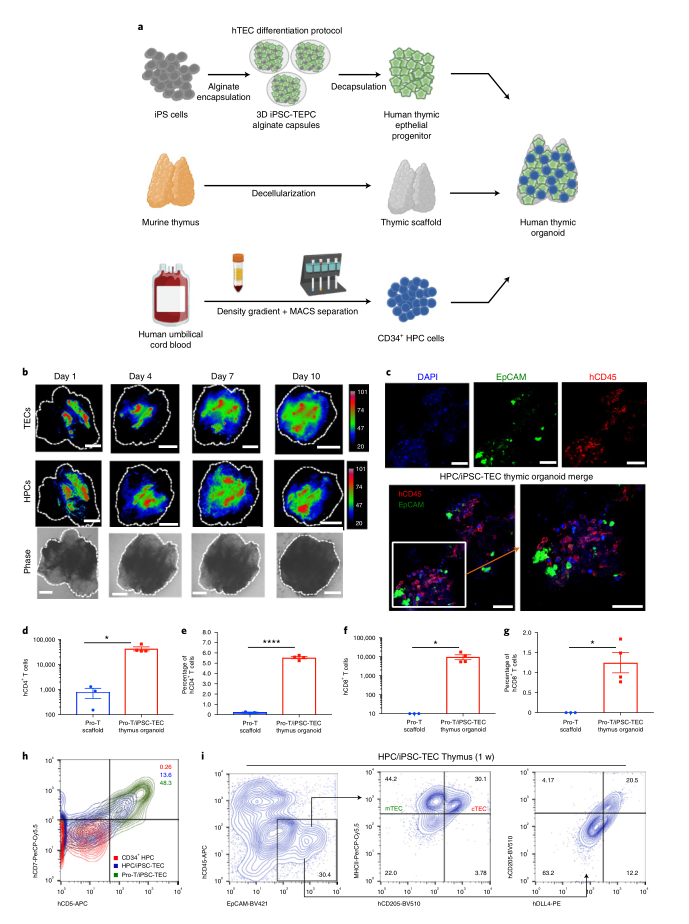
最重要的是,对移植了人类人工胸腺的 hu 小鼠的分析表明,人类 T 细胞的多样化群体的发展,表达了复杂的 T 细胞受体 (TCR) 库。T 细胞介导的细胞和或体液免疫反应,例如 TCR 参与时的促炎反应、同种异体肿瘤移植物生长的抑制和免疫球蛋白类别转换,在这些小鼠中得到恢复,进一步表明功能性人类 T 细胞区室的发展。
图|iPSC-胸腺类器官可以支持体外 T 细胞程序的进展
图|在 hu.Thor 小鼠中开发功能性人类 T 细胞亚群
将动物研究的结果转化为临床常常受到模型和人类之间物种特异性差异的阻碍。在植入人工人类胸腺的hu小鼠中生成功能性人类 T 细胞群将大大增加该模型研究人类适应性免疫反应的可及性,并加速临床前研究的转化。随着 iPSC 存储库的快速扩展,具有特定 HLA 成分的个体患者的 T 细胞免疫可以在 hu 小鼠中建模,以促进个性化医疗。从理论上讲,胸腺工程技术的改进将使人们能够从患者自己的 iPSC 中生成人造胸腺,用于治疗原发性和获得性免疫缺陷疾病。根据它们在胸腺中的定位,TECs 通常可以分为两个功能不同的子集:皮质 TECs 和髓质 TECs。该团队得下一个方法将侧重于复制人工胸腺的几何组织以改善其功能。iPSC-TEPC 将被诱导分化为特定的 TEC 子集。还将开发新的组织工程工具,以将 TEC 子集重新填充到胸腺支架内的特定区域。另一个重点领域将是改善 T 细胞和 B 细胞之间的相互作用,以在 hu 小鼠中获得更强大的适应性免疫反应。1.Zeleniak, A., Wiegand, C., Liu, W. et al. De novo construction of T cell compartment in humanized mice engrafted with iPSC-derived thymus organoids. Nat Methods (2022).https://doi.org/10.1038/s41592-022-01583-32.A tissue-engineered artificial human thymus from human iPSCs to study T cell immunity. Nat Methods (2022).https://doi.org/10.1038/s41592-022-01584-2












