1. Nature:甲壳素合成酶的结构表征与反应机理
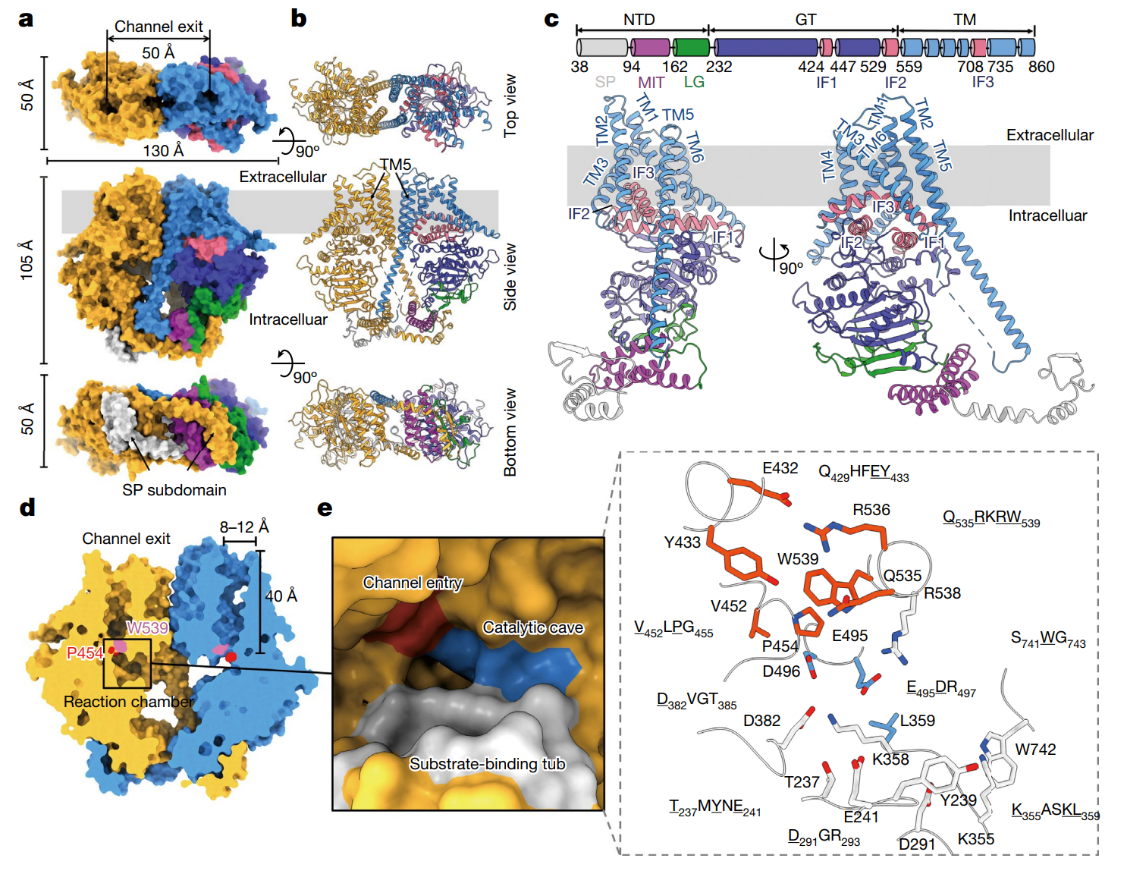
甲壳素是自然界中分布最广泛的氨基多糖,甲壳素是一种含有N-乙酰氨基葡萄糖结构的细胞外聚合物GlcNAc(N-acetylglucosamine),甲壳素的生物合成反应中的关键反应的催化剂是甲壳素合成酶(chitin synthase),是一种整合到膜上的糖基转移酶,能够从UDP-GlcNAc将GlcNAc转移到甲壳素的分子链。目前人们对这个反应过程并没有清楚的理解和认识。有鉴于此,中国农业科学院植物保护研究所杨青、中科院高能物理所龚勇等报道了从强大的大豆根腐病病原卵菌Phytophthora sojae (PsChs1)中通过冷冻电子显微镜表征技术,解析了5个甲壳素合成酶的冷冻电子显微镜结构,分别对应于载脂蛋白(apo)、GlcNAc-结合、甲壳素低聚体结合的初态、UPD-结合(合成后的状态)、甲壳素合成酶的抑制剂烟霉素Z-结合态,通过对甲壳素的生物合成过程、抑制作用进行深入理解,对甲壳素的合成过程进行深入理解。1)研究和表征发现,甲壳素合成的反应区域含有底物结合位点、催化活性中心位点、用于生成的聚合物离去的聚合物转运通道入口。这种现象说明甲壳素生物合成过程包含的连续多个重要过程,包括UDP-GlcNAc结合态、聚合物生长、产物释放。2)研究发现甲壳素传输通道含有一个摇摆回路结构,该结构作为“门禁”阻止底物离去、同时引导产物聚合物分子向产物传输通道转移,从而将产物分子排放到细胞膜的外侧。这项研究工作指明了甲壳素的生物合成过程的多个步骤,揭示了如何设计抑制甲壳素合成。Chen, W., Cao, P., Liu, Y. et al. Structural basis for directional chitin biosynthesis. Nature (2022)DOI: 10.1038/s41586-022-05244-5https://www.nature.com/articles/s41586-022-05244-5
2. Nature:构建光催化酶进行立体选择性[2+2]环加成
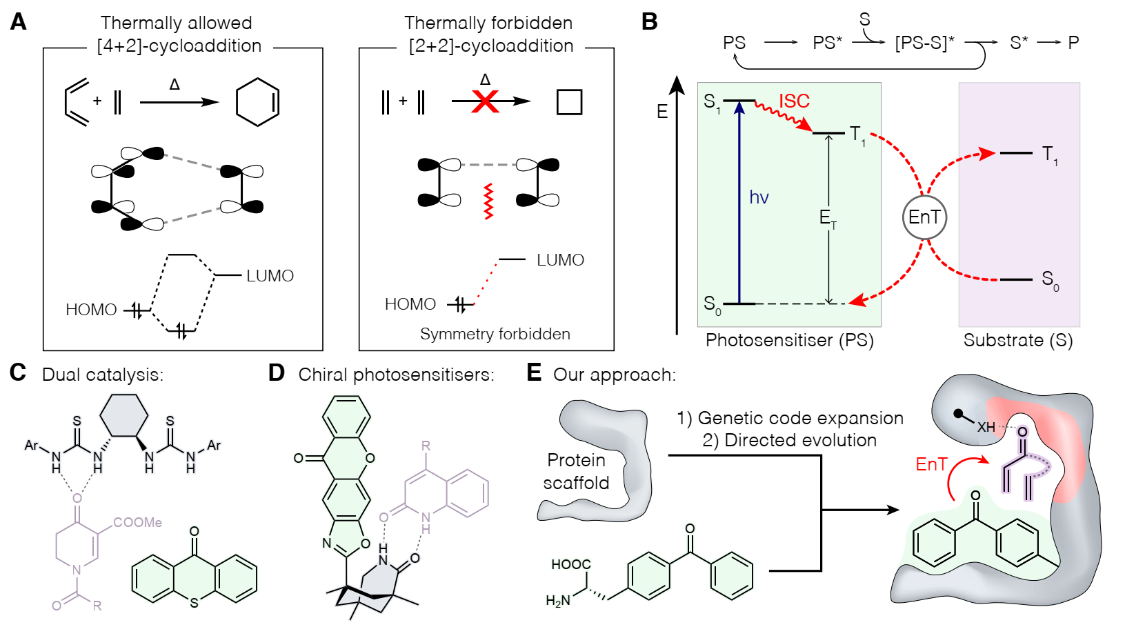
通过向蛋白中编辑新型催化剂的方式能够发展超越自然酶催化的功能,为了实现这个目标,基因编码扩展方法具有较高的前景,基因编码扩展能够向蛋白中以位点选择性的方式引入非常见的氨基酸侧链作为新型功能结构。有鉴于此,曼彻斯特大学Anthony P. Green等报道通过扩展基因编辑方法,将酶催化领域未曾有但是有机合成领域常用的三重态能量转移催化引入酶催化领域,发展了新型光-酶催化剂,能够在温和好氧条件实现高效率的立体选择性[2+2]环加成。1)通过将基因编码的方式将光敏剂组装到DA_20_20的β螺旋结构中,从而将Diels Alderase转变为光酶催化剂,成功的用于[2+2]环加成(EnT1.0)。随后通过发展和应用光酶结构进化的方式得到一种具有立体选择性的高效光酶(EnT1.3),产率最好达到99 % e.e.,能够进行分子内环加成、生物活性分子环加成反应,甚至能够对小分子催化剂而言非常困难的分子进行催化。与小分子光催化剂不同,EnT1.3的催化转化TON达到>300,能够在好氧条件和温和反应温度进行高效率的立体选择性催化反应。2)通过对EnT1.3-产物复合物进行X射线晶体学表征测试,研究多功能结构是如何相互配合实现高效率的进行选择性光催化反应。这项研究工作为发展立体选择性光催化剂提供帮助和指导,为蛋白的活性位点引入激发态相关大量研究提供机会。Trimble, J.S., Crawshaw, R., Hardy, F.J. et al. A Designed Photoenzyme for Enantioselective [2+2]-Cycloadditions. Nature (2022)DOI: 10.1038/s41586-022-05335-3https://www.nature.com/articles/s41586-022-05335-3
3. AM:“红碳”半导体聚合物的合成和应用
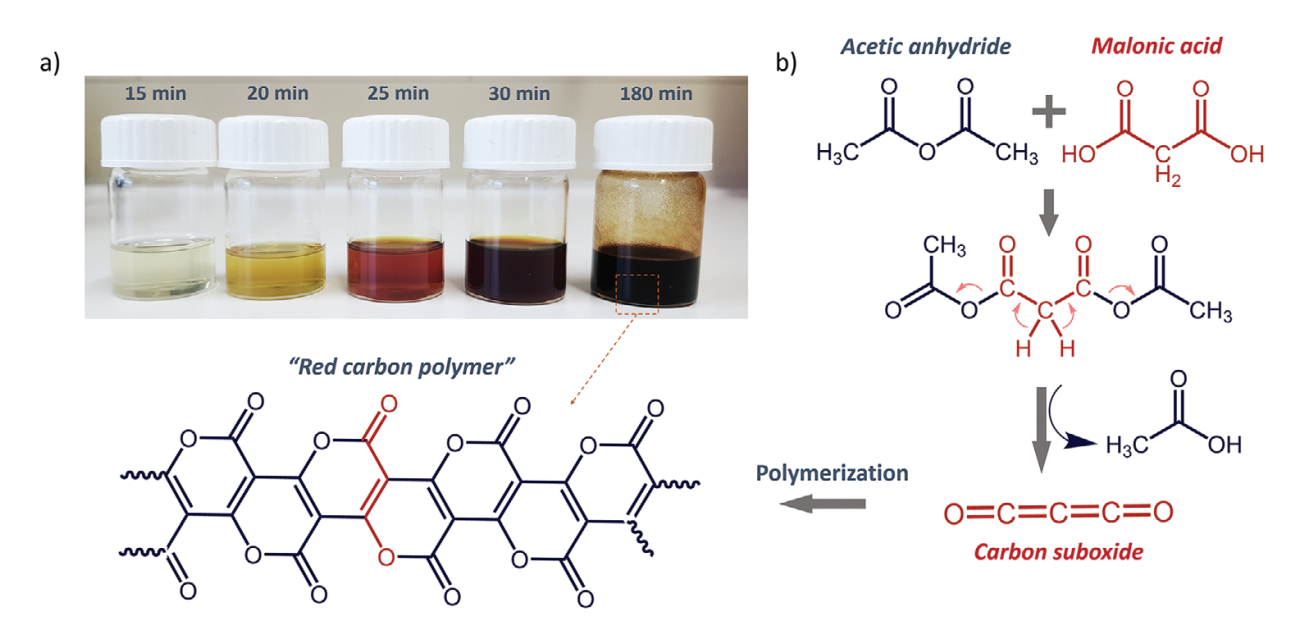
二氧化三碳C2O3(Carbon suboxide)是一种非常独特的分子,能够在0 ℃就能够自发聚合生成具有高度共轭结构的光吸收材料。虽然这种材料具有的显著优势,但是人们对这种碳基材料的特点和功能并不清楚。有鉴于此,马克思·普朗克固体与界面研究所Nieves López-Salas、Mateusz Odziomek等报道研究这种被人们遗忘的“红碳”聚合物半导体材料。通过发展一种溶液相聚合反应方法,能够更加简单方便的控制合成和结构,从而能够在非常低的温度得到聚合物材料。1)一般通过丙二酸MA(malonic acid)在P2O5上缩水的方式生成C3O2,随后在室温自发聚合生成深色固体材料,反应的速率能够通过温度和杂质进行调控,作者发现不同文献给出的合成时间互不相同,说明其合成过程对反应条件非常敏感。在此基础上,作者通过丙二酸与乙酸酐混合的方法活化羧酸官能团,生成丙二酸和乙酸的混合酸酐,因此首次实现了通过液相合成p(C3O2)x。通过表征技术,验证结果与以往报道的p(C3O2)x相同。通过光谱表征和元素分析,验证材料的结构为共轭梯状聚吡咯带状结构。使用DFT计算,验证半导体碳材料具有直接的能带结构半导体,光学数据分析结果显示其具有宽度适中的带隙。与C3N4等相比,这种碳材料的合成更加容易操作。2)红碳能够溶解于中等极性溶剂,并包覆在不同基底表面,因此可能用于多种多样的领域,包括OLED、有机场效应晶体管、太阳能电池、光催化等。这种碳材料在蓝光光照条件具有非常好的光催化活性,能够将苯甲醇转化为苯甲醛、将苯甲硫醚转化为亚砜/砜。材料通过非常简单的缩合-芳构化方法(condensation–aromatization route)能够直接合成梯状聚合物,这项研究为低温合成碳基材料提供一种普适性方法。Mateusz Odziomek, et al, “Red Carbon”: A Rediscovered Covalent Crystalline Semiconductor, Adv. Mater. 2022DOI: 10.1002/adma.202206405https://onlinelibrary.wiley.com/doi/full/10.1002/adma.202206405
4. Biomaterials:线粒体解偶联剂协同光动力纳米平台以实现促死亡自噬/线粒体自噬
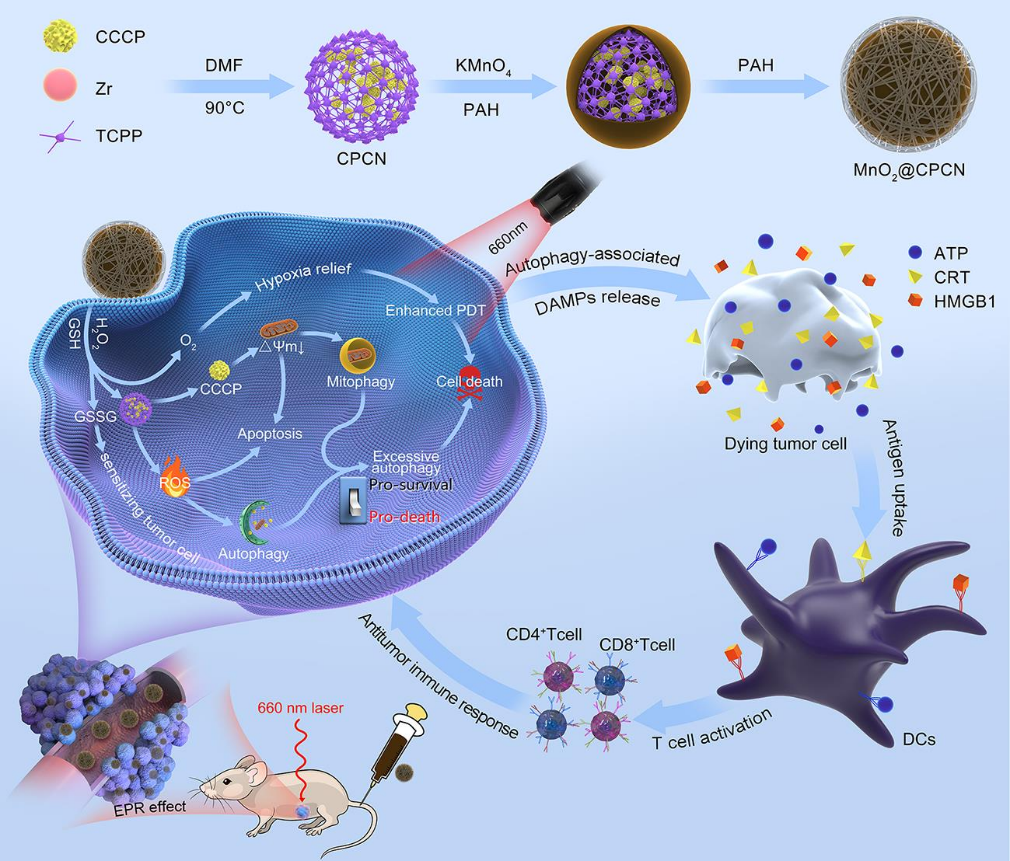
自噬/线粒体自噬是一种基于溶酶体的分解代谢途径,其可通过增加肿瘤细胞对活性氧(ROS)触发的蛋白质损伤和线粒体破坏的适应来降低光动力治疗(PDT)的效率。另一方面,过度激活的自噬/线粒体自噬级联也会引起自噬细胞死亡,促进死亡细胞内源性抗原释放,从而在启动抗肿瘤免疫反应的过程中发挥重要作用。为了充分利用细胞自噬/线粒体自噬的免疫调节作用,安徽中医药大学尹登科教授和杨晔教授合理构建了MnO2壳层包覆的多功能卟啉金属有机骨架(MOF)来负载羰基氰酯-3-氯苯基腙(CCCP)。1)包裹的MnO2外壳不仅可以防止CCCP在血液循环中被过早释放,还可以通过催化肿瘤内H2O2的分解来克服肿瘤乏氧。进入肿瘤细胞后,MnO2壳层可清除过表达的谷胱甘肽(GSH),导致CCCP释放、GSH消耗和O2生成,有效增强PDT。与此同时,释放的CCCP能够作为线粒体解偶联剂以诱导线粒体去极化和线粒体自噬,显著提高PDT过程中产生的自噬/线粒体自噬水平,从而将促生存的自噬/线粒体自噬转化为促死亡形式,导致肿瘤细胞自噬和免疫原性细胞死亡发生。2)体内实验结果表明,CCCP协同PDT可诱导与T细胞反应和免疫记忆相关的过度免疫刺激性自噬/线粒体自噬,导致原发性肿瘤完全消融,并能有效预防肿瘤复发和肺转移。综上所述,该研究充分证明了自噬/线粒体自噬在癌症治疗中的促死亡作用和免疫调节作用,从而为提高癌症治疗的疗效提供了一种新颖、通用的策略。Quanwei Sun. et al. Engineering mitochondrial uncoupler synergistic photodynamic nanoplatform to harness immunostimulatory pro-death autophagy/mitophagy. Biomaterials. 2022https://www.sciencedirect.com/science/article/pii/S0142961222004367
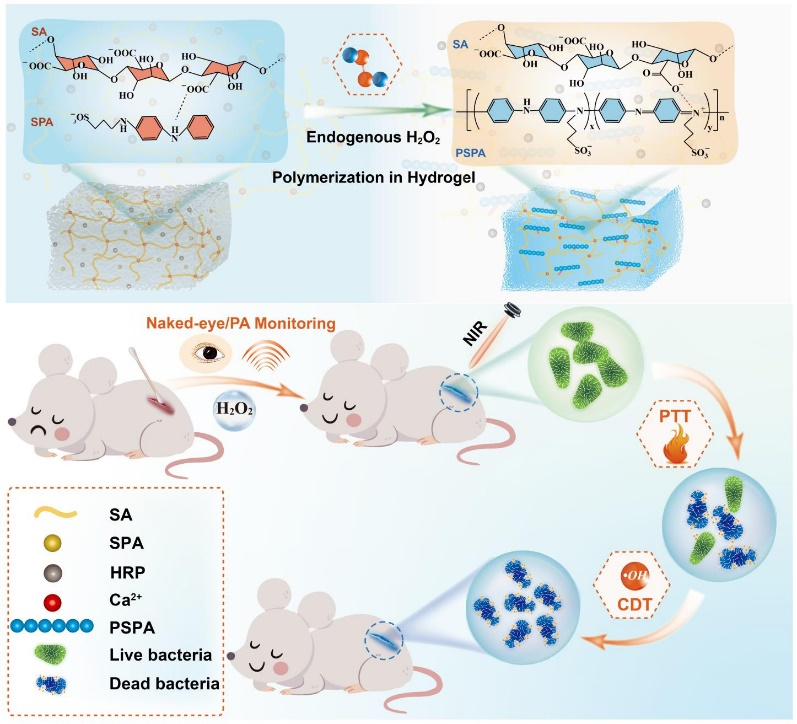
5. Biomaterials:H2O2活化的苯胺衍生物原位聚合用于伤口细菌感染的实时监测和抑制
创面极易发生细菌感染,并且会引起慢性创面以及一系列并发症。然而,目前仍然缺乏能够对伤口状态进行实时监测和有效治疗的系统。有鉴于此,广西师范大学沈星灿教授和蒋邦平教授首次利用生物微环境技术以在人工水凝胶中原位生物合成功能共轭聚合物,并将其用于实现对伤口感染的实时监测和对细菌的抑制。1)预负载的辣根过氧化物酶(HRP)能够催化感染创面过表达的过氧化氢(H2O2)产生羟基自由基(•OH),进而将一种易聚合的苯胺二聚体(N-(3-磺丙基)对氨基二苯胺,SPA)在海藻酸钙水凝胶中原位聚合为聚SPA (PSPA)。由于PSPA具有出色的近红外(NIR)吸收特性,因此这种聚合可以巧妙地通过肉眼观察和光声信号实现对H2O2的实时监测,并利用近红外光介导的光热治疗抑制细菌。2)体内实验结果表明,结合•OH具有的持续性化学动力学治疗性能,该治疗策略能够在第11天实现99.03%的创面愈合率。综上所述,该研究为在人工水凝胶中实现功能共轭聚合物的原位生物合成开辟了道路,能够有效解决伤口治疗所面临的严峻挑战。Aihui Wang. et al. H2O2-activated in situ polymerization of aniline derivative in hydrogel for real-time monitoring and inhibition of wound bacterial infection. Biomaterials. 2022https://www.sciencedirect.com/science/article/pii/S0142961222004380
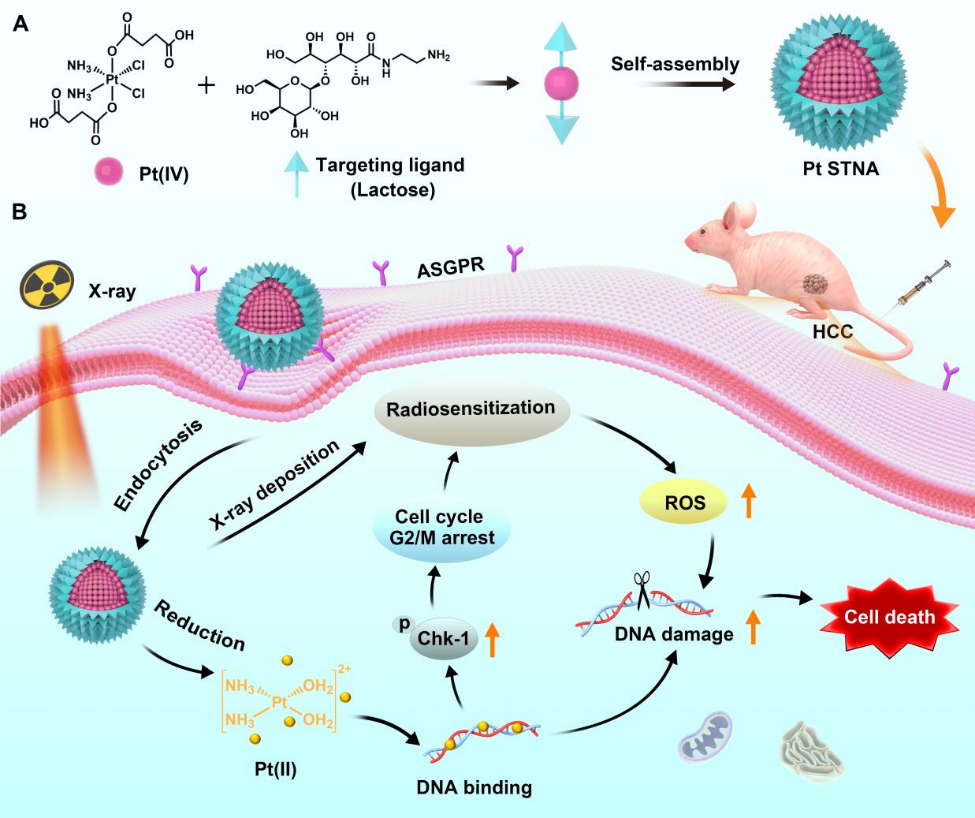
6. Biomaterials:自靶向铂(IV)两亲性前药纳米组装体可作为放疗增敏剂以对肝癌进行放射化学治疗
放化疗是一种被广泛应用于肝癌等恶性肿瘤患者的治疗方法。然而,如何实现安全、协同的化疗和放疗增敏仍然是一个严峻的挑战。中山大学潘越教授和南方医科大学周东方教授设计了一种基于铂(IV)-乳糖两亲性前药的自靶向纳米组装体(STNA),并将其用于对肝癌进行协同放射化学治疗。1)由于乳糖对HCC细胞具有靶向性,因此Pt STNA可以在肿瘤内有效积累。经受体介导内吞,Pt STNA可在癌细胞中释放顺铂(II)以与DNA结合,从而诱导产生DNA损伤和细胞凋亡。同时,这种与DNA的结合作用还可通过上调磷酸化检查点激酶1 (p-Chk1)的表达以导致对辐射敏感的G2/M期细胞周期阻滞。2)在x射线照射下,Pt STNA能够表现出较强的x射线衰减能力,以沉积更多的能量,从而在G2/M期提高活性氧(ROS)水平,增强放疗的癌细胞杀伤作用,使得DNA损伤增加。实验结果表明,Pt STNA可在放化疗中表现出显著的协同治疗作用,且不会再体内外产生不良反应。综上所述,该研究提出了一种新型的自靶向纳米组装策略,可通过协同化疗和放疗增敏实现肝癌治疗。Xiaohui Xiao. et al. Self-Targeting Platinum(IV) Amphiphilic Prodrug Nano-Assembly as Radiosensitizer for Synergistic and Safe Chemoradiotherapy of Hepatocellular Carcinoma. Biomaterials. 2022https://www.sciencedirect.com/science/article/pii/S0142961222004331