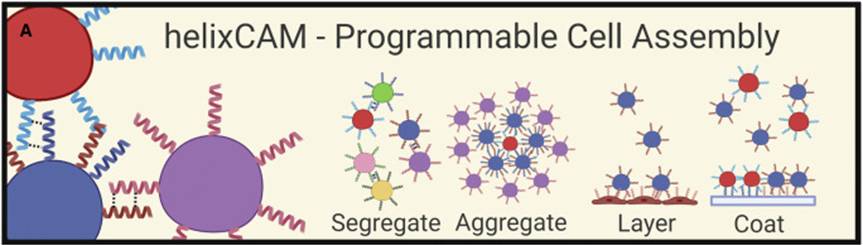
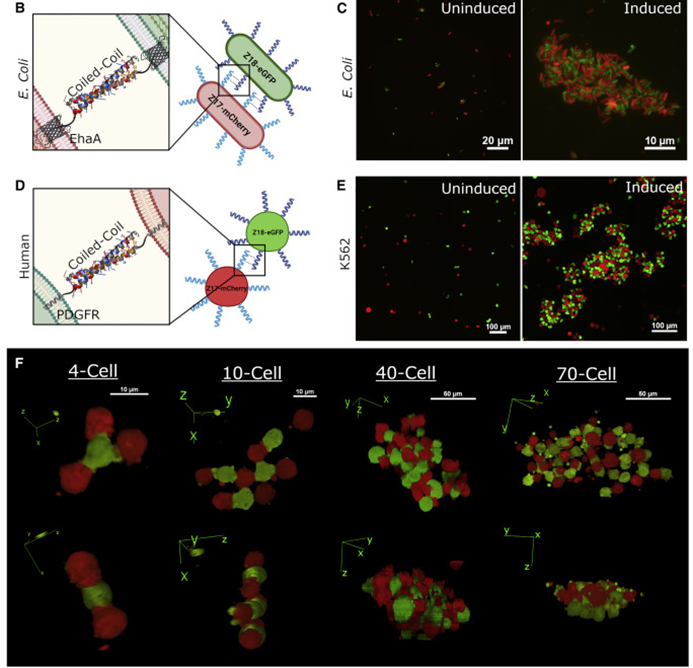
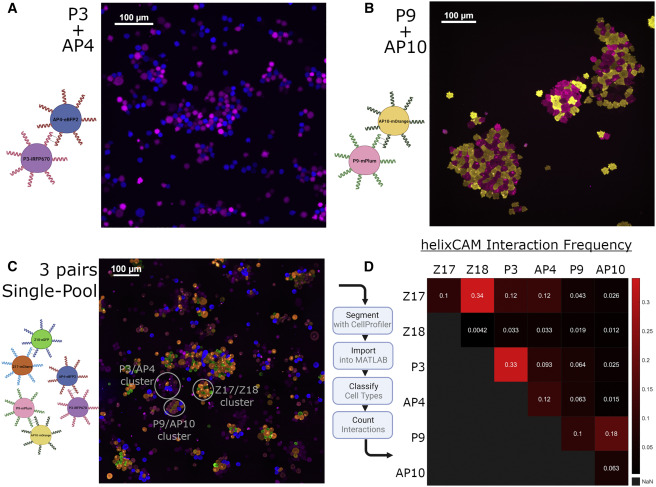
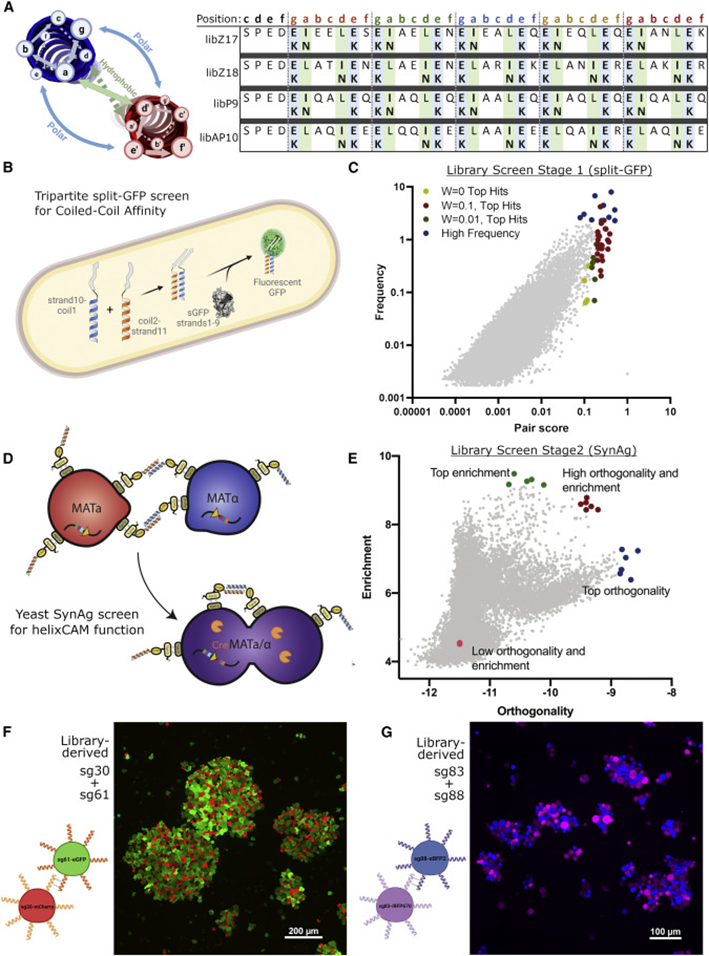
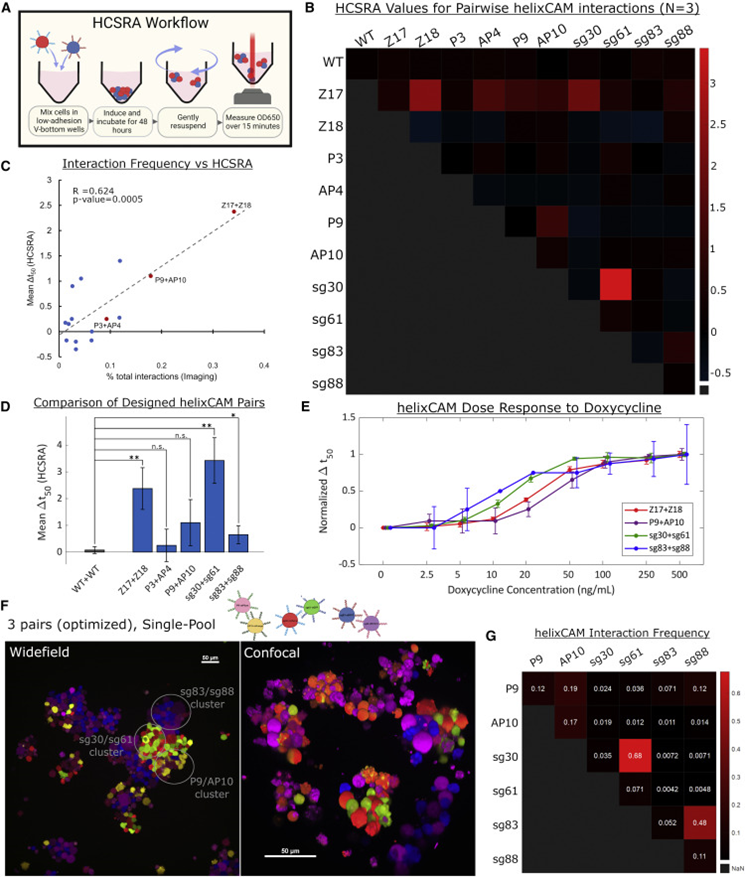
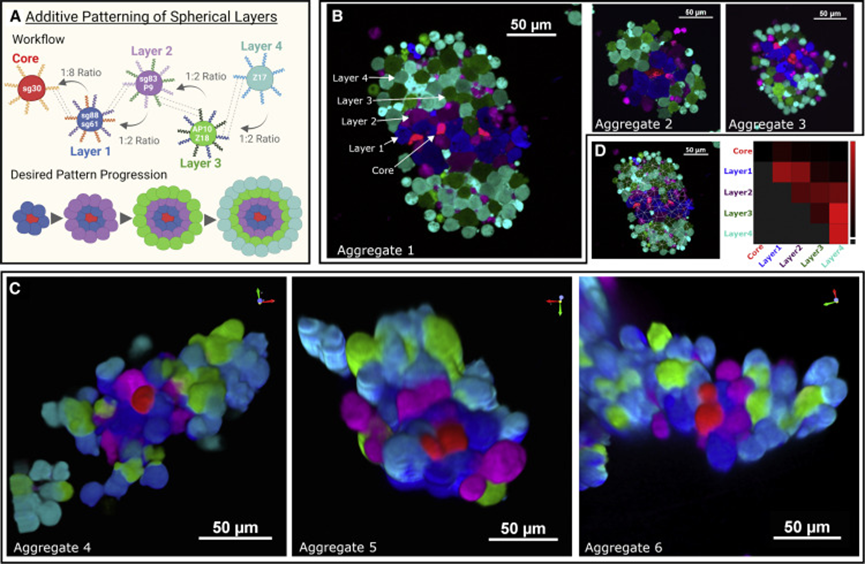
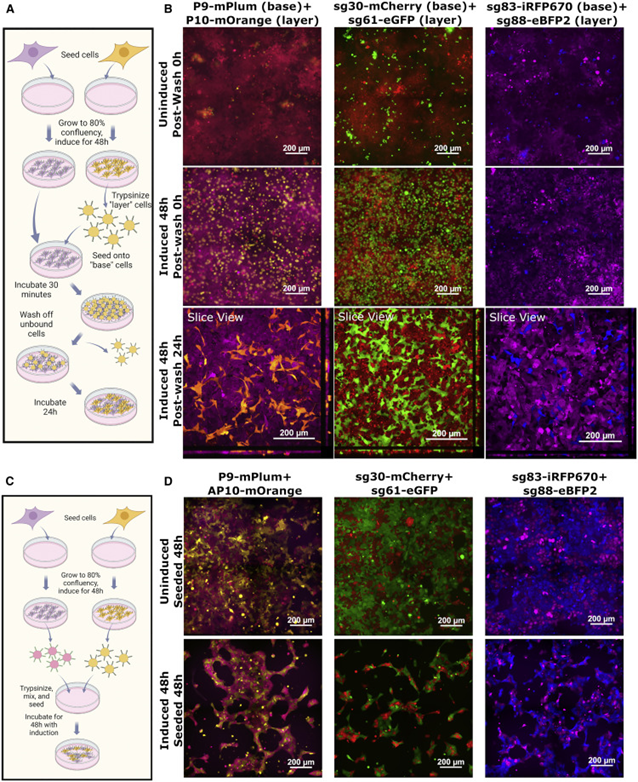
细胞间相互作用是生物体不可或缺的一部分,无论是单细胞还是多细胞。因此对之的研究也从未停下脚步,但是如何人为的构建细胞间相互作用一直是个技术难题。目前存在一些人为地引导细胞-细胞相互作用的方法。如过度表达两种钙粘蛋白能够组装大细胞聚集体,然而天然细胞粘附分子(CAM)如钙粘蛋白数量很少,具有显着的交叉活性,并且通常可以作为下游信号分子发挥双重作用,限制了它们用于平行引导多种相互作用。蛋白质介导的细胞相互作用的一个有吸引力的替代方案是螺旋蛋白结构域(CCs),这是经过充分研究的蛋白质结构域,在介导许多天然蛋白质的蛋白质-蛋白质相互作用方面具有既定的作用。由于其众所周知的配对规则,正交CC肽对的集合已被许多研究小组设计和表征使它们成为诱导特定细胞-细胞相互作用的潜在宝库。而该技术如今又实现了新的突破。近日,美国哈佛医学院遗传学系的乔治•丘奇院士率领其团队在Cell上发表了一种关于引导细胞-细胞相互作用的基础工具。作者团队将其称为“helixCAMs(螺旋细胞黏附分子)”,这是一个通过在细胞表面呈现卷曲的肽来设计合成CAM的平台。helixCAMs能够在细菌和人类细胞中产生特定的细胞-细胞相互作用,还能直接诱导模式聚集体的形成。基于helixCAMs的相互作用原理,作者团队构建了一组合理设计的helixCAMs库,从而发现了额外的高性能螺旋CAM对。此helixCAMs工具包预期将被应用于各种多细胞工程应用,例如球形分层、贴壁细胞靶向和表面图案化等等。helixCAMs在细菌与细胞中诱导的多细胞聚集:为了验证helixCAM可以作为细胞间相互作用平台,作者团队从SynZip库中选择了反平行异二聚体CC对Z17和Z18用于细菌模型构建。一个菌种表达Z17 helixCAM和mCherry荧光蛋白,另一个表达了Z18 helixCAM和eGFP。当两个种群混合时,在没有阿拉伯糖诱导下,细菌主要存在于单胞和小聚集体中。而在阿拉伯糖诱导下,可以观察到形成了包含数百个细胞的长达40 mm的大细菌聚集体。这些聚集物始终由来自两个菌株的细胞组成,主要以交替模式,体现出了异二聚体效应。接下来,试图在人体细胞中运用helixCAM系统。在人K562细胞中的构建了Z17mCherry与Z18eGFP helixCAM的稳定的细胞系。在未经诱导下,两种细胞混合后仍保持为单细胞悬浮液,但诱导48小时后,细胞形成大而紧密的簇状物,mCherry和GFP交替出现,表明异二聚体形成。图1F为共焦成像重建的可视化三维结构,可以发现,helixCAM蛋白诱导细胞间的结合界面呈连接状。由四到十个细胞组成的较小聚集体形成了结构,其中每个细胞只与表达互补螺旋CAM的细胞结合,形成清晰的棋盘格图案。这些数据表明,helixCAMs可以独立于内源性CAM蛋白在人类细胞系中形成强大的细胞间相互作用。图1 helixCAMs在细菌与细胞中诱导的多细胞聚集正交helixCAMs可在混合体系中实现可编程的子聚集:根据上述Z17/Z18的预期结果,进一步使用P3/AP4和P9/AP10的CC对设计了额外的helixCAM,之前有报道称它们具有高亲和力和正交性。首先使用沉降率分析在大肠杆菌中测试了这些helixCAM,并观察到当混合表达预期CC对的大肠杆菌时,形成了更大的沉降更快的聚集体。为了在人类细胞中测试这些helixCAM,与Z17/Z18的情况一样,P3iRFP670/AP4eBFP2细胞株(图2A)和P9mPlum/AP10mOrange细胞株(图2B)在成对共培养中诱导表达helixCAMs时形成细胞聚集。接下来,试图研究当所有三对helixCAM都出现在同一体系中时,这些相互作用的正交性。为此,将六个细胞系以相同浓度播种在一起。显微图像显示互补helixCAM细胞之间的明确结合偏好(图2C)。个体聚集物主要由成对互补的螺旋CAM细胞组成,尽管较大的聚集物由更多的细胞类型组成,但不同的亚簇仍然很明显。图2 额外helixCAMs和三对之间相互作用正交性helixCAMs库设计和高性能helixCAM对筛选:为了构建更优化的helixCAM正交系统,作者团队试图通过基于在K562细胞中表现出高亲和力和特异性的四个helixCAM设计合理的CC肽库来扩展高亲和力正交helixCam的集合。为了有效筛选这些相互作用,我采用了一种两阶段的方法:首先,在大肠杆菌中进行三重GFP互补分析,以选择表现出强结合的候选CC。在初步筛选之后,进行酵母交配试验,以评估CC对诱导真核细胞聚集的能力。在利用三分法筛选了102个候选CC肽后,考虑到原核生物和真核生物helixCAM特征之间的潜在脱节,CC筛选的下一阶段旨在选择诱导真核生物聚集的能力,同时保持合理的筛选吞吐量,基于酵母的SynAg交配试验非常适合。简而言之,表达高正交性helixCAM的酵母细胞被促进交配,将两个单倍体细胞合并为二倍体细胞,两个helixCAM DNA得以结构重组为一条单链(图3D)。对存活下来的酵母细胞进行评分,选择了两个可能能够指导强而特异的细胞聚集的最佳候选CC对(sg30/sg61和sg83/sg88)(图3E)。“细胞沉降分析”揭示了库衍生helixCAMs的高亲和力和特异性:通过添加两个库衍生的helixCAM对,需要对十个不同的helixCAM进行正交性检测。使用与大肠杆菌沉降率测定相同的原理,作者团队开发了一种人类细胞沉降率测定(HCSRA)检测技术,以评估K562细胞中的聚集。使用HCSRA,测量所有helixCAM以及与野生型K562细胞的相互作用(图4B)。HCSRA Dt50的值与显微镜得出的相互影响频率一致,两个库衍生的helixCAM对都显示出高亲和力和特异性(图4D)。事实上,sg30/sg61对的平均HCSRA值超过了之前的最高亲和力对Z17/Z18。利用HCSRA实现的更高吞吐量们进一步研究了四对高亲和力helixCAM对的特性。首先,研究了聚集效应是否可以通过改变helixCAM表达水平来调整。对一系列强力霉素诱导浓度的亲和力进行了测试(图4E),结果表明,仅通过控制helixCAM的表达,就可以形成不同大小的聚集体。这些发现表明,通过使用小分子诱导剂控制helixCAM的表达,可以很容易地校准helixCAM诱导的亲和力,以实现个体应用。图4 helixCAM亲和力的HCSRA测量helixCAM亲和力helixCAMs可实现复杂三维细胞结构的附加构建:不同特殊细胞类型的特定空间模式是人体组织的一个标志,组织可以基于此实现营养物质交换和细胞信号传递等功能。假设可以通过使用表达单个helixCAM的“核心”细胞,然后与表达两个helixCAM的“层”细胞进行连续培养,可以复制与人类组织中发现的细胞相似的复杂细胞层。为此,我们选择sg30mCherry细胞作为“核心”细胞,并创建了三种中间“层”细胞类型,每种类型表达两个正交的helixCAM。目标是使用正交性最强的helixCAM形成稳定的内层机构,同时将正交性差的降为外层(图5A)。这一过程形成的聚集体与设想的结构布局极为相似。图5B展示了广域成像的三个精选聚集体,同时图5C中展示了共聚焦3D重建。可以观察到的是,虽然最初的细胞层形成球形结构,但这些种子聚集物的不均匀性似乎会被随后的细胞层放大,通常导致第2-4层的细胞在核心的相对侧组织起来,形成一个汉堡状的呈现。四对helixCAM形成聚集体有着惊人复杂性,以及与预期多细胞结构蓝图的相似性,暗示了helixCAM在指导复杂多细胞结构的模式化方面的潜力。图5 helixCAM可以构建复杂的3D多细胞结构helixCAMs能够将悬浮细胞靶向粘附细胞并影响其迁移和形态:除组织构建外,细胞间相互作用对于免疫细胞靶向活动感染或恶性肿瘤区域至关重要。假设如果可以使感兴趣的粘附细胞表达helixCAM对的一个成员,则有可能招募表达互补helixCAM的悬浮细胞到该区域。首先,产生了能够表达helixCAMs的粘附性HEK293细胞系,随后添加相应的K562 helixCAM表达细胞,然后洗去未结合的细胞。可以观察到K562细胞与HEK293细胞形成强烈的helixCAM依赖性结合,直到到24小时,结合后的细胞团已重新建立其粘附形态(图6B)。这些实验表明,helixCAM是一种可行的工具,可将悬浮细胞和粘附细胞等靶向预先建立的相关粘附细胞。进一步检查helixCAM相互作用的强度是否能够与内源性粘附竞争,对HEK293 helixCAM细胞系进行共培养,并通过宽视野显微镜检查其优先相互作用(图6C)。虽然未诱导对照组中的两种细胞类型分布均匀,显示正常的细胞形态,但诱导细胞更局部集中,空腔的更大区域留下,并形成拉长的束(图6D)。HEK293 helixCAM细胞形态的显著变化表明helixCAM相互作用可以与内源性相互作用竞争,从而影响粘附细胞的迁移和形态。图6 helixCAMs能够将悬浮细胞靶向粘附细胞并影响粘附细胞的形态helixCAMs能同时对多种细胞类型进行可调图形化尽管上述实验侧重于helixCAM将细胞相互结合的能力,但helixCam的亲和力和特异性也可用于在表面上形成多种细胞类型,从而从混合群体中纯化细胞或形成微流体装置。为了测试helixCAM对细胞模式的能力,将蛋白质溶液应用于镀镍板,以形成CC涂层表面,然后添加helixCAM表达细胞以形成图案。移除未结合的细胞后对剩余的细胞进行成像和定量(图7A)。在几乎所有条件下,CC涂层表面导致helixCAM细胞结合,结合的细胞数量与应用的蛋白质涂层浓度密切相关。接下来,测试了是否可以同时将两个不同的helixCAM细胞群以特定的空间模式结合到平板上。用两个不同的CC-GFP-His蛋白进行了预模式化,随后添加了两个相应的K562 helixCAM细胞的混合物,要么在左侧呈“G”形,要么在右侧呈“C”形(图7E)。洗前图像显示了两种helixCAM单元类型在表面的均匀分布。清洗后,可以在相应的“G”和“C”CC图案区域发现密集的helixCAM细胞,而未处理的区域几乎完全没有细胞。helixCAM细胞与CC图案化表面的结合证明了其作为一种高度特异性细胞捕获和图案化的方法的潜力,同时图案化细胞类型的数量由可用的正交CC对的数量决定。图7 helixCAM可以在CC图案表面上同时对多种细胞类型进行可调图案绘制在这项研究中,作者团队提出了helixCAM,这是一个可扩展的平台,用于研究工程细菌和人类细胞中的可编程细胞-细胞相互作用。helixCAM被证明可以诱导形成包含数千个细胞并跨越多个细胞层的大型图案化细胞聚集体。从先前建立的CC结构域组成的helixCAM中,作者团队合理设计了CC肽库,并在筛选亲和力和特异性后,鉴定出两个具有良好正交性和亲和力的工程CC对。然后,在一系列细胞类型和应用中测试了该CC对,证明了它们在指导多细胞模式和形态方面的多功能性。helixCAM平台的开发增强了合成蛋白质粘附素的现有工作。与先前研究使用钙粘蛋白类似,helixCAM能够形成大细胞聚集体,不同之处在于CC形成的是异源二聚体。异源二聚体和特异性亲和力是更复杂的图案形成基石。也正是如此,helixCAM平台的应用潜力极为巨大,如用于免疫学中研究各种免疫细胞之间的相互作用,甚至直接将免疫细胞定位到受感染或恶性组织。又或用于3D细胞打印,helixCAM平台可用于制造具有单细胞级精度的复杂球形结构。helixCAM平台的多功能性超越了细胞间相互作用,延伸到细胞表面相互作用,为增强传统细胞纯化和图案化方法打开了机会之门。对于器官芯片平台而言,通过预先将微流体装置与多个CC物种共模式化,可以设计复杂的细胞分布模式来进一步模拟生理环境。helixCAM平台提供了一种简单但强大的方法来控制细胞-细胞相互作用,这是从原核生物到真核生物的无处不在的特征。除了这项工作中描述的五个螺旋CAM对之外,可能还有更多正交螺旋CAMs被发现,以进一步扩大潜在的应用。可以相信的,这里介绍的helixCAMs工具包将帮助多个领域的生物学家更好地了解细胞相互作用在各种情况下的作用,并使工程师能够更好地控制这些相互作用以用于治疗应用。George Chao, Timothy M Wannier, Clair Gutierrez, et al. helixCAM: A platform for programmable cellular assembly in bacteria and human cells. Cell. 2022 Sep 15;185(19):3551-3567.e39.https://www.sciencedirect.com/science/article/pii/S0092867422010613