血脑屏障(BBB)是基因传递到中枢神经系统(CNS)的一个巨大障碍。事实上,一些血清型的腺相关病毒(AAV),包括临床证实的AAV9,即使大剂量给药也无法克服BBB。在小鼠模型中,设计更有效地跨越BBB的AAV载体(即,中枢神经嗜性AAV载体)的努力通常是卓有成效的。然而,将这些工程化的AAV载体从啮齿动物转化为大型动物一直是一项挑战。在灵长类动物中设计一种比AAV9(“黄金标准”AAV载体)效率高出五到十倍的嗜中枢神经系统AAV载体,可以极大地促进为广泛的中枢神经系统疾病开发的基因治疗。
成果简介
鉴于此,哈佛医学院Fengfeng Bei等研究人员利用AAV9作为亲本载体,构建一种AVV载体,提高其在小鼠和非人类灵长类动物体内穿透BBB的效率,并为其临床转化适用性提供概念证明。

转导效率提高6倍
作为正在进行的筛选工作的一部分,研究人员在AAV9衣壳中常用的588/589位点基因插入了14个单独的细胞穿透肽(CPP),并筛选了这些AVV变异体穿透BBB的能力。进一步测试了另外七种CPP样肽,以优化第一轮筛选中的最佳CPP候选肽。分别产生AAV候选病毒,并将其静脉注射到小鼠和非人类灵长类动物(特别是食蟹猴)体内,以评估其对中枢神经系统的转导。
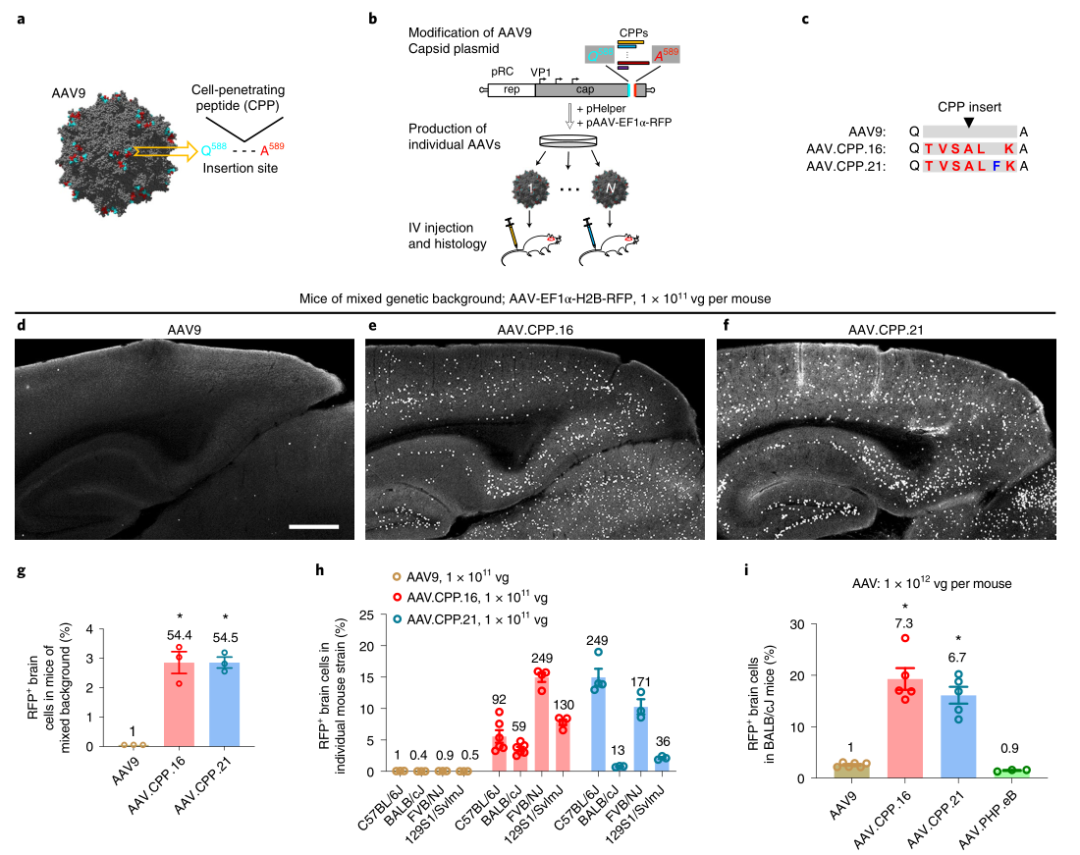
图|小鼠血脑屏障穿透性AAV变异体衣壳工程研究
该课题组鉴定了两种肽插入物(AAV.CPP.16中的TVSALK和AAV.CPP.21中的TWSALFK),它们在多个小鼠品系中可以将AAV9衣壳的转导效率提高了6倍以上。重要的是,AAV.CPP.16的神经趋向性从小鼠转移到食蟹猴身上。AAV.CPP.16比AAV9在动物模型中的这种增强作用与作者的发现是一致的,即AAV.CPP.16与AAV9相比,在人类BBB的体外模型中显示出更多的穿胞作用,并在培养的人类细胞系中增强转导。
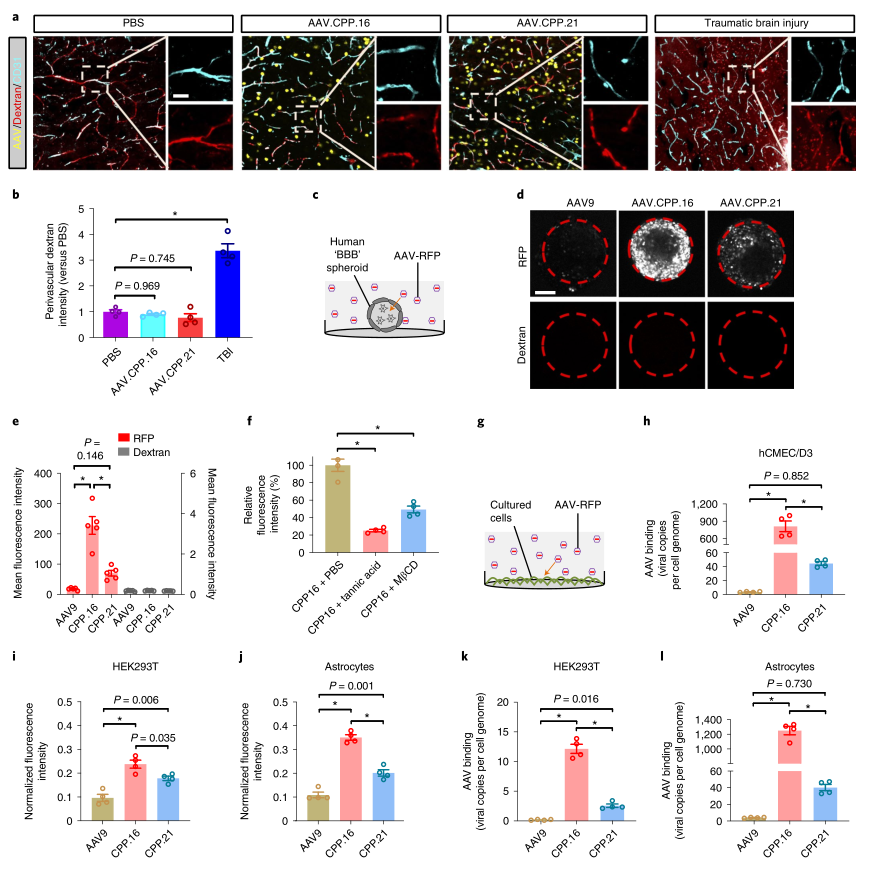
图|AAV.CPP.16对血脑屏障完整性、细胞转运和细胞转导的影响
可静脉递送抗体和酶
此外,研究人员还发现AAV.CPP.16可用于在胶质母细胞瘤的小鼠模型中静脉递送抗程序性死亡配体1抗体(αPD-L1)或单纯疱疹病毒1型胸苷激酶(一种 "自杀 "基因,与前体药物结合后可杀死肿瘤细胞)。尽管AAV.CPP.16只转导了一小部分肿瘤细胞(大约10%),但这两种治疗方法都产生了惊人的促进生存的益处。
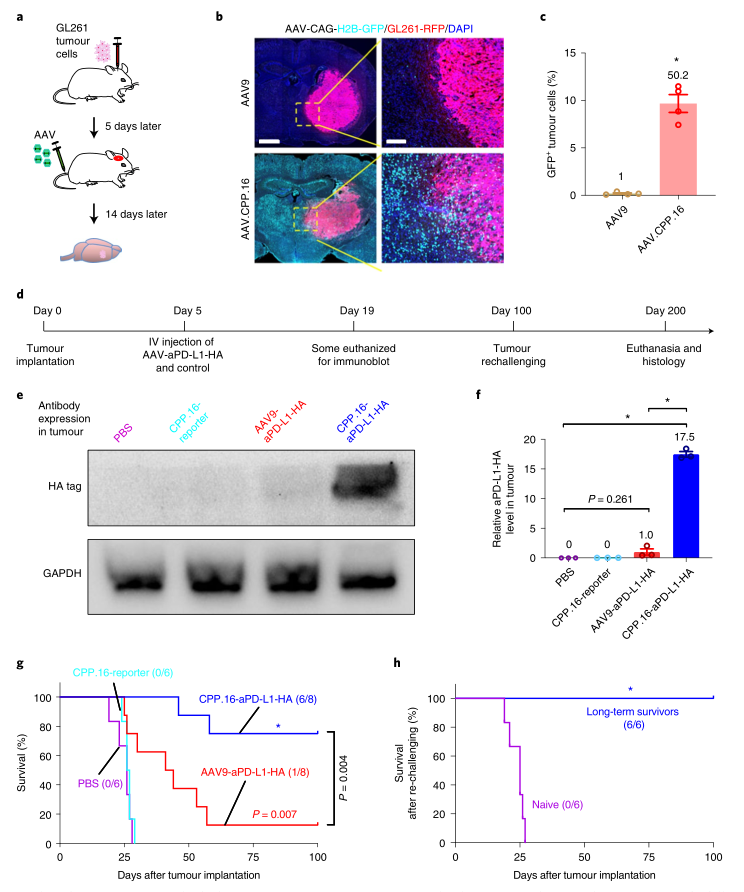
图|AAV.CPP.16为基础的系统性PD-L1抗体治疗
总结与展望
AAV.CPP.16是向中枢神经系统递送治疗性转基因的很有希望的载体,特别是对于具有弥漫性病理和明确遗传病因的疾病。要考虑的疾病目标包括中枢神经系统疾病,在这些疾病中,可以应用细胞之间的“交叉纠正”,例如通过分泌蛋白质。鉴于AAV.CPP.16对运动神经元或浦肯野细胞的高度趋向性,主要影响运动神经元或浦肯野细胞的中枢神经系统疾病也可以成为靶点,而且使用AAV.CPP.16通过BBB传递抗体来治疗胶质母细胞瘤是可能的。事实上,在胶质母细胞瘤中,血脑屏障只被部分破坏,而对于这种癌症,血脑屏障药物输送有限是其他有希望的治疗失败的主要原因。
该研究的一个局限性是,研究人员没有系统地评估AAV.CPP.16在非人类灵长类动物中的转导水平。研究人员使用的报告基因和或免疫组织学方法在允许转导细胞的可视化方面是不理想的。由于技术原因,也没有在非人类灵长类动物中进行病毒基因组的生物分布。该研究的另一个注意事项是,当AAV.CPP.16在标准的实验室环境中制备时,会在高浓度下观察到病毒颗粒的聚集。尽管现在有证据表明,这种聚集是由AAV.CPP.16制剂中的杂质引起的,但目前还不清楚这种问题是否以及如何影响本研究中AAV.CPP.16的转导效率。
下一步,研究人员希望使用绿色荧光蛋白作为报告基因,系统地评估高度纯化的AAV.CPP.16载体在非人灵长类动物中的DNA、RNA和蛋白质水平的生物分布。该研究的结果将进一步验证AAV.CPP.16作为基因治疗载体的应用。对AAV.CPP.16的外壳进行工程设计以进一步提高其在全身给药后对中枢神经系统的特异性也将是有意义的。
参考文献:
Yao, Y., Wang, J., Liu, Y. et al. Variants of the adeno-associated virus serotype 9 with enhanced penetration of the blood–brain barrier in rodents and primates. Nat. Biomed. Eng (2022).
https://doi.org/10.1038/s41551-022-00938-7











