胰腺癌是临床肿瘤学中最致命的癌症表现之一。尽管仅占所有癌症病例的3.2%,但它是癌症相关死亡的第三大病因。胰腺癌对常规疗法的耐药性源于胰腺肿瘤自身的生物学特性。胰腺肿瘤的微环境由广泛、致密的血管性腺皮质组成,它们共同为药物的递送提供了强大的运输障碍,并抑制了放化疗效。
传统上,局部区域性胰腺肿瘤通过手术切除和辅助化疗进行控制,但是手术干预后复发率大于50%。当体外放射治疗(EBRT)被整合到现有治疗方案中后,减少了复发并增加总生存期。尽管有其临床收益,但EBRT在胰腺癌的临床管理方面存在实质性的局限性。目前的EBRT试验侧重于使用超分割方案安全地改善递送到胰腺肿瘤的有效辐射剂量。即使取得了一定的进展,但采用此技术放疗的胰腺肿瘤患者的2年和5年生存率仍为21.7%和 11.5%。因此,胰腺癌的放疗仍然需要实质性的临床改进。
近日,美国杜克大学生物医学工程系主任Ashutosh Chilkoti教授率领其团队在Nature biomedical engineering上发表了一种可注射的液体生物聚合物,用于提供131I放射性核素进行近距离放射治疗,进而形成与紫杉醇化疗联合治疗的高效治疗方案。该生物聚合物依赖于弹性蛋白样多肽(ELP)的热响应特性,以提供连续的131I,而紫杉醇(PTX)使用嵌合多肽(CP)作为纳米颗粒制剂递送,PTX与CP偶联后触发自组装形成直径约为60nm的球形纳米颗粒 。这种联合治疗可以有效克服胰腺癌固有的耐药机制,并且在各种胰腺肿瘤基因型的动物模型中都表现出良好的疗效,而这些结果是体外放疗所无法复制的。

联合治疗给药方式:
针对联合治疗的效果,首先作者团队评估了两种联合用药方案。第一种是CP-PTX与131I-ELP在肿瘤内作为混合物共同输注。该策略旨在提高肿瘤内PTX的生物利用度,以最大限度地提高化疗的潜在协同作用。第二种方法131I -ELP瘤内注射,而CP-PTX则静脉注 射以提供全身化疗。
尽管BxPc3-luc2人胰腺肿瘤细胞系在体外实验中表现对化疗敏感,但临床前研究一直表明,BxPc3异种移植瘤对放疗和化疗具有极强的抵抗力。作者团队选择将BxPc3-luc肿瘤原位接种在无胸腺小鼠的胰腺中来构建模型。经证实,在控制肿瘤生长方面,瘤内输注CP-PTX不如静脉注射CP-PTX有效,无论是作为单一药物还是与131I联合治疗。进一步评价两种联合治疗方案的131I浓度,方案一在9 d后仅保留注射的48%的放射性剂量,而方案二保留了其90%的放射性有效载荷。瘤内注射131I -ELP,在输注后24小时,肿瘤的初始放射性丧失率为21%。然而,在所有其他时间点,肿瘤放射性占测量的全身活性的>95%。这表明输注的初始阶段会损失一定的131I -ELP,但这种放射性在给药后48小时从体内清除,同时血液中的131I含量也被验证一直处于极低水平。在放射性库稳定性和肿瘤控制效力的基础上,作者团队选择了131I -ELP近距离放射治疗与静脉CP-PTX联合用于后续实验。
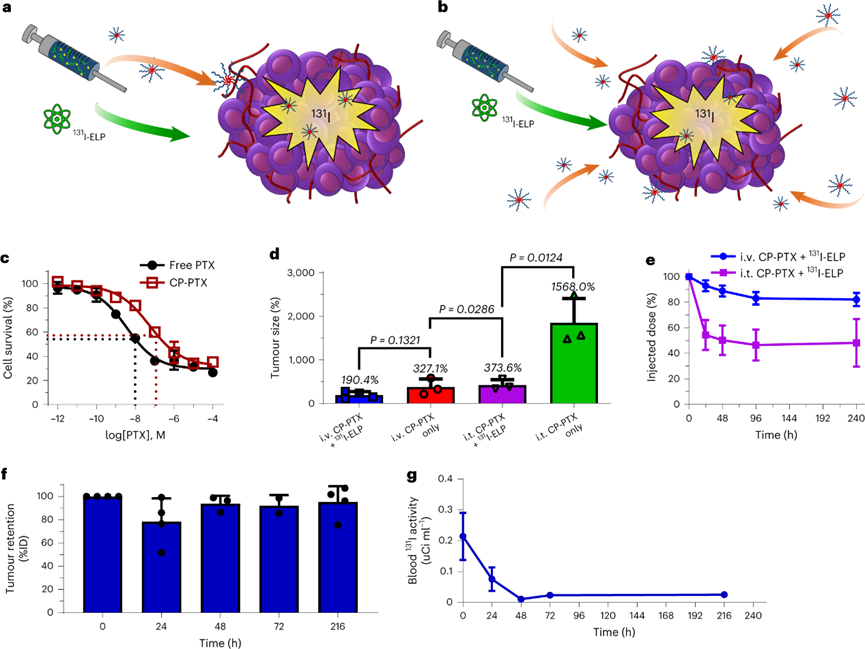
图 评估131I-ELP近距离放射治疗与紫杉醇纳米颗粒(CP-PTX)联合治疗胰腺肿瘤
联合治疗剂量评估:
进一步评价不同剂量联合治疗的治疗效果,在皮下 BxPc3-luc2 肿瘤无胸腺小鼠模型中进行控制剂量的研究。与所有单药治疗对照组相比,131I-ELP联合CP-PTX实现了显著的肿瘤消退。随着放射剂量的递增,肿瘤的治疗与控制效果也是递增的。最令人鼓舞的是,10.0 μCi mm−3联合治疗组显示100%缓解,治疗后所有肿瘤在14-21 d消失。而CP-PTX剂量实验,选择依次12.5,25和50mg kg−1的 PTX 等效剂量。虽然 CP-PTX 与131I-ELP的联合治疗展现出了抑制肿瘤生长的效力,但改变CP-PTX剂量并没有产生显着变化。单独使用任何剂量的CP-PTX化疗对减缓肿瘤生长没有影响。在初始的联合治疗一周后第二次给药CP-PTX,与接受单次CP-PTX注射的联合治疗相比,肿瘤生长得到了显着控制。然而,存活率仅从36 d略微提高到41 d。这表明重复CP-PTX注射可以延长治疗效果的持续时间,即使治疗效果不展现出PTX剂量依从性。
从这些实验中,确定了联合治疗的优化剂量方案:10.0 μCi mm−3的131I-ELP被选为最有效的放射性剂量。对于CP-PTX,决定将总剂量保持在50mg kg−1,这是先前研究中确定的最大耐受剂量。同时重复PTX给药改善肿瘤反应,将CP-PTX总剂量分为4次每周一次的CP-PTX注射。
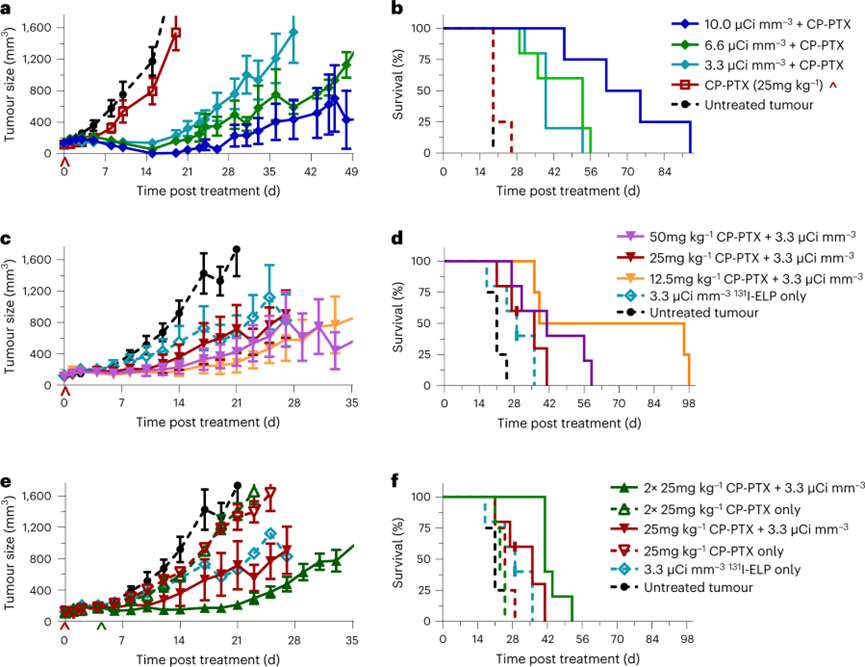
图 联合治疗的不同用药剂量在BxPc3-luc2 胰腺癌模型中的治疗效果
与当前临床治疗用药的疗效对比:
由于剂量递增的研究表明联合治疗可能对胰腺肿瘤有效,因此接下来将联合治疗与当前临床护理标准进行了比较。用FDA批准的紫杉醇制剂替代CP-PTX,而131I-ELP近距离放射治疗被EBRT取代。单独的Nab-PTX制剂治疗只有一只小鼠表现出部分反应。而131I-ELP单药治疗将生存率略微提高到38.5 d,仅实现了肿瘤生长的抑制。当Nab-PTX与131I-ELP近距离放射治疗在BxPc3-luc2肿瘤表现出显著的消退。根据实体瘤反应评估标准(RECIST)标准,获得了83.3%的ORR效果。与先前的实验中的CP-PTX相比,Nab-PTX联合治疗表现出的最佳肿瘤反应与CP-PTX相比没有统计学差异,清楚地表明PTX的纳米制剂的形式对治疗效果并不重要。
随后研究了用三种不同的EBRT方案代替131I-ELP的治疗效果。EBRT标准治疗研究的结果再次强调了辐射剂量对胰腺肿瘤治疗的影响。模拟临床37.5 Gy的“标准”5 Gy×5 BED方案对肿瘤生长几乎没有影响。同时,最高剂量的50Gy方案作为单一疗法显示出最大的肿瘤清除能力,但产生了致命的副作用。与预期不同的是,3 Gy ×15 EBRT 方案与 CP-PTX 联合使用时产生了最佳的肿瘤治疗效果。然而,它只是实现了稳定的肿瘤控制,没有完全缓解。这些结果与131I-ELP近距离放射治疗的肿瘤反应形成鲜明对比,证明了近距离放射治疗的价值。
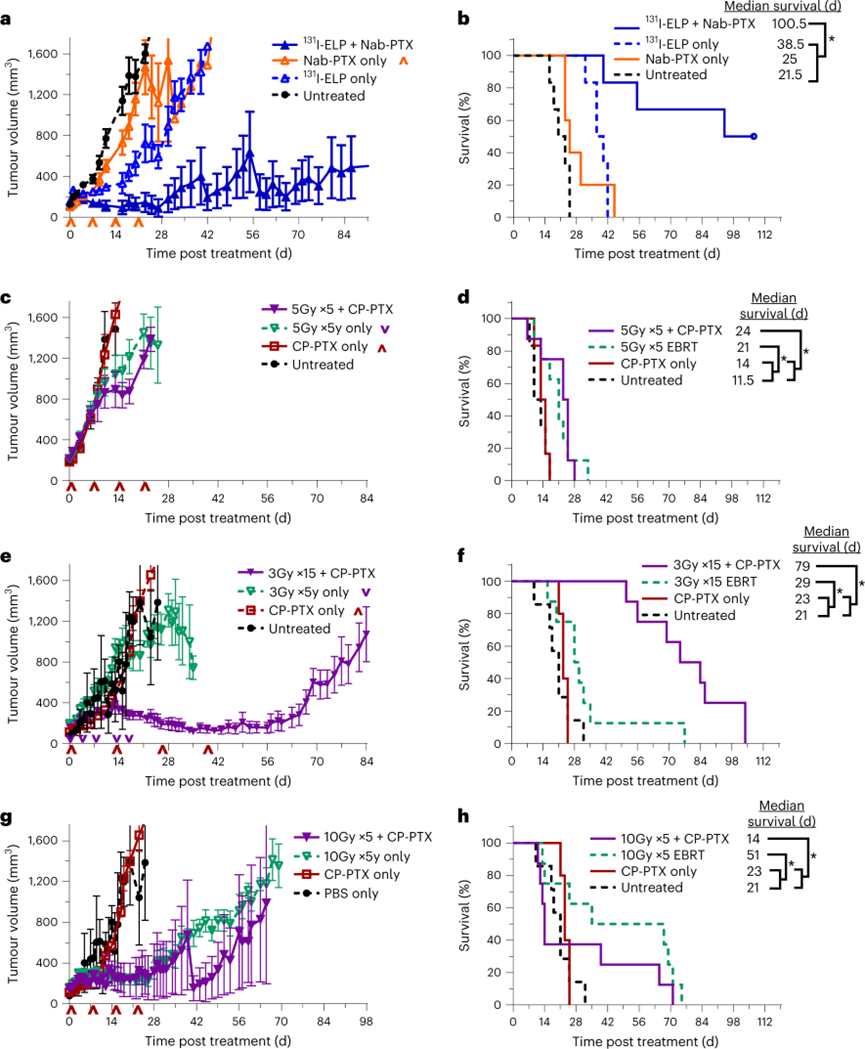
图 当前临床临床标准方案替代联合放化疗对BxPc3-luc2胰腺肿瘤疗效的影响
联合治疗协同作用机制:
接下来,联合治疗有效协同机制进行探讨。首先研究了PTX对细胞周期进展的影响。BxPc3-luc2细胞在体外用不同的PTX处理,并通过流式细胞术分析以评估细胞周期随时间的分布。所有PTX制剂都使得进入辐射敏感G2 / M阶段的细胞比例随逐渐增加。对于不同的放射疗法方式,EBRT每剂仅应用0.5-2分钟,此时许多处于细胞周期耐辐射阶段的肿瘤细胞存活并逃逸。相反,131I-ELP近距离放射使得肿瘤持续暴露于辐射中,确保所有肿瘤细胞在最终进展到G2 / M阶段时都暴露于治疗中。同时,131I-ELP近距离放射治疗还可以确保肿瘤细胞不会暂时缓解以休息,恢复和修复自己。
为了验证这一假设,使用TUNEL染色剂对肿瘤切片以评估肿瘤细胞凋亡。CP-PTX与EBRT治疗表现出有限的TUNEL染色面积,或局限于注射部位或分布均匀但效果不佳。与所有其他治疗组形成鲜明对比的是,131I-ELP与CP-PTX在肿瘤标本中表现出大面积的强烈TUNEL染色。这比任何一种单一疗法都要强得多,并且表明联合疗法的细胞凋亡增加。
这些结果可能有多种原因。首先,PTX介导的肿瘤致敏增加了131I-ELP的有效治疗时间窗口和强度;其次,连续照射方式由131I-ELP在防止肿瘤细胞休息、修复和恢复方面可能比间歇性EBRT照射更有效;最后,可能是131I-ELP近距离放射治疗还可以增强肿瘤内PTX的积累,并使其达到细胞毒性水平。
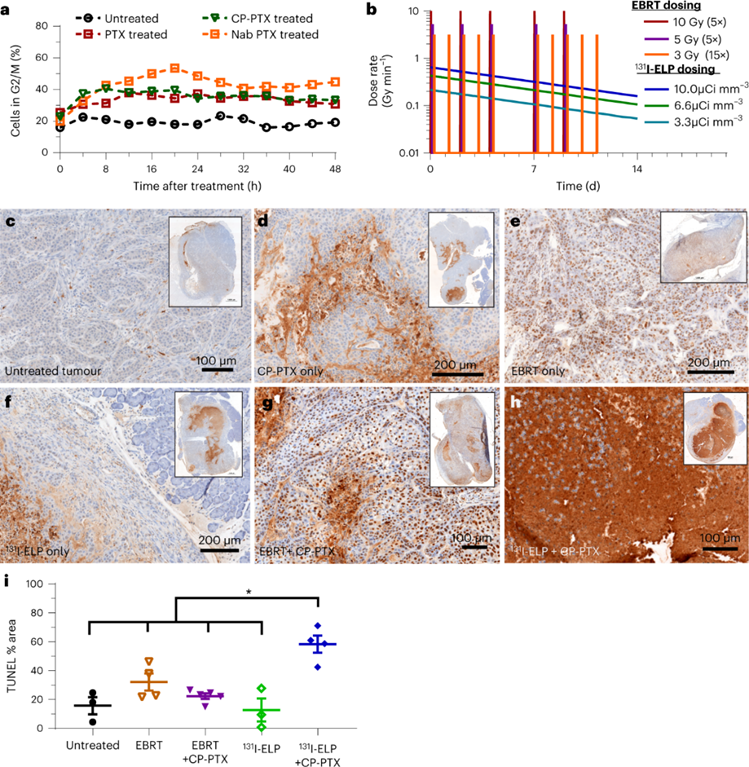
图 放射剂量时间分布与PTX致敏作用对于联合治疗协同作用非常重要
近距离持续性放射治疗对肿瘤微环境的影响:
除了放大胰腺癌细胞内的细胞毒性反应外,作者团队还推测,持续暴露于131I-ELP也可能会诱导肿瘤微环境的实质性变化。胰腺癌拥有独特的肿瘤微环境,除了血管不足和密集基质,其也上调了许多连接蛋白的表达,这些连接蛋白充当生物屏障,抑制化疗药物的渗透和保留。
通过H&E染色评估肿瘤组织学。与EBRT的联合治疗方案相比,131I-ELP的联合疗法具有更大的大面积坏死和具有核多态性的肿瘤细胞。进一步检查基质胶原的完整性,EBRT似乎诱导了相反的效果,肿瘤表现出致密的基质胶原。用Claudin-4,CD-31和CD-144进一步染色。Claudin-4是一种调节细胞旁扩散的紧密连接蛋白,其表达在EBRT联合治疗后未改变。然而,131I-ELP的注射位点E附近的肿瘤细胞中显示出表达减少。这种效应对Claudin-4是特异性的,并且没有扩展到另外两个连接蛋白CD-31和CD-144。肿瘤微环境中的这些病理变化表明,131I-ELP使得调节肿瘤通透性的生物屏障被削弱了。
直接检查放射治疗是否诱导肿瘤摄取和化疗药物滞留的变化。CP-PTX用近红外荧光团进行荧光标记,以使用IVIS光度XR进行体内成像。分析显示,EBRT没有诱导载药纳米颗粒的积累。而131I-ELP治疗的肿瘤中荧光强度超过EBRT,比未经放疗的肿瘤增加198.5%。这些结果最终表明,近距离连续性的131I-ELP照射增强了肿瘤内PTX的穿透和保留。
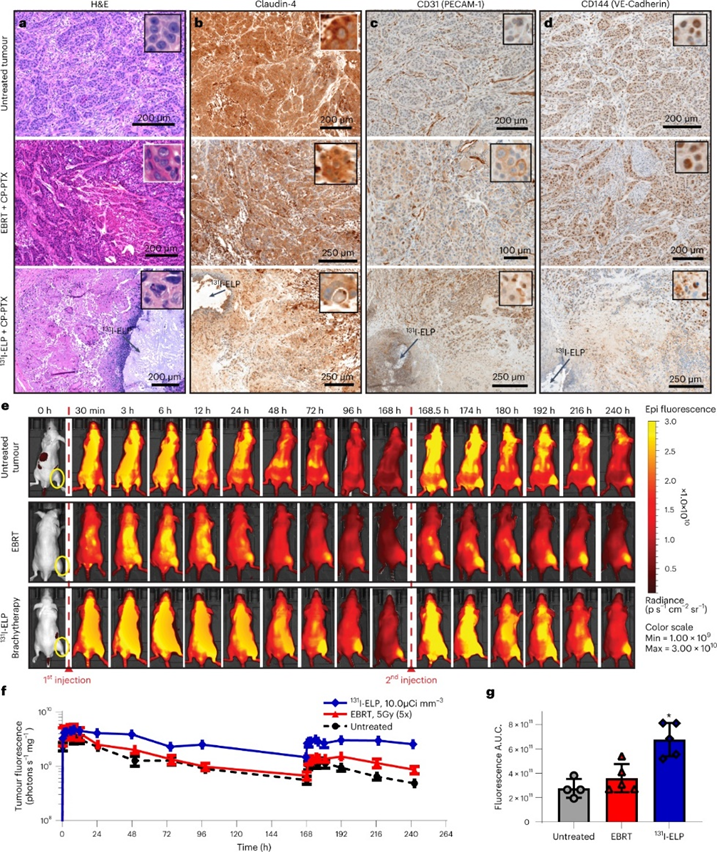
图 原位BxPc3-luc2肿瘤在12 d治疗后显示放疗对肿瘤微环境的影响差异
在多种不同基因型胰腺肿瘤的疗效:
研究联合治疗在不同遗传和表型胰腺肿瘤中的治疗潜力。首先,评估了联合治疗方案是否能成功对抗MIA PaCa-2皮下肿瘤模型。与 BxPc3-luc2 不同,MIA PaCa-2 人类肿瘤细胞系具有常见于患者的 K-ras 突变。结果显示所有治疗小鼠的100%ORR与完全肿瘤消退。中位生存期从未经治疗的小鼠的33 d增加到接受治疗的小鼠的92 d。
随后在AsPc-1皮下肿瘤模型中再次检查抗肿瘤疗效。它具有K-ras和TP5344的基因突变,以及CDKN2A/P16、SMAD4、MAP2K4和FBXW776的缺失。与MIA PaCa-2的表型不同,AsPc-1肿瘤是低血管的,具有高基质密度。联合治疗在AsPc-1模型中诱导了100%的ORR肿瘤反应,7只动物中有2只获得了完全缓解。
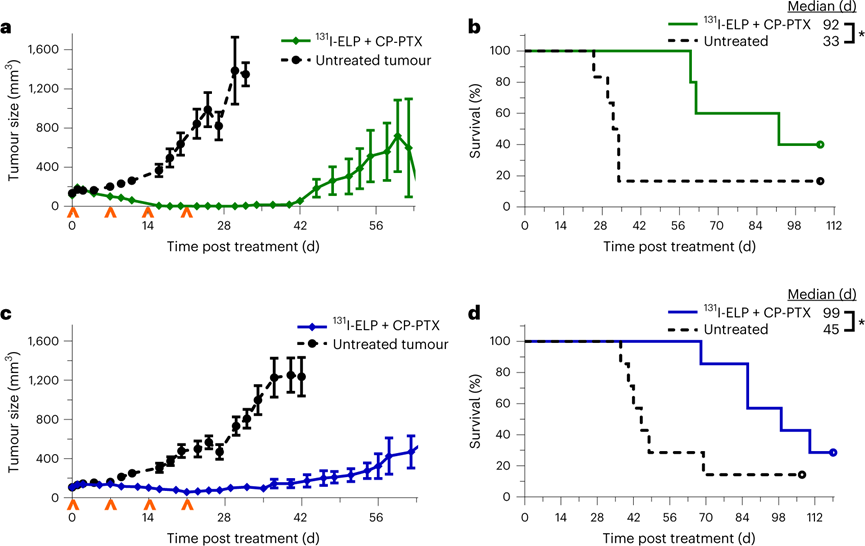
图 优化的联合治疗方案在多种基因型胰腺癌中的治疗效果
原位胰腺肿瘤的疗效与安全性:
最后,评估了联合治疗在原位 BxPc3-luc2 肿瘤模型的治疗效果。由于胰腺的解剖学位置和较高的基质含量,原位瘤比皮下瘤对治疗的抵抗力更强。将肿瘤通过手术植入胰腺造模成功后,通过手术切除肿瘤并注射10μCi mm-3 131I-ELP,随后每周一次以12.5mg kg-1的PTX等效剂量静脉注射CP-PTX持续4周。与未经治疗的肿瘤相比,单一疗法显示出最小的生长抑制。但是,联合治疗实现了100%的ORR,其中83.3%实现了完全缓解,其中没有检测到肿瘤信号。
原位BxPc3-luc2模型还提供了更严谨的模型,这有助于更加合理的评估联合治疗方案的安全性。在131I-ELP单药治疗或联合治疗组,治疗小鼠中没有观察到严重炎症或痛苦的迹象,这与高BED剂量的EBRT治疗研究不同。所有治疗组的血清α-淀粉酶水平均与健康小鼠相似这些结果证实了131I-ELP近距离放射治疗胰腺肿瘤的静脉导管治疗。
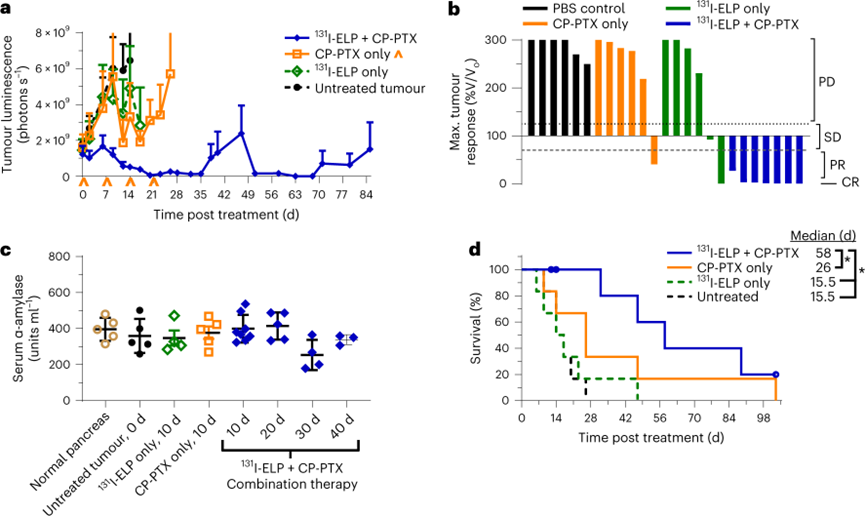
图 联合治疗在原位胰腺移植瘤小鼠模型中的疗效与安全性
小结:
作者团队的研究表明,不仅131I-ELP近距离放射治疗与全身PTX化疗会形成协同治疗作用,而且其疗效在多种胰腺癌模型中都是存在的。在相同的临床前肿瘤模型中,其治疗效果超过了EBRT治疗所达到的生长抑制作用。这些结果与胰腺癌治疗的临床前文献综述形成鲜明对比,目前没有单一或联合治疗方案,在这些肿瘤模型中达到100%的ORR,或在原位胰腺肿瘤模型中达到100%完全缓解。
观察到的协同作用的起源似乎是多方面的。辐射剂量是诱导肿瘤消退的关键因素,但剂量并不是最大化PTX致敏效果的关键因素。相反,关键因素是连续性131I-ELP近距离放射治疗,确保所有肿瘤细胞在达到辐射敏感的晚期G2 / M阶段都可以受到放射治疗。这也阻止了肿瘤细胞在辐射剂量之间休息,修复和恢复。相比之下,EBRT的短暴露时间间隔允许大量高度耐辐射性肿瘤细胞逃逸。更有趣的是发现131I-ELP可以打破微环境屏障,改善肿瘤通透性。长期以来,微环境屏障一直是胰腺癌耐药性的来源,克服这一障碍一直是临床研究的一个主要焦点。PTX化疗与131I-ELP近距离放射治疗在肿瘤内产生局部正反馈回路。首先,131I-ELP辐射可降低肿瘤内的分子通透性屏障,以增加紫杉醇的积累。然后,药物使肿瘤组织对辐射的细胞毒性作用敏感。最后,辐射使降低微环境和基质内连接蛋白的水平导致随后化疗时紫杉醇摄取增加,从而导致协同治疗的良性循环。这种渗透率增强表明131I-ELP可以成功地与其他化疗药物联合使用,以驱动放射致敏,调节微环境并直接促进细胞毒性。
目前临床上,无论分期如何的胰腺癌治疗的预后都不容乐观。因为高复发率和低生存率的持续存在,临床证据继续强调需要改进局部疾病的治疗方式。随着胰腺癌成为美国癌症死亡的第二大原因,可以预见的是对于胰腺癌更加有效的治疗方案的临床诉求将会越来越多。通过利用材料科学和药物输送方面的进步,作者团队的研究结果表明了放射治疗医学治疗胰腺癌的巨大潜力。
参考文献:
Jeffrey L Schaal, Jayanta Bhattacharyya, Jeremy Brownstein, et al. Brachytherapy via a depot of biopolymer-bound 131I synergizes with nanoparticle paclitaxel in therapy-resistant pancreatic tumours. Nat Biomed Eng. 2022 Oct;6(10):1148-1166.
https://www.nature.com/articles/s41551-022-00949-4











