干扰素基因刺激因子(STING)在DNA感应中起重要作用,从而启动先天性免疫反应。病原体来源的DNA和自身DNA首先由环鸟苷一磷酸腺苷(cGAMP)合成酶(cGAS)检测,该合成酶产生2′,3′-cGAMP,结合内质网中的STING并促进向高尔基体的转运。STING激活最终通过激活TANK结合激酶1(TBK1)/干扰素调节因子3(IRF3)和IKK。STING通路对多种癌症治疗的反应至关重要,并与放疗、靶向治疗和化疗后的癌症免疫有关。尽管STING途径是一个有吸引力的治疗靶点,但有效的全身给药仍然是一个挑战。
二甲基黄嘌呤乙酸(DMXAA)在小鼠模型中表现出优异的抗肿瘤效果,但在III期试验中失败,后来发现对人STING没有结合亲和力。细菌衍生的环状二核苷酸(CDN),如环状二聚腺苷一磷酸(CDA)和环状二聚鸟苷一磷酸,通过小鼠和人类STING信号传导介导免疫应答,但生物利用度和稳定性较差。CDN衍生物(如ADU-S100和MK-1454)的局部递送仅显示出适度的临床反应,最近的口服和锰基制剂已在有限数量的临床前模型中证明了系统递送的一些前景。因此,对于避免降解并靶向肿瘤微环境(TME)的高效、系统性STING激动剂递送系统的需求仍未得到满足。
基于纳米粒子(NP)的药物递送因其改善药物药代动力学、靶向肿瘤和减少副作用的能力而受到关注。由于NP的大小,由于血管系统改变和淋巴引流受损,NP往往会被动积聚在肿瘤中。纳米级配位聚合物(NCP)由无毒的磷酸锌亲水核和由聚乙二醇(PEG)-共轭磷脂(ZnP)组成的脂质双层组成,可负载亲水和疏水部分,并可用于刺激触发药物释放,与传统NP设计相比具有优势。
鉴于此,美国芝加哥大学Ralph R. Weichselbaum院士、林文斌教授等研究人员确定了一种靶向肿瘤的CDA负载的NCP(ZnCDA),其具有有效的免疫刺激特性。

核-壳ZnCDA的合成采用两步法。载CDA的磷酸锌核是通过Zn(NO3)2、磷酸钠和CDA在反相微乳液中的配位聚合,并用1,2-二油酰基-sn-甘油-3-磷酸盐(DOPA)的单钠盐进行表面覆盖而制备的,得到Zn平均直径为47.2nm。将这些颗粒进一步用1,2-二油基-sn-甘油-3-磷酸胆碱(DOPC)、胆固醇和1,2-二硬脂酰-sn-丙基-3-磷酸乙醇胺-N-[氨基(聚乙二醇)2000](DSPE-PEG2000)的2:1:1混合物涂覆以形成直径为111.8 nm。ZnCDA中的最终CDA负载为2.63 ± 0.08 wt%。
研究人员使用THP1 STING报告细胞验证ZnCDA的免疫刺激活性。体内研究表明,ZnCDA具有剂量依赖性的抗肿瘤作用和瞬时可逆体重减轻。静脉注射ZnCDA延长CDA循环并有效靶向肿瘤,在一组不同的临床前癌症模型中以单一剂量介导稳健的抗肿瘤效应。
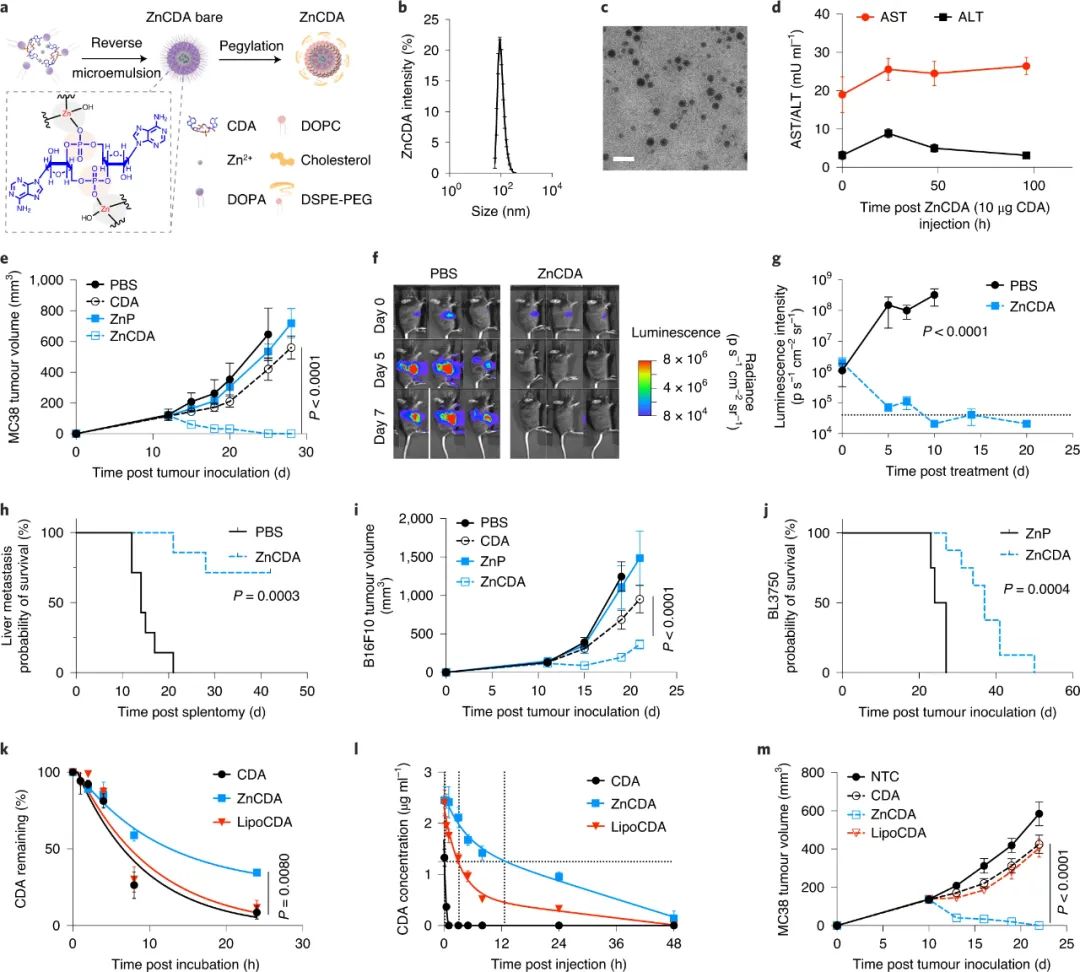
图|全身性给药ZnCDA抑制小鼠原发性和转移性肿瘤生长
值得注意的是,研究结果揭示了ZnCDA肿瘤积聚的新机制;该研究结果表明,ZnCDA通过破坏肿瘤血管系统中的内皮细胞来增强肿瘤积聚。ZnCDA优先靶向肿瘤相关巨噬细胞,以调节抗原处理和呈递。此外,ZnCDA在免疫“冷”胰腺和神经胶质瘤模型中恢复了放射治疗和免疫检查点抑制剂的抗肿瘤活性,这为治疗顽固性人类癌症提供了一种有前景的联合策略。
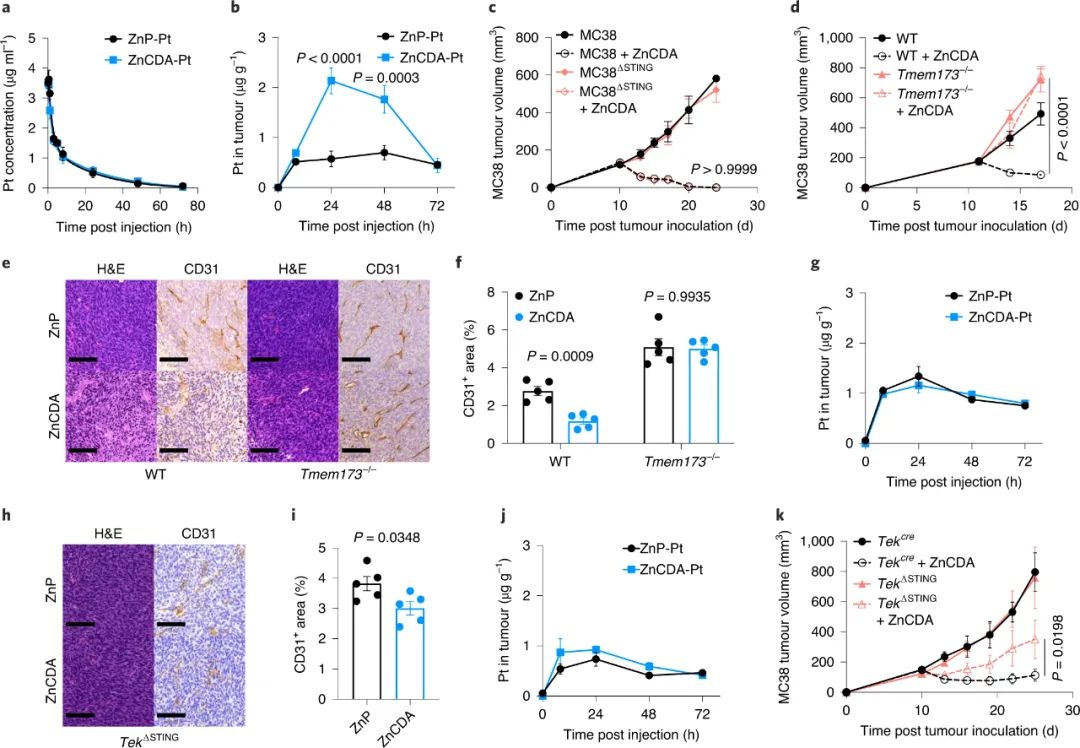
图|ZnCDA破坏肿瘤血管系统以增强其在肿瘤中的沉积
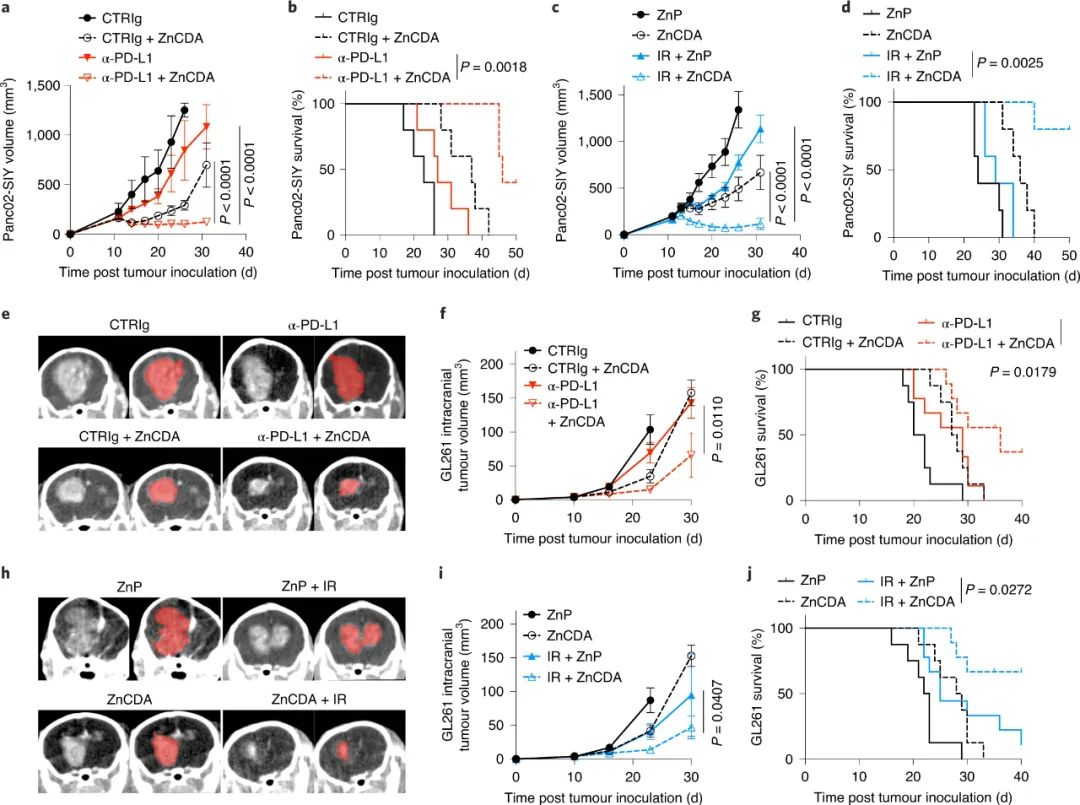
图|ZnCDA与ICB或IR结合以克服治疗耐受
纳米材料的应用因其增强化疗药物、基因和免疫刺激剂的递送能力而在癌症治疗中受到关注。研究人员开发了一种基于NCP平台的纳米制剂肿瘤靶向STING激活剂ZnCDA,它在小亲水分子递送方面优于传统NP。出乎意料的是,肿瘤细胞中的STING激活导致了血管系统的快速破坏,这进一步增强了肿瘤中ZnCDA的积累。内皮细胞STING激活可能用于增加肿瘤靶向药物递送。
STING激动剂瘤内给药后的研究表明,IFN-I对于STING活化介导的抗肿瘤作用是必不可少的。该研究表明,不同的制剂或递送策略可能通过替代途径抑制肿瘤生长,这是一个主要的治疗优势。研究人员发现ZnCDA优先靶向并调节TAM的抗原处理和呈递,从而进一步促进抗肿瘤T细胞应答。CSF1R信号传导的阻断减少了TAM并消除了ZnCDA的抗肿瘤能力。
综上所述,ZnCDA增强了自身的肿瘤靶向性,重振了TAM以促进抗肿瘤T细胞免疫,并克服了“冷”表型。此外,ZnCDA和ICB或IR的组合为克服顽固性人类癌症的耐药性提供了一种概念验证的治疗策略。
参考文献:
Yang, K., Han, W., Jiang, X. et al. Zinc cyclic di-AMP nanoparticles target and suppress tumours via endothelial STING activation and tumour-associated macrophage reinvigoration. Nat. Nanotechnol. (2022).
https://doi.org/10.1038/s41565-022-01225-x











