传统的近红外一区荧光成像由于信噪比低、背景信号强等缺点,对诊疗产生严重的干扰。在近红外第二生物窗口(NIR-II),生物组织自身的吸收和散射弱,这样就可以极大程度的规避第一窗口探针的缺点。另外,单一模态成像方式所获取的信息有一定的局限性,不能完全反映生物体的复杂性。整合二区荧光材料和可降解的磁性纳米粒子于一体,进行二区荧光(NIR-II FL)和磁共振成像(MRI)的双模态成像,从而实现分子影像技术的光、核、磁等技术的多角度综合集成,弥补单一模态成像的局限。使获取更精确、更高分辨率和信噪比的生物体信号成为可能。
宋继彬教授课题组报道了一种可降解的磁性氧化铁基双模分子影像探针(IO/DCNP@PP),并将其应用于NIR-II FL/MRI成像指导的癌症精准机械治疗(图1)。该团队采用乳液法将脱镁叶绿酸A(PP)修饰的磁性氧化铁(Fe3O4)纳米粒子和二区荧光纳米粒子DCNP组装成复合纳米球(IO/DCNP@PP)。再静脉给药IO/DCNP@PP和MnO2@PEG后,纳米粒子在肿瘤内富集。在恒定磁场的介导下,IO/DCNP@PP沿磁力线方向克规则排列成结构有序的纳米链,近一步利用肿瘤微环境中过表达的特征分子谷光肝肽(GSH)和MnO2反应生成的Mn2+与PP的配位作用使形成的磁性纳米链固定。在活体成像指导下,及在转磁场作用在下,肿瘤细胞内形成的纳米链随着旋转磁场方向的改变随之可控转动,其产生的机械力能够有效地破坏细胞器结构,从而使癌细胞凋亡,最终实现双模态活体成像指导的癌症精准机械治疗。
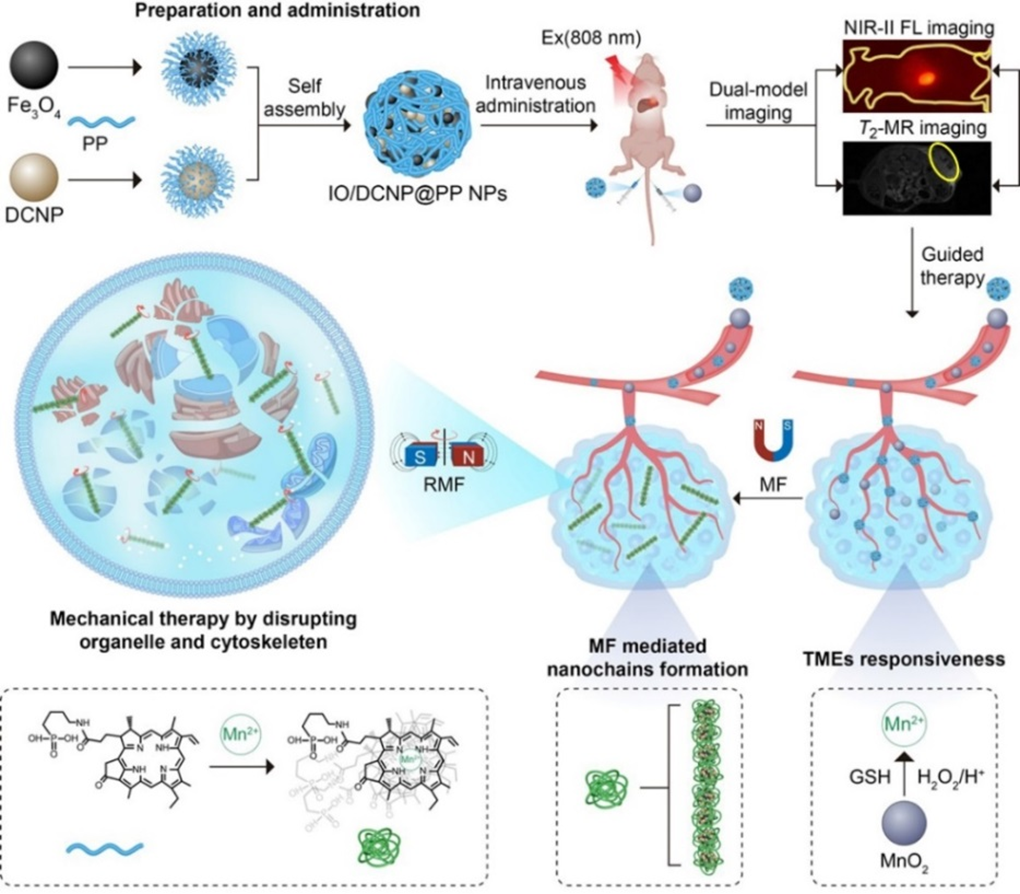
图1.示意阐述双模态分子探针(IO/DCNP@PP)的制备及其在NIR-II FL/MRI成像指导的癌症机械治疗中的应用。
在本工作中,作者先后利用恒定磁场,旋转磁场,以及磁性材料和荧光分子的协同应用实现癌症的机械治疗,同时双模态活体成像可实时监测探针在肿瘤中的分布情况(图2)。MRI成像结合二区荧光成像背景信号弱、信噪比高等优点,既能对肿瘤区域实现组织结构精确成像,又能对探针在体内的分布进行定性分析,同时对肿瘤在旋转磁场下的机械治疗引起的影像改变的病理学基础通过原位、实时、双模态可视化成像提取的信息进行分析研究。
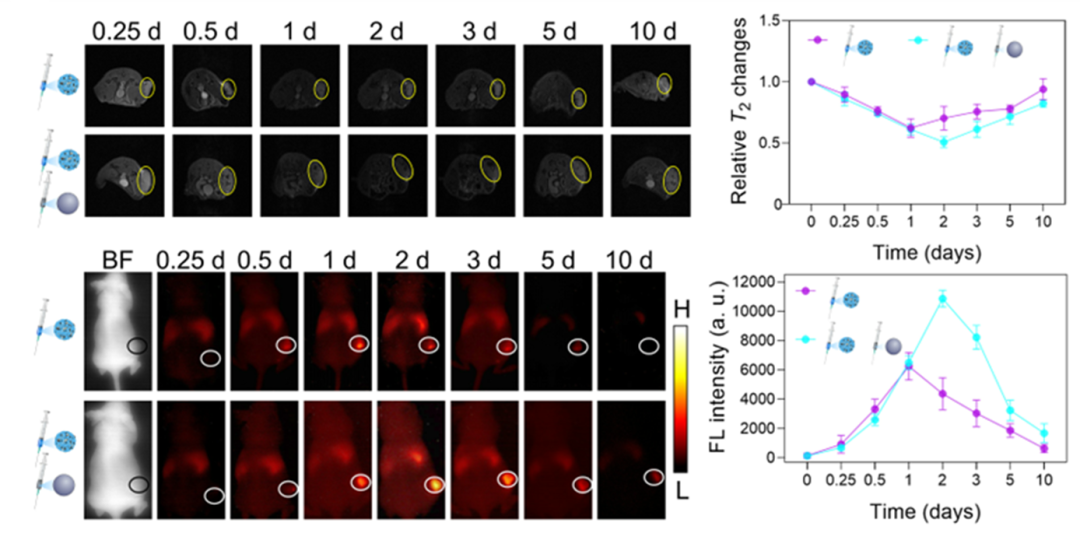
图2.静脉注射纳米探针及在肿瘤部位特异性形成纳米链后,荷瘤小鼠的MRI和NIR-II FL成像图片及其信号强度随时间的变化曲线。
【小结】
宋继彬教授课题组围绕活体成像及疾病诊疗方面开展了系列研究工作,代表性工作包括:活体比率光声成像(Angew. Chem. Int. Ed. 2022, 61, 10.1002/anie.202213319;Angew. Chem. Int. Ed. 2021, 60, 17647-17653; Adv. Funct. Mater. 2020,30, 2001771)、活体比率荧光成像(Angew. Chem. Int. Ed. 2021, 60, 20888-20896; ACS Nano 2022, 16, 2889–2900)、双模比率活体成像(Angew. Chem. Int. Ed. 2021, 60,7323-7332; Adv. Funct. Mater. 2022, 31, 202208720; Small, 2022,18, 202202551)及成像指导的治疗及实时疗效评估(Angew. Chem.Int. Ed. 2022, 61, e 202112237; Chem 2022, 10.1016/j.chempr.2022.07.001)。
文章信息:
https://onlinelibrary.wiley.com/doi/abs/10.1002/anie.202213319











