
抑制免疫细胞功能的细胞表面受体(即所谓的“抑制性免疫检查点”受体)的药理学阻断是过去十年癌症治疗中最成功的进展之一。尽管这些疗法所针对的受体,例如程序性细胞死亡蛋白 1 (PD-1),通常存在于 T 细胞上,但在其他免疫细胞谱系上表达的受体,特别是巨噬细胞,也可以作为治疗益处的目标。一个这样的例子是信号调节蛋白 α (SIRPα) 受体。
巨噬细胞是具有“吞噬”和破坏癌细胞能力的免疫细胞,这一过程称为“吞噬作用”。它们还将摄入的癌细胞蛋白降解成小肽,然后它们可以作为抗原呈递给 T 细胞,从而产生针对肿瘤的抗原特异性免疫反应。吞噬作用受到巨噬细胞上“吃我”(促吞噬)和“别吃我”(抗吞噬)受体之间的平衡的严格控制,配体可能存在或不存在于肿瘤上细胞。对于非凋亡性肿瘤细胞,巨噬细胞上的“吃我”受体包括抗体的不变片段可结晶(Fc) 部分的受体(FcR)和信号淋巴细胞活化分子家族 7 (SLAMF7),一种将其他 SLAMF7 识别为配体的同型受体肿瘤细胞上的分子。由于 SLAMF7 仅限于造血细胞,因此它仅用于造血细胞的吞噬作用。最典型的别吃我的受体是 SIRPα,它识别为在肿瘤细胞上广泛表达的配体 CD47。癌细胞通常通过增加其细胞表面的 CD47 量来逃避吞噬作用。
仔细研究表明,单纯阻断 SIRPα-CD47 免疫检查点,使用针对 SIRPα 或 CD47 的阻断抗体或使用可溶性 SIRPα,不足以在体外触发吞噬作用并诱导体内肿瘤细胞的消除。需要共同参与诸如 FcR(通过针对肿瘤细胞表面分子的抗体)或 SLAMF7(在SLAMF7阳性造血癌细胞如淋巴瘤和多发性骨髓瘤中)等“吃我”受体。这些要求可能解释了为什么在SIRPα-CD47阻断疗法的1期和2期临床试验中,造血恶性肿瘤,特别是淋巴瘤和Sezary综合征获得了最令人鼓舞的结果。在炎症环境中,促吞噬细胞受体如CD11a和CD11c也可以介导吞噬作用。这种获得的能力可能解释了为什么一些研究人员报告在SIRPα-CD47 阻断期间通过 FcR 和 SLAMF7 独立过程吞噬 SLAMF7 阴性肿瘤细胞。
为了扩大对 SIRPα-CD47 阻断敏感的癌症类型的范围,德克萨斯大学 MD 安德森癌症中心Wen Jiang、Betty Y. S. Kim等人开发了双特异性纳米颗粒(命名为BiTN),其中纳米颗粒与抗人表皮生长因子受体 2(HER2)单克隆抗体和重组 SLAMF7 结合,进而诱导强大的吞噬作用并激活吞噬细胞cGAS-STING通路,使肿瘤对免疫检查点抑制剂敏感。
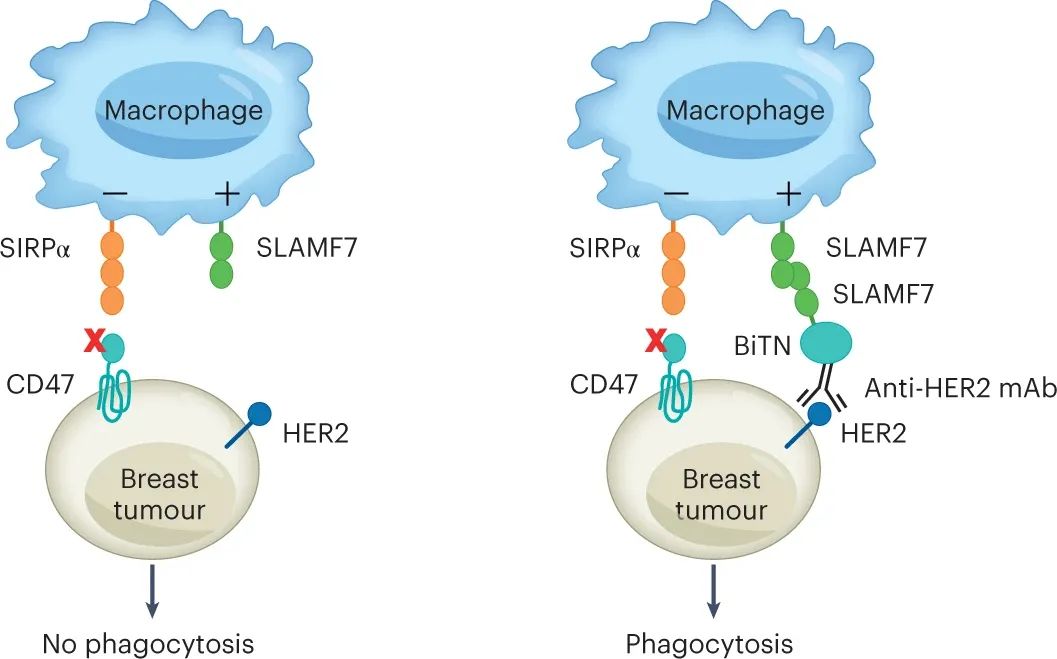
图|纳米缀合物可扩大对巨噬细胞免疫治疗敏感的实体肿瘤细胞的范围
这些抗 HER2-SLAMF7 纳米缀合物专门靶向表达 HER2 的乳腺癌细胞,用 SLAMF7 人工修饰乳腺癌细胞。该过程导致响应于 SIRPα-CD47 阻断的吞噬作用显著改善。它还改善了小鼠体内 SIRPα-CD47 阻断期间的肿瘤细胞消除,且没有毒性证据。
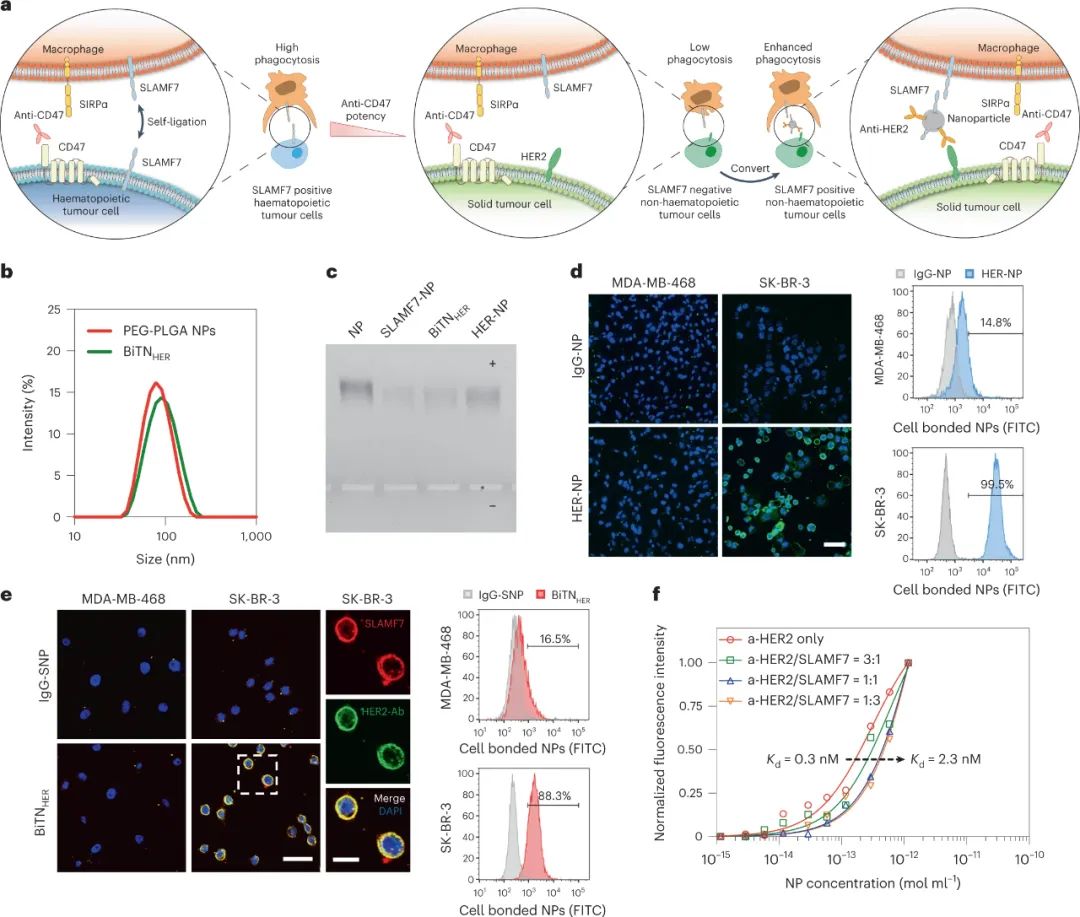
图|BiTNHER纳米颗粒靶向特定的非造血癌细胞并将其转化为造血样癌细胞
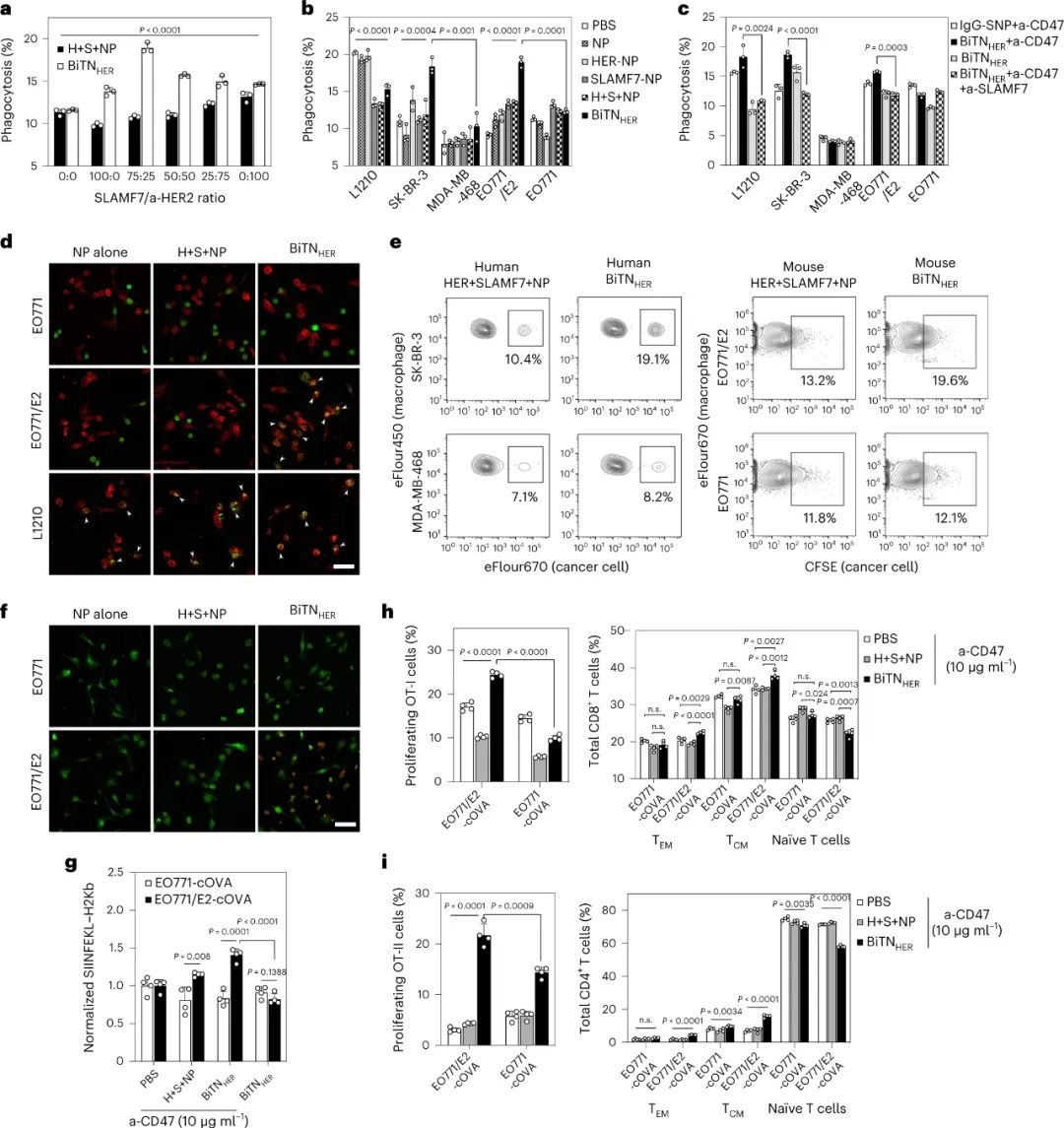
图|抗 CD47 和 BiTNHER 的组合诱导癌细胞的靶向吞噬作用和随后的巨噬细胞活化
纳米缀合物的部分体内作用是由巨噬细胞在吞噬作用后启动抗原特异性抗肿瘤 T 细胞反应的能力介导的。通过同时阻断T 细胞抑制性免疫检查点 PD-1,进一步增强了纳米缀合物在SIRPα-CD47 阻断期间的体内抗肿瘤作用。纳米缀合物的影响需要用SLAMF7修饰肿瘤细胞和SLAMF7在巨噬细胞上的表达,但与抗HER2抗体的Fc部分无关。因此,它是通过触发巨噬细胞上的 SLAMF7 而不是 FcR 来介导的。
通过改变缀合物中SLAMF7与抗HER2抗体的比例,发现3:1的SLAMF7:anti-HER2比例触发了最高程度的吞噬作用。尽管未测试较高的比率,但较低的比率在增强吞噬作用方面的效率较低。这一观察结果表明,肿瘤细胞上存在的SLAMF7分子的数量可能对于通过这种机制导致高效吞噬作用至关重要。对于大多数受体(包括吃我受体)而言,它们的正常功能需要最佳的受体聚类。
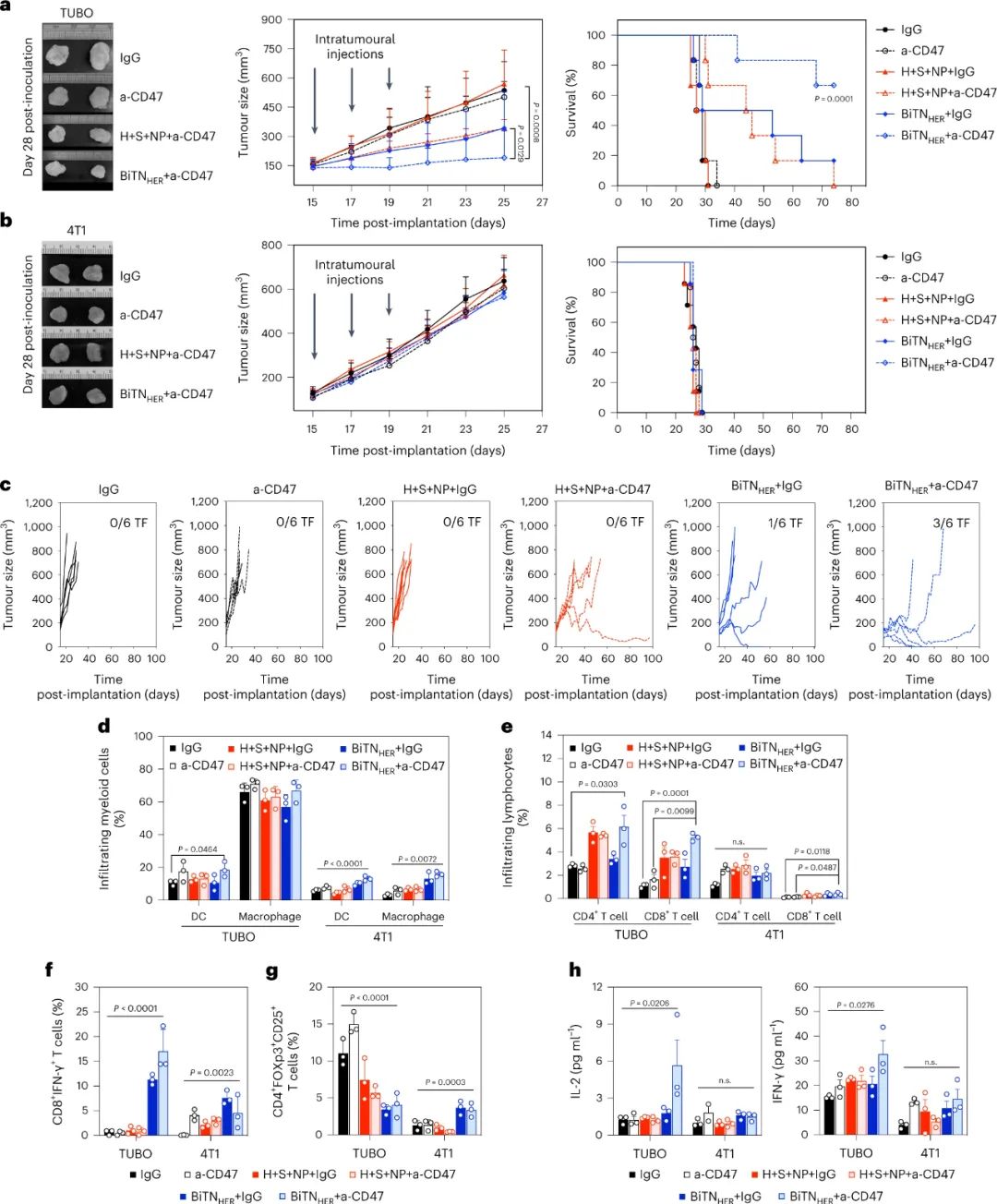
图|BiTNHER和抗 CD47 的联合治疗在 HER2/neu 表达的小鼠肿瘤模型中诱导抗肿瘤免疫反应
当配体用量不足甚至过量时,这些功能可能受损。当工程缀合物用于实验或治疗目的时,适当的化学计量值得仔细考虑。沿着这些思路,值得注意的是,淋巴瘤细胞和正常活化的 B 细胞在SIRPα-CD47阻断期间可以抵抗吞噬作用,尽管它们表面似乎表达了非常大量的 SLAMF7。一种可能性是这些细胞上的 SLAMF7 分子数量不适合适当的受体聚类。也许,他们太高了。在这种情况下,有趣的是,进一步增加纳米缀合物中SLAMF7的量是否也会抑制吞噬作用将是很有意义的。
尽管用 SLAMF7 修饰肿瘤细胞促进了吞噬作用,但有人可能认为,只需用具有完整 Fc 部分的抗肿瘤抗体包被肿瘤细胞即可实现类似的结果,然后可以触发巨噬细胞上的 FcR,导致吞噬作用。值得注意的是,在 SIRPα-CD47 阻断的情况下,已知向许多类型的癌细胞添加抗肿瘤抗体会通过 FcR 刺激抗体依赖性吞噬作用。然而,抗肿瘤抗体对 FcR 的长时间刺激会导致巨噬细胞功能的有害变化,从而获得免疫抑制特性。这种改变可能会导致抑制性免疫检查点治疗期间出现的肿瘤“过度进展”综合征,从而影响患者的预后。因此,最好避免长期与治疗性抗体接触 FcR。用 SLAMF7 等天然配体修饰肿瘤细胞可能更合适。
总之,研究人员发现为“免疫转化”策略提供了一个引人注目的例子,该策略拓宽了适用于某些类型免疫治疗的肿瘤类型的范围。尽管报道的研究集中于乳腺癌细胞,但有理由提出类似的方法可能适用于其他类型的实体肿瘤,如结肠癌和肺癌。作者还强调了T细胞以外的免疫细胞,特别是巨噬细胞,作为抗肿瘤免疫治疗的效应器的有用性。最后,这些结果进一步支持了SLAMF7是巨噬细胞上的一种有效的“吃我”受体的观点,并且SLAMF7可能是治疗人类癌症的有效治疗益处。
参考文献:
Lu, Y., Huntoon, K., Lee, D. et al. Immunological conversion of solid tumours using a bispecific nanobioconjugate for cancer immunotherapy. Nat. Nanotechnol. (2022).
https://doi.org/10.1038/s41565-022-01245-7











