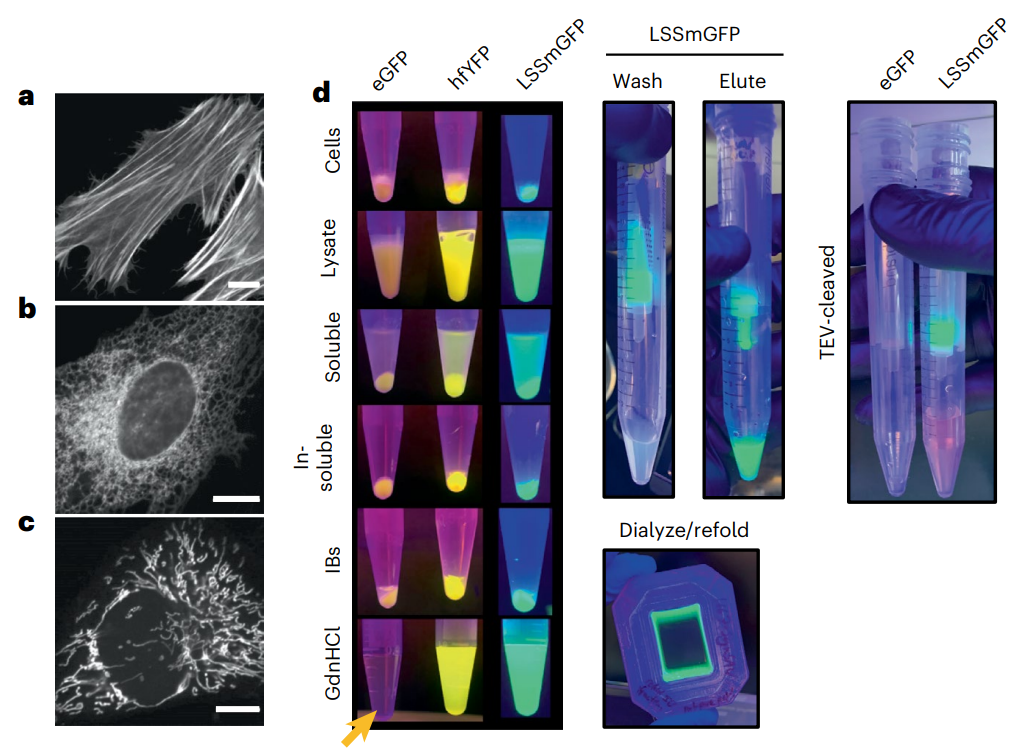
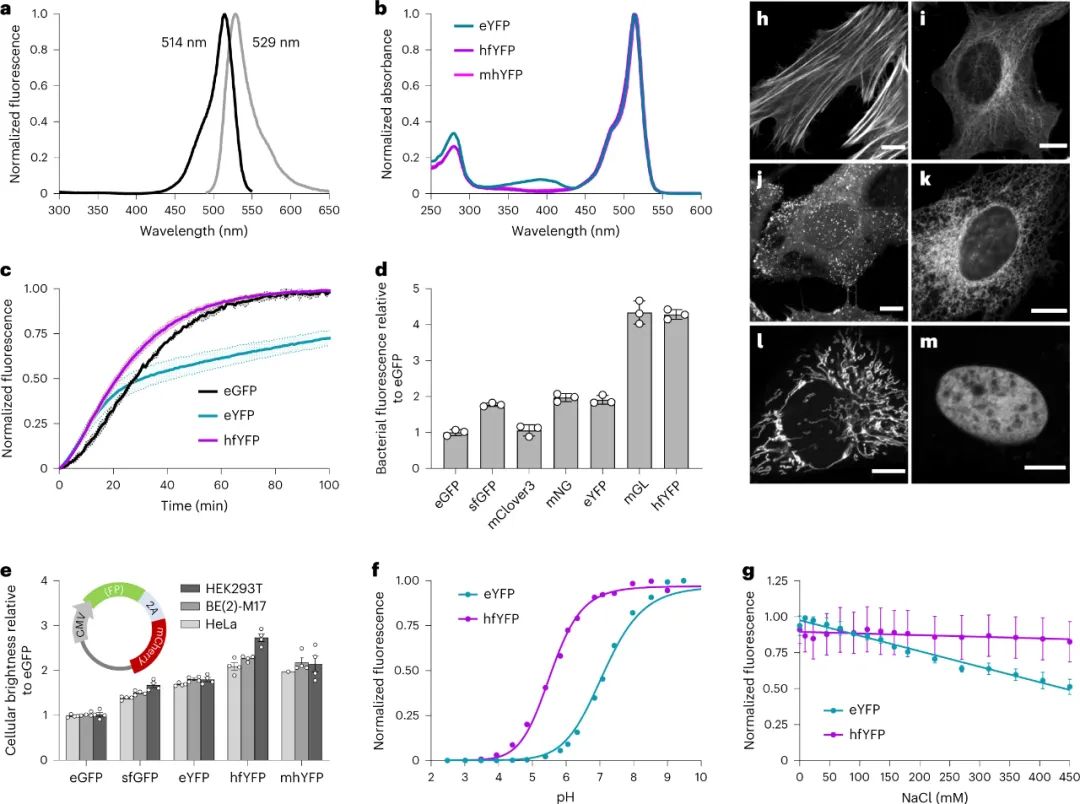
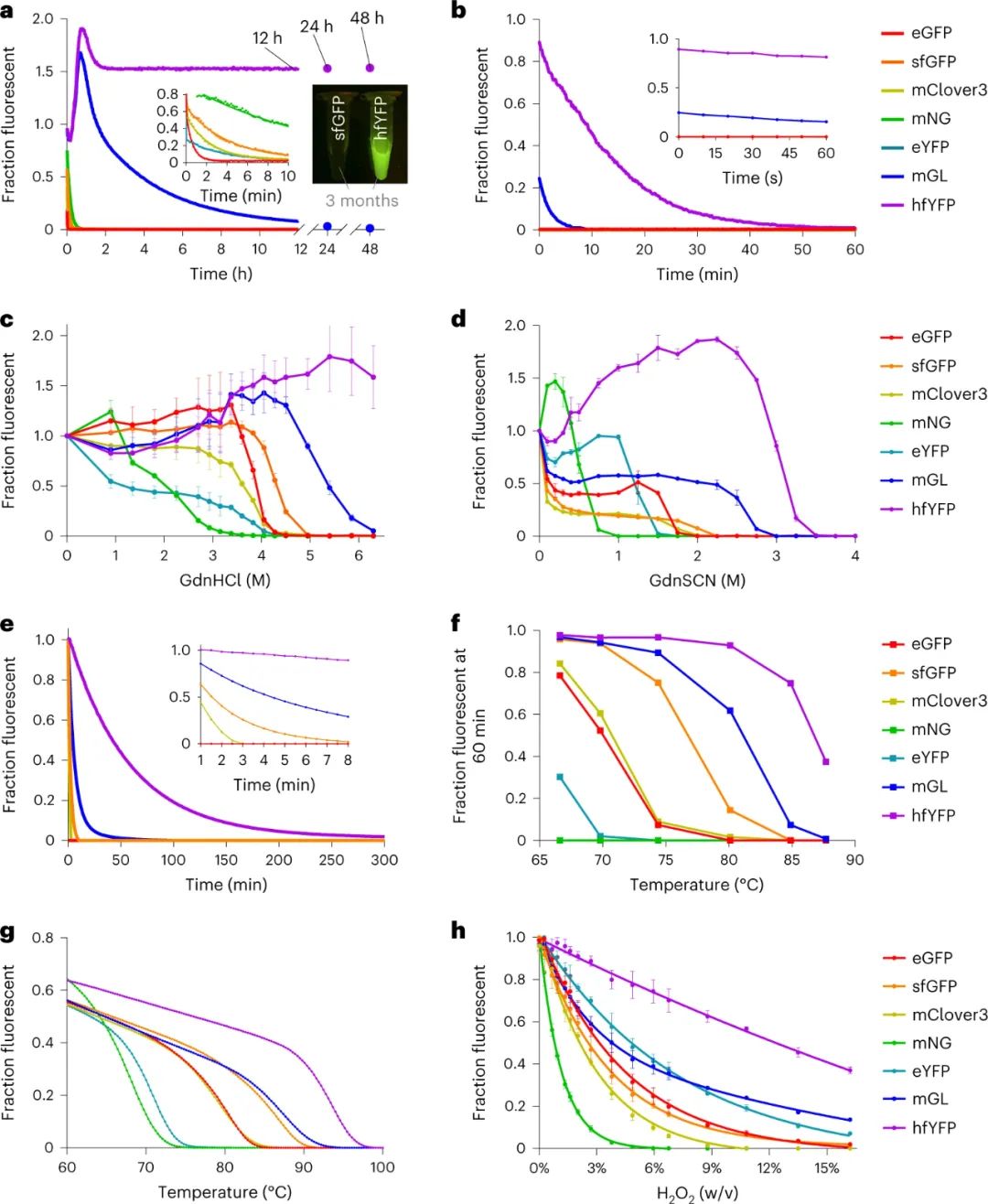
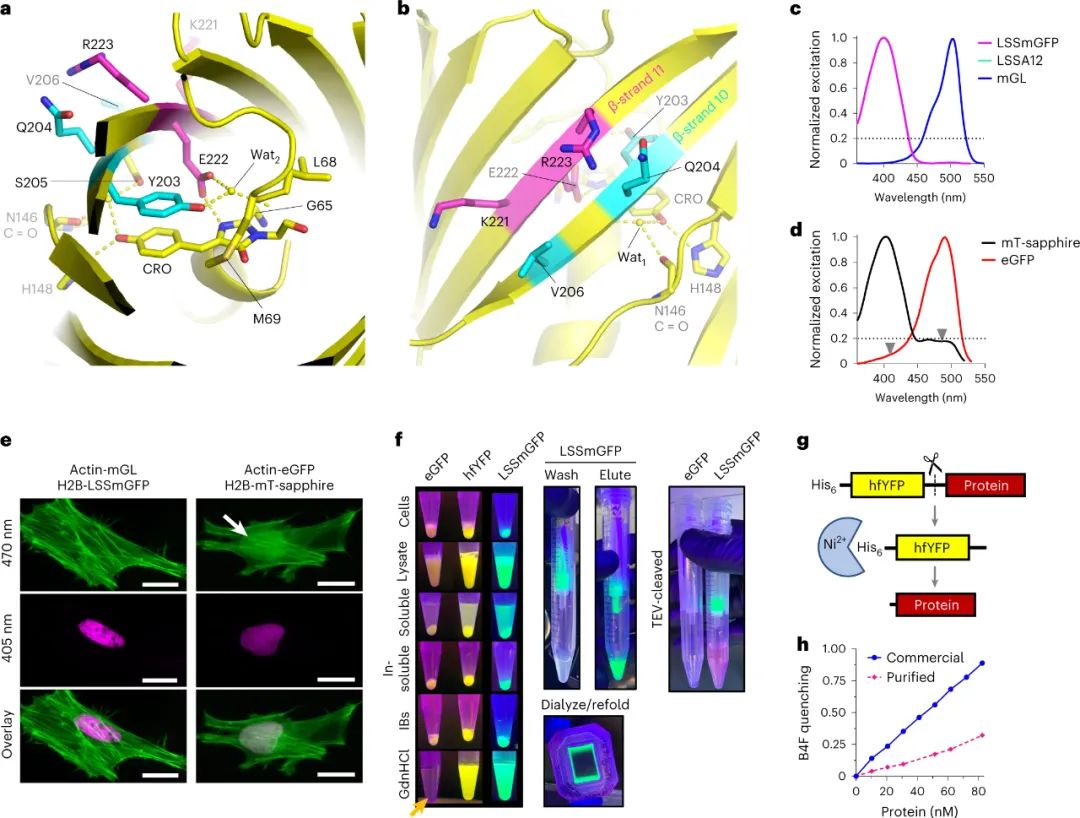
近三十年来,荧光蛋白 (FP) 一直被用于探测细胞生物学,但传统的荧光蛋白 (FP) 不适合现代组织处理和固定样品的超分辨率 (SR) 显微镜的实验条件。即使是通过多聚甲醛对细胞或组织进行常规固定也会减少FP信号,并且保存条件(例如组织透明化,一种通过最小化其散射和吸收的光来使样品透明的技术)比FP进化和设计的条件更苛刻。光电关联显微镜 (CLEM) 是一种超分辨率技术,需要使用四氧化锇 (OsO4)制备样品,这是一种强大的固定剂,可以保留超微结构,但会使蛋白质变性。尽管已经开发出对 OsO4 具有更高耐受性的 FP,但仍然存在固定剂耐受性 FP 选项稀缺且探索不足。类似地,大多数蛋白质在盐酸胍 (GdnHCl) 溶液中迅速变性,盐酸胍是一种离液剂(一种在水溶液中破坏水分子之间氢键的分子),通常用于溶解和重新折叠错误折叠的蛋白质。可以承受浓缩 GdnHCl 的 FP 将促进明亮发光的色谱纯化,而不是不可见的未折叠蛋白质,并可能为组织学开辟新的选择。先前,加州大学Benjamin C. Campbell等人根据报道和假设的结构-功能关系,通过突变来自Aequorea victoria水母的 FP,设计了一种亮绿色 FP,mGreenLantern (mGL),这增强了它在哺乳动物细胞中的溶解度、稳定性和表达水平。研究人员认为mGL在蛋白质保留扩展显微镜(proExM,一种使用衍射极限显微镜对通过化学过程物理放大的保存标本进行纳米级成像的技术)和组织清除中的良好性能是由于其高熔化温度和抗化学变性(例如,通过GdnHCl),因此,研究人员筛选了大型基于mGL的库,以寻找具有改进的化学和热稳定性的变体。于此,该课题组筛选出了一种非常稳定的黄色荧光蛋白(YFP),即“超折叠YFP”(hfYFP)的合理工程,该蛋白能够承受在数秒内变性大多数生物结构的离液条件,包括超折叠绿色荧光蛋白(GFP)。最强大的突变体“超折叠”黄色荧光蛋白在靶向细胞结构时定位正确,而且,它在7 M GdnHCl中保持荧光数月,而增强型绿色荧光蛋白(eGFP)甚至超折叠GFP(sfGFP)在同一溶液中则立即变性。hfYFP耐受OsO4和CLEM的脱水和塑胶树脂包埋步骤。使用hfYFP,研究人员使用台式LED条可视化了常规的通过亲和层析变性蛋白质纯化的所有步骤,使分离蛋白质组分和监测蛋白水解切割变得更加容易。在本研究中产生的晶体结构的基础上,研究人员突变了hfYFP并生成了具有高化学稳定性的 405 nm可激发的GFP:大斯托克斯位移单体 GFP (LSSmGFP)。它具有与mT蓝宝石相同的光稳定性,并且由于LSSmGFP中不存在mT蓝宝石中存在的残余488nm激发带,因此消除了用GFP进行多色成像期间的荧光渗漏。图|LSS-GFP的结构导向工程及其在荧光辅助蛋白纯化中的应用hfYFP比 sfGFP 稳定得多,并且由于sfGFP支架和突变对许多生物传感器、效应器和其他分子工具都有贡献,研究人员设想 hfYFP、其单体变体 mhYFP 和mGL 变体 FOLD6 —具有高分辨率晶体结构(分别为1.7Å、1.6Å和1.2Å)—成为创建和改进下一代生物传感器和其他工具的有用模板。当使用eGFP或sfGFP仅产生非荧光、错误折叠的蛋白质时,研究人员已经使用 hfYFP 开发了高度响应的小分子和还原和氧化电位生物传感器。该hfYFP 是一个“超折叠”原型。hfYFP 与 proExM 兼容,但mGL 的稳定性和高亮度的结合仍然使其成为这种模式的更好选择。相比之下,hfYFP 是 CLEM 的更好选择,因为它可以承受 OsO4。hfYFP 的最大限制可能是其在激光扫描共聚焦照明下的光稳定性相对较低:它比 eGFP 和Clover(GFP 变体)漂白(失去荧光)更快。最后,hfYFP的耐久性可能使其在细胞中积累并抵抗蛋白水解降解;因此,高稳定性的优势取决于应用。从超折叠晶体结构中可以学到很多东西。生物物理实验可以揭示hfYFP在其他FP被破坏时抵抗GdnHCl和热量的机制,这一发现可能有助于蛋白质折叠和稳定性的基础知识。
我们期待看到化学稳定的 FP 可以在整个生物科学的实验中发挥什么作用!
参考文献:
Campbell, B.C., Paez-Segala, M.G., Looger, L.L. et al. Chemically stable fluorescent proteins for advanced microscopy. Nat Methods (2022).
https://doi.org/10.1038/s41592-022-01660-7