特别说明:本文由学研汇技术中心原创撰写,旨在分享相关科研知识。因学识有限,难免有所疏漏和错误,请读者批判性阅读,也恳请大方之家批评指正。研究背景
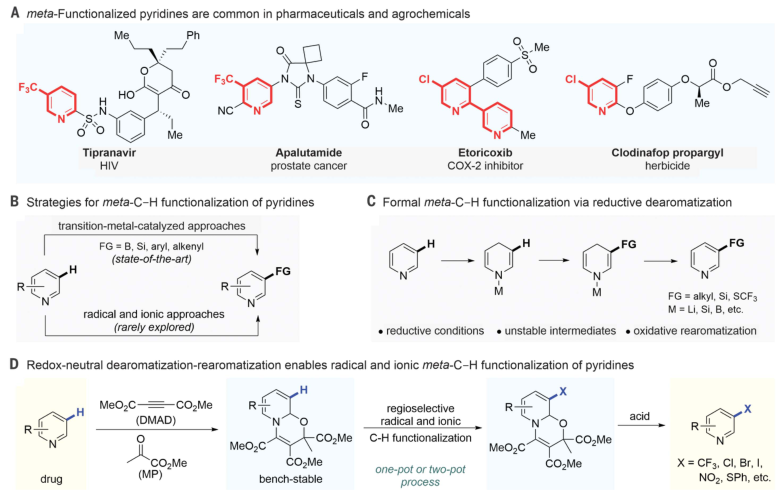
吡啶(C5H5N)是制造广泛的化学物质的出发点,包括用于药物发现、催化和材料科学的化学物质。它是由五个碳-氢(C-H)对和一个氮(N)原子组成的六边形环。取代吡啶中的氢是有机化学中的一个重要课题。卤化-用卤素原子取代这些氢可用作制备吡啶衍生物的中间步骤,因为与氢相比,卤素更容易被另一个原子或一组原子取代。此外,卤素取代基可以促进分子间相互作用,这些相互作用对于某些期望的功能(如与靶蛋白的结合)至关重要。吡啶的卤化可以通过与亲电化学品的反应来完成。这些亲电试剂是缺电子的,可以通过接受富含电子的化学物质的电子对形成化学键。
关键问题
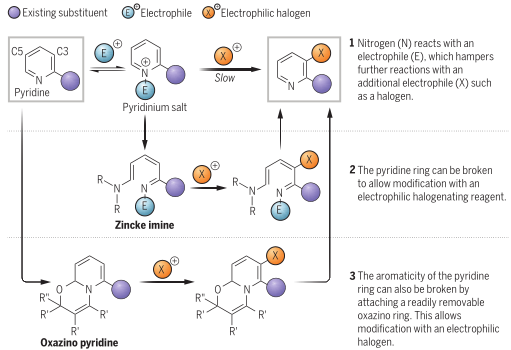
由于氮原子从环的碳原子吸引电子,碳原子本身缺乏电子,因此不容易与亲电试剂反应。氮原子优先与亲电试剂反应以形成相应的吡啶鎓盐,其比吡啶更贫电子,因此不太可能与亲电卤素物种反应。卤化反应需要苛刻的反应条件,通常包括强酸和高温,以生成非常强的亲电试剂,从而实现反应,这限制了可使用的反应物和可生成的产物的范围。取代发生时很难控制哪个或者哪几个位置被取代。此外,一些取代基可以改变吡啶环的电子和结构特征,可能降低环上反应的位置选择性。某些产品需要吡啶在与其他芳环(例如具有离域电子的芳环)一起放置时发生反应,这些芳环会与芳香吡啶环竞争卤化。现有的碱介导或者使用中间体等手段虽然可以避免使用强亲电试剂,但这些策略的要求会限制可能取代基的范围。
新思路
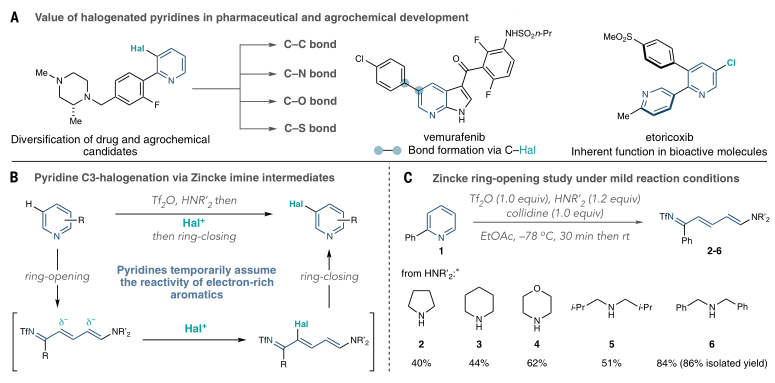
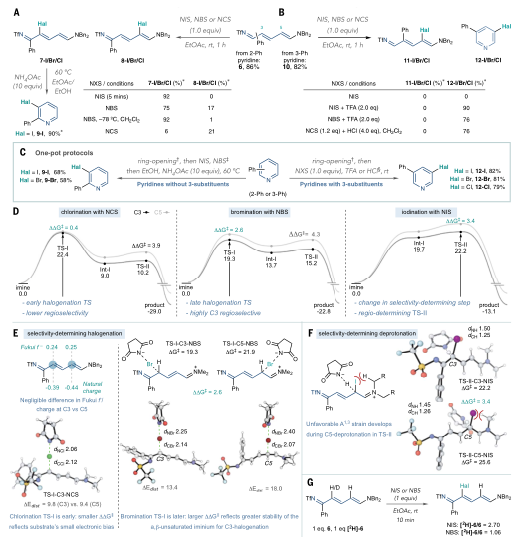
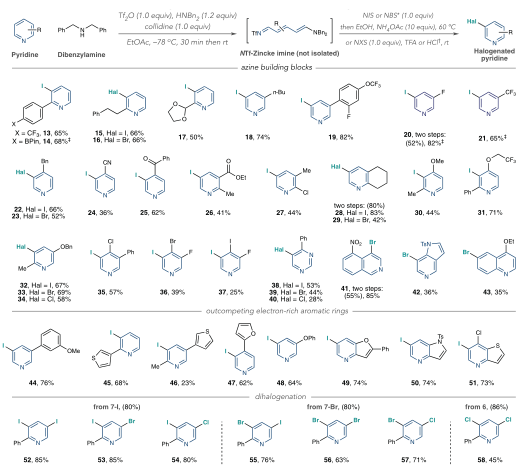
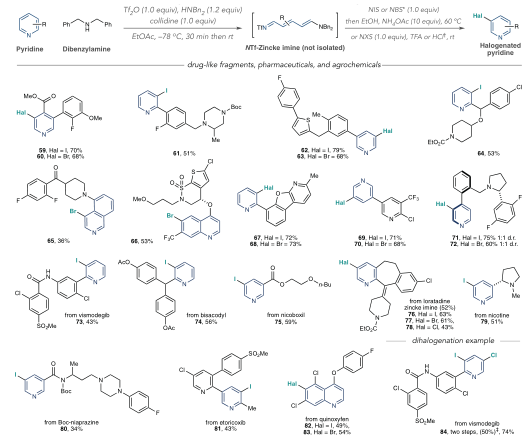
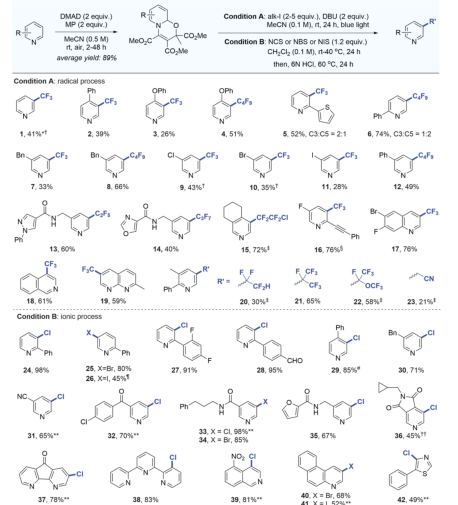
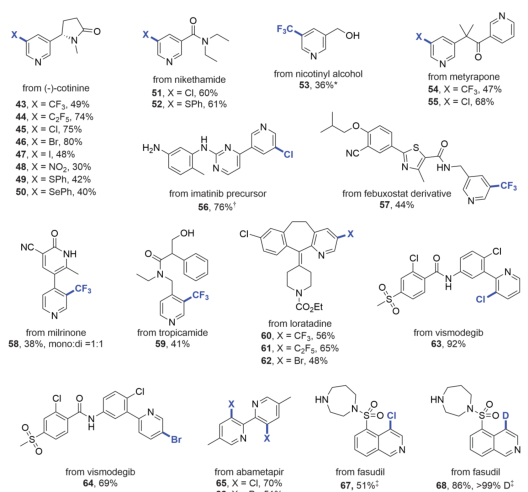
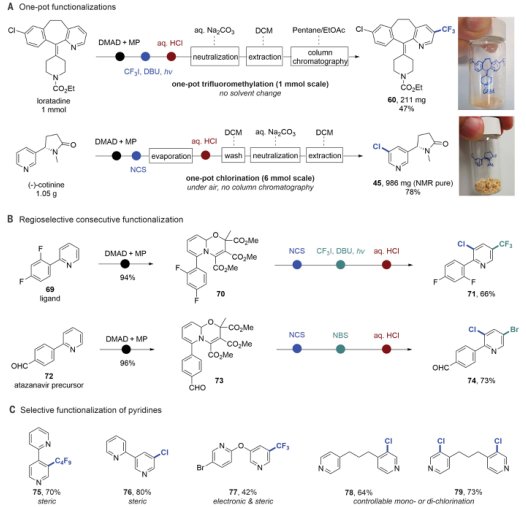
有鉴于此,科罗拉多州立大学Andrew McNally等人开发了一种策略,将缺乏电子的吡啶转化为富含电子的分子,使其能够与具有高位置选择性的亲电卤化试剂反应。作者采用Zincke反应,通过使用亲电试剂三氟甲磺酸酐[(CF3SO2)2O]和胺添加剂二苄胺[(C6H5CH2)2NH)],吡啶的碳原子上插入取代基,以生产富含电子的Zincke亚胺中间体,然后环闭合以再生吡啶环,且不存在Zincke亚胺中间体的分解。这种开环、卤化和闭合环的反应顺序使作者能够合成几种不同的C3卤代吡啶衍生物。无独有偶,德国威廉姆斯学院Hui Cao等人采取了不同的方法,通过将吡啶转化为富含电子的恶嗪诺(C4N1O1)吡啶中间体来实现相同的吡啶卤代。恶嗪基吡啶可以与自由基物种以及与亲电试剂反应,以用另一个原子或一组原子取代氢。与McNally等人所述的中间体类似,恶唑啉基吡啶中间体的形成已得到充分研究,但尚未探索其在吡啶官能化中的应用潜力。Cao等人使用了廉价的试剂,包括乙炔二甲酸二甲酯和丙酮酸甲酯,以破坏芳构化反应。通过连接一个容易移除的恶嗪环创建了稳定的中间体,作者使用一系列试剂证明了其方法的兼容性,包括三氟甲基(CF3)、全氟烷基(CnF2n+1)、卤素(氯、溴和碘)、硝基(NO2)、硫基(SC6H5)和硒基(SeC6H5)供体。在取代后,通过酸处理除去附着的恶嗪诺环,得到最终产物。上述两项工作均在11月17日发表于Science。作者提出了一种吡啶卤化的替代方法,使用“一锅法”完成吡啶开环、卤化、闭环策略,并证实该方法的高产率和高选择性。将一系列吖啶构建嵌段型化合物应用于一锅卤化反应,证实了该方法与在2位具有芳基、烷基和缩醛取代基的吡啶、4位具有苄基、氰基和酮取代基的吡啶以及一系列2,3-、2,4-和2,5-二取代吡啶以及3, 4-二取代体系的可行性。作者通过该方案成功地卤化了多种药物和农用化学品,证明了其在后期功能化中的效用。 作者通过将脱芳基化-再芳基化策略与三氟甲基自由基化学相结合,实现了吡啶的形式化直接偏选择性三氟甲基化。作者证明了开发的氧化还原中性脱芳基化功能化再芳基化策略对12种具有不同取代模式的药物和药物衍生物以良好的产率进行了不同的间选择功能化,并在更大范围内证实了该方法的实用性和稳定性。这两项工作开发的方法可以在“一锅”过程中进行,该过程只需要连续添加试剂,而不需要改变反应容器。这两种方法都对吡啶环的卤化表现出高选择性。作者开发的方法对吡啶环内的C3位置具有高选择性。尽管两种合成的中间体中都存在C3和C5两个富含电子的位置,但C3优先取代C5,除非当C3上已经存在取代基。这两种方法也允许顺序卤化,这会在环中产生具有两个卤原子的吡啶,首先是C3,然后是C5。
技术细节
作者提出了一种吡啶卤化的替代方法,使用开环、卤化、闭环策略。这种“一锅”方案在经典的Zincke开环反应基础上进行改进,该反应将吡啶转化为氮三烯中间体,或“Zincke亚胺”。这种合成方法将吡啶从缺电子杂环暂时转化为一系列极化烯烃,这些烯烃经历亲电取代反应,很像富含电子的芳烃。卤化过程在一系列取代吡啶中是3-选择性的,并且在功能上与具有药用价值的复杂结构兼容。基于以上策略,作者探究了卤化3-取代亚胺的历程,证实了Zincke亚胺的高产率和高选择性,且证实了一锅法完成上述步骤的可行性。此外,作者通过理论计算解析了亲电加成和脱质子化步骤的反应过程。图 吡啶卤化反应的重要性和基于开环中间体的独特策略将一系列吖啶构建嵌段型化合物应用于一锅卤化反应,由于其方便的室温C–I键形成步骤,因此对大多数底物选择碘化。该方法与在2位具有芳基、烷基和缩醛取代基的吡啶兼容,并且酸介导的条件对一系列吡啶有效。作者证实了在4位具有苄基、氰基和酮取代基的吡啶也是有效的底物。然后,卤化了一系列2,3-、2,4-和2,5-二取代吡啶以及3, 4-二取代体系,并展示了卤化机理和相应的光谱证据。作者还测试了卤化Zincke亚胺中间体是否能胜过相邻的富电子芳香环,以及二卤化过程的可行性。结果表明,虽然一锅法不成功,但能够分离出Zincke亚胺,并对它们进行第二轮卤化,导致二卤代吡啶的各种排列。这项研究的最后阶段集中于卤化复杂药物如中间体、药物和农用化学品。这些结构通常包含多个(杂)芳烃、反应性位点和路易斯碱性原子,因此对开环、卤化和关环过程构成了重大的合成挑战。然而,这一努力的成功将使后续的聚合偶联反应、化合物多样化和后期功能化努力成为可能。作者通过卤化代表类药物中间体的五个多环结构,获得了作为单区域异构体的卤化产物的产率。该方案成功地卤化了多种药物和农用化学品,证明了其在后期功能化中的效用。作者分析了现有方法进行吡啶官能化的局限性,提出了一种通过氧化还原中性脱芳基化-再芳基化过程实现吡啶、喹啉和异喹啉多用途和实用的间-C–H官能化的方案。可以在温和条件下实现完全间位选择性的C–H官能化,以形成三氟甲基、全氟烷基、氯、溴、碘、硝基、硫和硒代N-杂芳烃。作者首先评估了吡啶的氧化还原中性脱芳基化和再芳基化的反应条件,发现区域选择性C的重排−H官能化的恶嗪基吡啶中间体在60°C的含水酸中很容易以定量产率获得。作者通过将脱芳基化-再芳基化策略与三氟甲基自由基化学相结合,实现了吡啶的形式化直接偏选择性三氟甲基化。后功能化能够快速修饰药物、候选药物和材料,而无需从头合成。作者证明了开发的氧化还原中性脱芳基化功能化再芳基化策略是含吡啶部分药物直接后期修饰的实用方法。12种具有不同取代模式的药物和药物衍生物以良好的产率进行了不同的间选择功能化。为了证明该方法在药物和过程化学中的实用性和稳定性,作者在更大范围内展示了一锅反应,证实了该方法在氯雷他定、(-)-可替宁、阿扎那韦前体等合成反应中的可行性。即使对于在相同化学环境中含有吡啶的化合物,受控的单脱芳基化和二脱芳基可以分别以高产率产生相应的单氯化和二氯化产物。
展望
总之,这两项技术为探索吡啶官能化提供了机会。吡啶相对于其他富电子芳香环的优先卤化具有高的位置选择性,消除了在合成的早期阶段必须生成含卤素吡啶以防止所有芳香环卤化的限制。此外,选择性卤化可以与碳-卤素键的多样化结合,生成具有不同取代基的吡啶衍生物。除了亲电的卤化试剂,其他通常不适应吡啶官能化的亲电试剂现在也可以被考虑。生产具有广泛可插入取代基的活性中间体推动了优化候选药物和有机功能材料的创造进展,这在过去是无法实现的。JUNG MIN JOO. Adding functions to pyridines. Science, 2022, 378(6621):710-711.DOI: 10.1126/science.ade5501https://www.science.org/doi/10.1126/science.ade5501BENJAMIN T. BOYLE, et al. Halogenation of the 3-position of pyridines through Zincke imine intermediates. Science, 2022, 378(6621):773-779.DOI: 10.1126/science.add8980.https://www.science.org/doi/10.1126/science.add8980HUI CAO, et al. Radical and ionic meta-C–H functionalization of pyridines, quinolines, and isoquinolines. Science, 2022, 378(6621):779-785.DOI: 10.1126/science.ade6029.https://www.science.org/doi/10.1126/science.ade6029